槲皮素对糖尿病大鼠视网膜病变的抗氧化作用及其机制
王冬艳,彭建明,季 琰,罗惠媛,叶记林
视网膜病变包括黄斑水肿、玻璃体腔出血和视网膜新生血管性青光眼,严重影响患者的视力,糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病的严重慢性并发症,也是患者失明的主要原因之一[1]。长期高血糖导致蛋白激酶C、糖化血红蛋白和多元醇代谢物增加,影响视网膜生理功能,引发氧化应激损伤[2]。高糖培养的糖尿病大鼠模型和人视网膜色素上皮均显示视网膜脂质过氧化物明显增加,抗氧化酶降低。有研究表明通过抗氧化和抗炎作用可以减轻糖尿病大鼠视网膜损伤[3]。
槲皮素(Quercetin,QUE)是黄酮类化合物,在许多中药如菟丝子和毛丹皮中常见,具有神经保护、抗氧化、抗炎、清除自由基等多种药理活性,目前,QUE 对糖尿病患者和糖尿病动物模型的糖脂代谢调节和抗氧化作用已受到广泛关注[4]。该研究建立糖尿病大鼠模型,观察QUE 对糖尿病大鼠视网膜的保护作用,并初步探讨其作用机制。
1 材料与方法
1.1 材料QUE (成都必特生物科技有限公司,批号 110878-201611,纯度≥98%);4%多聚甲醛和2.5%戊二醛 (北京索拉比奥生命科学技术有限公司);1%骨微酸(上海哈林生物科技有限公司);枸橼酸铅和2%醋酸铀酰 (上海荣创生物科技有限公司);手术显微镜(德国莱卡,型号:M525F40);微体(德国莱卡,型号:EMUC7);倒置生物显微镜(上海光学仪器厂,型号:37X F);电泳仪(北京刘毅生物科技有限公司。模型:DYCZ-40D);苏木精-伊红染色(武汉博希德生物工程有限公司);BCA 蛋白检测试剂盒、裂解液、PVD F 膜和化学发光试剂、Bcl-2、Bax 和P53 抗体(上海贝约时间生物技术)。
1.2 方 法
1.2.1 动物造模及给药 取40 只清洁雄性SD 大鼠(来自南京医科大学动物中心),体重(160±20)g。随机分为正常对照组(Normal)、糖尿病组(Model)、低剂量 QUE 组(QUE-L)和高剂量 QUE 组(QUEH),每组 10 只。所有大鼠自适应喂养 1 周。糖尿病组、QUE 低剂量组和高剂量组大鼠禁食12 h 后腹腔注射60 mg/kg 链脲佐菌素,建立糖尿病模型。正常对照组大鼠注射等量生理盐水,在72 h 后,用自动血糖分析仪测量尾静脉血糖,并将>16.7 mmol/L 的作为成功的糖尿病模型。造模成功后第2 天开始,QUE 组每天腹腔注射QUE,低剂量组10 mg/kg,高剂量组50 mg/kg。正常对照组和糖尿病组大鼠不接受治疗,持续12 周。
1.2.2 视网膜病变的取材及观察 末次给药后,给大鼠服用过量的麻醉剂。在立体显微镜下无菌摘除右眼球,分离视网膜组织,HE 染色:4%多聚甲醛固定24 h,染色苏木精5~10 min,用蒸馏水冲洗后,用伊红染色5~10 min,用蒸馏水再次冲洗玻片,用梯度乙醇溶液脱水后,观察视网膜病理变化。
1.2.3 视网膜组织SOD 和MDA 水平 分别取每组视网膜组织50 μg,研磨成组织匀浆,低速离心(2000 r/min),再取上清液。按试剂盒说明书加入样品,混匀。用黄嘌呤氧化酶法检测SOD 和MDA 水平。
1.2.4 Western Blot(WB)对 Bcl-2、Bax 和 P53 蛋白表达水平的影响 取视网膜组织50 μg,在冰上加入含有蛋白酶抑制剂的裂解液400 μl,研磨30 min提取总蛋白,在10000 r/min 下离心10 min 取上清液,进行10%SDS-聚丙烯酰胺凝胶电泳;跨膜后,用5%脱脂奶粉在4 ℃下阻滞2 h,加入一次抗体(稀释比 1∶1000),过夜保存。将二次抗体(稀释 1∶2000)室温孵育1 h。利用ECL 化学发光进行自我开发,获取图像。通过样品靶蛋白的光密度与内参带光密度的比值,比较不同样品的相对表达率。
1.3 统计分析用SPSS 20.0 统计软件分析数据。计量数据以(±s)表示。组间比较采用单向方差分析。具有方差齐性的2 组比较采用LSD-t 检验。
2 结 果
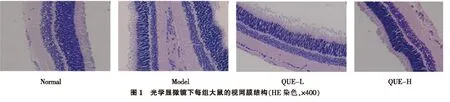
2.1 大鼠视网膜形态学变化正常对照组大鼠视网膜组织结构清晰,内外核层细胞排列规则; 糖尿病大鼠视网膜组织层分辨率差,神经纤维层水肿,内外核层排列松散; 低剂量组视网膜细胞基本分层,细胞排列良好,内外核层轻度紊乱;高剂量组与低剂量组相比,大鼠视网膜组织结构进一步改善。如图1 所示。
图1 见封三。
2.2 大鼠视网膜组织SOD 和MDA 水平糖尿病大鼠视网膜组织SOD 水平显著降低,MDA 水平显著升高(P<0.05)。低剂量 QUE 组和高剂量 QUE 组SOD 水平显著升高,MDA 水平显著降低 (P<0.05)。见表1。
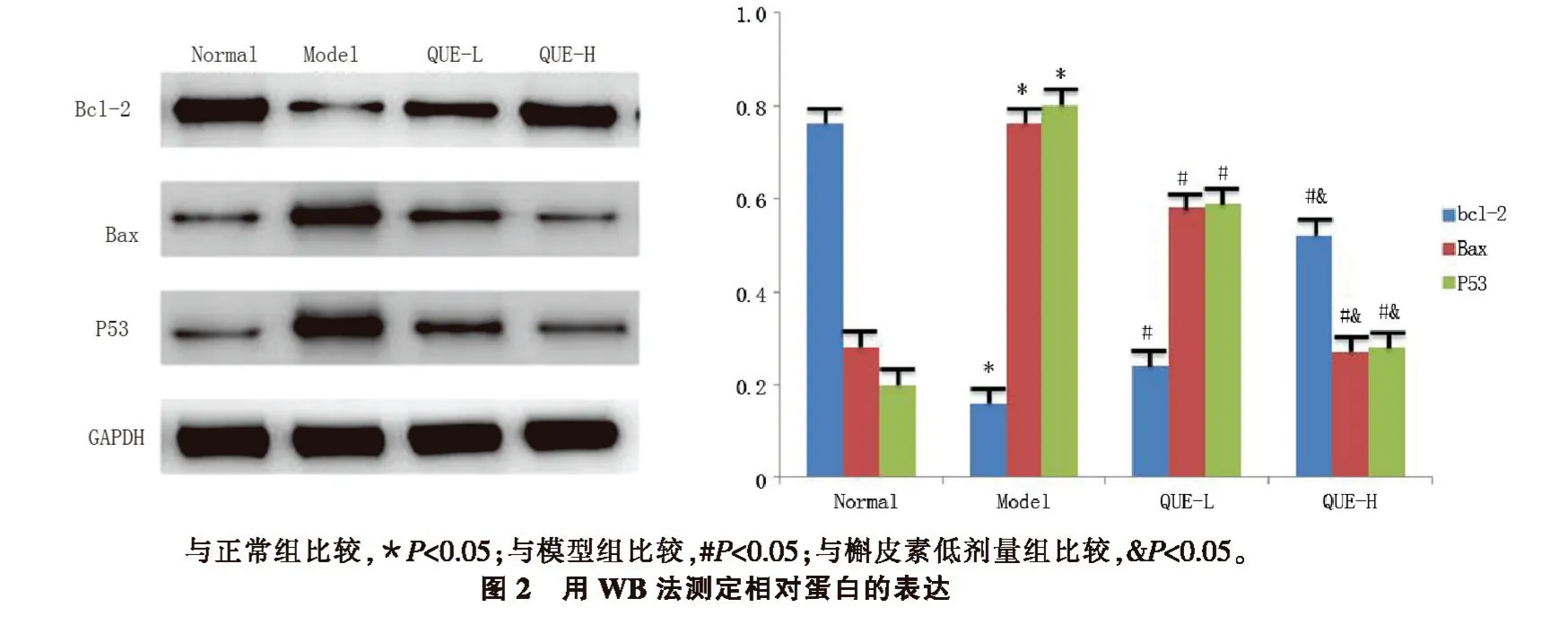
2.3 大鼠视网膜组织凋亡蛋白表达水平糖尿病大鼠视网膜组织中Bcl-2 蛋白表达明显降低,Bax和 P53 明显升高(P<0.05)。低剂量和高剂量 QUE 组Bcl-2 蛋白表达显著增加,高剂量QUE 组Bax 和P53 蛋白表达显著降低(P<0.05)。见图2。
表1 各组大鼠视网膜组织SOD 和MDA 水平(±s)
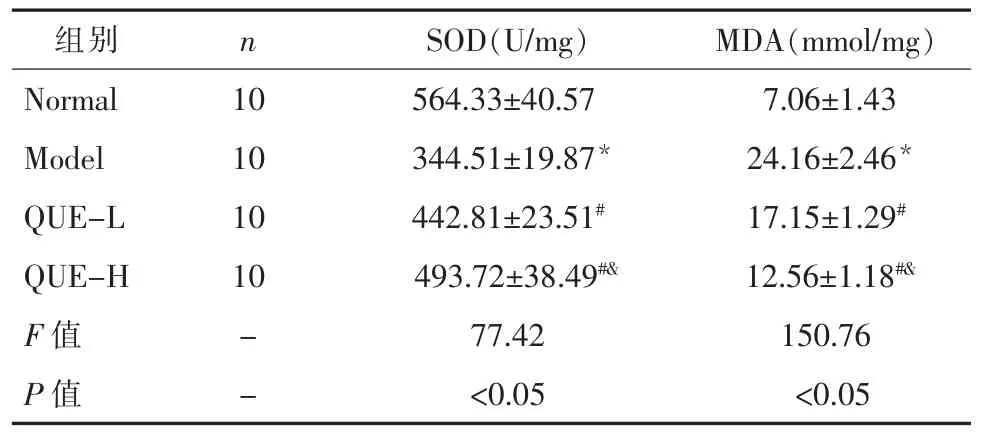
表1 各组大鼠视网膜组织SOD 和MDA 水平(±s)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05;与 QUEL 组比较,&P<0.05。
组别Normal Model QUE-L QUE-H F 值P 值n 10 10 10 10--SOD(U/mg) MDA(mmol/mg)564.33±40.57 7.06±1.43 344.51±19.87* 24.16±2.46*442.81±23.51# 17.15±1.29#493.72±38.49#& 12.56±1.18#&77.42 150.76<0.05 <0.05
图2 见封三。
3 讨 论
糖尿病微血管并发症主要包括DR 和糖尿病肾病。根据视网膜是否形成新生血管分为非增殖期糖尿病视网膜病变(NPDR)和增殖性糖尿病视网膜病变 (PDR)。NPDR 有微血管损伤,出现毛细血管扩张和渗漏、棉絮斑、硬性渗等视网膜内微血管异常病变[5]。若未予治疗,可演变为增殖期,形成新生血管、玻璃体积血或前视网膜出血,造成患者视力严重下降,增加失明风险。对于DR 的发生现普遍认为高血糖、胰岛素抵抗、遗传因素是主要致病主要因素。葡萄糖的过度转运改变视网膜细胞的生理作用,糖代谢障碍引起毛细血管基底膜增厚、内皮细胞增生以及视网膜血流量的自我调节机制受损伤。高血糖时,自由基产生过多,抗氧化系统负荷过重,从而损伤内皮细胞、引起血管渗出、刺激新生血管生成等[6]。
视网膜由视网膜神经上皮和视网膜色素上皮(RPE)组成,任何原因引起的RPE 损伤都会对视觉功能产生不可逆转的影响。糖尿病患者视网膜组织中的氧化应激水平增加,影响视网膜神经上皮和RPE 层的正常生理功能,视网膜对氧化应激高度敏感[7]。高糖时神经细胞增殖活性受抑制,研究表明,QUE 可提高被抑制的神经上皮细胞的增殖活性,减少氧化应激损伤[8]。QUE 亦可通过去除体内和体外模型的 ROS 来抑制炎症小体的激活[9]。该研究结果表明,QUE 干预的糖尿病大鼠视网膜形态结构优于糖尿病大鼠。糖尿病大鼠视网膜组织层分辨率差,神经纤维层水肿,内丛状层、内外核层排列疏松。经过QUE 干预后,视网膜各层细胞排列更加规则。
SOD 和MDA 是人体主要的抗氧化酶,SOD 与自由基清除呈正相关,MDA 含量可反映自由基水平。该研究证实,QUE 干预糖尿病大鼠可提高SOD水平,降低MDA 含量,从而减少病理条件下组织氧化损伤。
细胞凋亡为细胞死亡的特殊类型,是一种基本生物学现象。研究表明Bax/Bcl-2 和P53 蛋白是调控细胞凋亡的关键蛋白,在氧化应激介导的细胞凋亡反应中,Bcl-2 起着重要的作用,是调节线粒体凋亡途径的重要分子,具有潜在的抗凋亡作用。而Bax和P53 的表达水平直接反映了细胞凋亡的程度。糖尿病组大鼠视网膜组织中Bcl-2 蛋白减少,Bax 和P53 蛋白增加,表明链脲佐菌素可诱导组织凋亡。在QUE 干预后,Bcl-2 表达增加,Bax 和 P53 表达降低,进一步证实QUE 可抑制高糖诱导的视网膜组织凋亡。

