乌司奴单抗治疗中-重度活动性克罗恩病疗效和安全性的Meta分析
宋阿倩, 丁 鹏, 郭浩然, 周秀彦
1.山西医科大学,山西 太原 030001;2.山西医科大学第二医院消化内科
克罗恩病(Crohn’s disease,CD)是一种慢性炎性肉芽肿性疾病,多见于末段回肠和邻近结肠,但从口腔至肛门各段消化道均可受累,呈节段性或跳跃性分布。临床以腹痛、腹泻、体质量下降、腹块、瘘管形成和肠梗阻为特点,可伴有发热等全身表现以及关节、皮肤、眼、口腔黏膜等肠外损伤。重症患者迁延不愈,预后不良。我国流行病学资料显示,CD在我国仍属少见病,但近20余年来其就诊人数呈快速上升趋势[1]。目前CD的治疗药物有5-氨基水杨酸、糖皮质激素、免疫抑制剂、抗菌药物、抗TNF-α单克隆抗体等。尽管目前存在多种治疗CD的方法,但大部分患者对常规药物无反应,约1/3的患者对TNF拮抗剂治疗失败[2],且高达40%的最初受益的患者随后失去反应[3]。中和细胞因子IL-12和IL-23已经成为一种有希望的新策略。乌司奴单抗(Ustekinumab)是一种针对IL-12和IL-23共有的p40亚单位的人IgG1-κ单克隆抗体,已成为治疗银屑病和CD的新方法[4]。国内尚未应用乌司奴单抗治疗活动性CD,本研究将10个乌司奴单抗治疗中-重度活动性CD的随机对照试验(RCTs)按照Cochrane系统评价的要求,对疗效和安全性进行Meta分析,以期为临床应用提供循证医学依据。
1 资料与方法
1.1 一般资料检索PubMed、Embase、Cochrane Library数据库;检索词(包括主题词和自由词):“Crohn Disease”,“Crohn’s Disease”,“Crohns Disease”,“Crohn’s Enteritis”,“Inflammatory bowel disease”,“Ustekinumab”,“Stelara”,“CNTO 1275”,“CNTO-1275”;检索年限:建库至2020年1月;检索语言仅限英文。逐一阅读所有符合条件的研究及其参考书目,以确定相关研究。
1.2 方法
1.2.1 文献纳入标准:(1)为RCTs;(2)研究对象年龄>18岁,结合临床表现、实验室检查、内镜检查、影像学检查和病理组织学检查及CD活动指数(CDAI,<150分为缓解期,≥150分为活动期,其中150~220分为轻度,221~450分为中度,>450分为重度)[5]进行综合分析,临床确诊为中-重度活动性CD的患者;(3)治疗组使用乌司奴单抗,对照组使用安慰剂,剂量和给药方式不限,无论是否有常规药物或TNF拮抗剂使用史;(4)治疗组和对照组之间具有可比性;(5)明确描述至少一项结局指标,如诱导期或维持期临床反应率、临床缓解率、不良事件反生率等。
1.2.2 文献排除标准:(1)重复性文献;(2)综述或病例报道;(3)研究对象为非乌司奴单抗或溃疡性结肠炎,无对照组或对照组为非安慰剂;(4)数据不完整文献;(5)结局指标中未含临床反应或临床缓解。
1.2.3 文献质量评价与资料提取:所有被纳入的RCTs文献均由2名评价员独立进行评价,如有分歧则请第3名评价员协助决定是否纳入。纳入的文献均按照Jadad量表对RCTs进行质量评价。改良后的Jadad量表(1~3分视为低质量,4~7分视为高质量):(1)随机序列的产生(0~2分);(2)随机化隐藏(0~2分);(3)盲法(0~2分);(4)撤出与退出(0~1分)。提取资料内容包括作者姓名、发表时间、干预措施、对照措施、结局指标、研究结果等。对于数据不全的研究与原文作者取得联系进行补充。
1.3 统计学处理采用Revman 5.3软件进行Meta分析,结果以森林图呈现。对纳入研究首先进行异质性判断,计数资料以OR及其95%CI表示,P<0.05为差异有统计学意义。异质性检验采用Q统计量检验和由Cochrane手册的评价系统所定义的I2检验[6],若纳入研究间无异质性(P>0.1,I2≤50%),则使用固定效应模型,若纳入研究间有异质性(P<0.1,I2>50%),则使用随机效应模型,同时进行亚组分析、灵敏性分析排除能引起异质性的研究,再进行Meta分析。应用Stata 14.0进行发表偏倚检验,以P<0.05为存在发表偏倚,若存在发表偏倚则采用剪补法对结果进行校正。
2 结果
2.1 检索结果从PubMed、Embase、Cochrane Library数据库检索获得共145篇文献。剔除重复文献后获得126篇文献,通过阅读文题和摘要后获得50篇,最后通过阅读全文纳入10篇文献,其中诱导期治疗文献8篇[7-14],共8 052例患者,维持期治疗文献8篇[7-10,13-16],共2 484例患者。文献筛选流程图及结果如图1所示。
2.2 纳入研究一般特征8篇诱导期治疗文献分为乌司奴单抗组和安慰剂组,其中经历TNF-拮抗剂治疗失败文献有6篇[7-12],经历常规治疗失败文献有5篇[7-11]。治疗方式为静脉注射乌司奴单抗或安慰剂,乌司奴单抗剂量为1 mg/kg、3 mg/kg、6 mg/kg或130 mg,研究持续时间8周,纳入研究的基本特征如表1所示。
8篇维持期治疗文献分为乌司奴单抗组和安慰剂组,治疗方式为皮下注射乌司奴单抗或安慰剂,乌司奴单抗剂量为90 mg,每8周1次或12周1次或16周1次,研究持续时间最长48周,纳入研究的基本特征如表2所示。

图1 文献筛选流程图Fig 1 Literature screening flow chart

表1 诱导期纳入文献一般特征Tab 1 General characteristics of the included literatures during the induction period
2.3 Meta分析结果
2.3.1 诱导期:(1)临床反应率:纳入6项研究[7-10,12-13]比较了诱导期使用乌司奴单抗和安慰剂治疗中-重度活动期CD的临床反应率,各个RCTs间无异质性(P=0.26,I2=23%),采用固定效应模型,乌司奴单抗组临床反应率为43%(1 883/4 335),安慰剂组临床反应率为25%(532/2 097),Meta分析结果显示,乌司奴单抗在诱导中-重度活动期CD的临床反应疗效方面优于安慰剂(OR=2.36,95%CI:2.09~2.65,P<0.00001)(见图2)。对纳入的研究采用Stata 14.0进行Begg和Egger检验,结果显示,Begg和Egger检验P值分别为0.260和0.441,提示不存在发表偏倚。
(2)临床反应率亚组分析:5项研究[7-10,12]比较了乌司奴单抗和安慰剂治疗经历TNF-拮抗剂治疗失败中-重度活动期CD的临床反应率,各个RCTs间无异质性(P=0.20,I2=34%),采用固定效应模型,乌司奴单抗组临床反应率为39%(899/2 324),安慰剂组临床反应率为24%(273/1 161),Meta分析结果显示,乌司奴单抗在诱导既往TNF-拮抗剂治疗失败中-重度活动期CD的临床反应疗效方面优于安慰剂(OR=2.13,95%CI:1.81~2.50,P<0.00001)(见图3)。

表2 维持期纳入文献一般特征Tab 2 General characteristics of the included literatures during the maintenance period
4项研究[7-10]比较了乌司奴单抗和安慰剂治疗经历常规治疗失败中-重度活动期CD的临床反应率,各个RCTs间无异质性(P=0.66,I2=0),采用固定效应模型,乌司奴单抗组临床反应率为39%(839/1 617),安慰剂组临床反应率为24%(228/804),Meta分析结果显示,乌司奴单抗在诱导既往常规治疗失败中-重度活动期CD的临床反应疗效方面优于安慰剂(OR=2.87,95%CI:2.38~3.45,P<0.00001)(见图4)。
(3)临床缓解率:纳入5项研究[7,9-10,12-13]比较了诱导期使用乌司奴单抗和安慰剂治疗中-重度活动期CD的临床缓解率,各个RCTs间无异质性(P=0.54,I2=0),采用固定效应模型,乌司奴单抗组临床缓解率为16%(562/3 419),安慰剂组临床缓解率为8%(137/1 641),Meta分析结果显示,乌司奴单抗在诱导中-重度活动期CD的临床缓解疗效方面优于安慰剂(OR=2.27,95%CI:1.85~2.77,P<0.00001)(见图5)。对纳入的研究采用Stata 14.0进行Begg和Egger检验,结果显示,Begg和Egger检验P值分别为0.806和0.790,提示不存在发表偏倚。
(4)临床缓解率亚组分析:4项研究[7,9-10,12]比较了乌司奴单抗和安慰剂治疗经历TNF-拮抗剂治疗失败中-重度活动期CD的临床缓解率,各个RCTs间无异质性(P=0.91,I2=0),采用固定效应模型,乌司奴单抗组临床缓解率为15%(275/1 826),安慰剂组临床缓解率为8%(70/914),Meta分析结果表示,乌司奴单抗在诱导既往TNF-拮抗剂治疗失败中-重度活动期CD的临床缓解疗效方面优于安慰剂(OR=2.27,95%CI:1.71~3.02,P<0.00001)(见图6)。
3项研究[7,9-10]比较了乌司奴单抗和安慰剂治疗经历常规治疗失败中-重度活动期CD的临床缓解率,各个RCT间无异质性(P=0.54,I2=0),采用固定效应模型,乌司奴单抗组临床缓解率为19%(229/1 199),安慰剂组临床缓解率为9%(54/595),Meta分析结果表示,乌司奴单抗在诱导既往常规治疗失败中重度活动期CD的临床缓解疗效方面优于安慰剂(OR=2.53,95%CI:1.82~3.50,P<0.00001)(见图7)。
(5)内镜缓解率:纳入2个研究[11,14]比较了诱导期使用乌司奴单抗和安慰剂治疗中-重度活动期CD的内镜缓解率,各个RCTs间无异质性(P=0.48,I2=0),采用固定效应模型,乌司奴单抗组临床反应率为13%(135/1 067),安慰剂组临床反应率为5%(26/553),Meta分析结果显示,乌司奴单抗在诱导中-重度活动期CD的内镜缓解疗效方面优于安慰剂(OR=2.90,95%CI:1.88~4.48,P<0.00001)(见图8)。
(6)黏膜愈合率:1项研究[14]比较了诱导期使用乌司奴单抗和安慰剂治疗中-重度活动期CD的黏膜愈合率,乌司奴单抗组黏膜愈合率为9%(14/155),安慰剂组黏膜愈合率为4%(4/97),该研究认为乌司奴单抗在诱导中-重度活动期CD的黏膜愈合疗效方面优于安慰剂。

图2 乌司奴单抗和安慰剂诱导期临床反应率

图3 TNF-拮抗剂治疗失败乌司奴单抗和安慰剂诱导期临床反应率

图4 常规治疗失败乌司奴单抗和安慰剂诱导期临床反应率

图5 乌司奴单抗和安慰剂诱导期临床缓解率

注:*:文献缺少例数未提及。图6 TNF-拮抗剂治疗失败乌司奴单抗和安慰剂诱导期临床缓解率

图7 常规治疗失败乌司奴单抗和安慰剂诱导期临床反应率
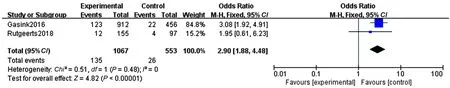
图8 乌司奴单抗和安慰剂诱导期内镜缓解率
2.3.2 维持期:(1)临床缓解率:纳入7项研究[7-10,13,15-16]比较了维持期使用乌司奴单抗和安慰剂治疗缓解期CD的临床缓解率,各个RCTs间无异质性(P=0.86,I2=0),采用固定效应模型,乌司奴单抗组临床反应率为41%(641/1 570),安慰剂组临床反应率为27%(227/844),Meta分析结果表示,乌司奴单抗在维持缓解期CD的临床缓解疗效方面优于安慰剂(OR=1.97,95%CI:1.63~2.38,P<0.00001)(见图9)。对纳入的研究采用Stata 14.0进行Begg和Egger检验,结果显示,Begg和Egger检验P值分别为0.652和0.879,提示不存在发表偏倚。
(2)临床反应率:纳入5项研究[7,9-10,13,15]比较了维持期使用乌司奴单抗和安慰剂治疗缓解期CD的临床反应率,各个RCTs间无异质性(P=0.28,I2=21%),则采用固定效应模型,乌司奴单抗组临床反应率为55%(570/1 033),安慰剂组临床反应率为38%(218/571),Meta分析结果显示,乌司奴单抗在维持缓解期CD的临床反应疗效方面优于安慰剂(OR=2.09,95%CI:1.69~2.59,P<0.00001)(见图10)。对纳入的研究采用Stata 14.0进行Begg和Egger检验,结果显示,Begg和Egger检验P值分别为0.086和0.050,未存在明显发表偏倚。
(3)黏膜愈合率:1项研究[14]比较了维持期使用乌司奴单抗和安慰剂治疗缓解期CD的黏膜愈合率,乌司奴单抗组黏膜愈合率为13%(6/46),安慰剂组黏膜愈合率为4%(1/24),该研究认为乌司奴单抗在维持缓解期CD的黏膜愈合疗效方面优于安慰剂。

图9 乌司奴单抗和安慰剂维持期临床缓解率

注:*:文献缺少例数未提及。图10 乌司奴单抗和安慰剂维持期临床反应率
2.4 不良反应纳入3项RCTs[8,13-14]比较了乌司奴单抗组和安慰剂治疗中-重度活动性CD的不良反应,分为诱导期和维持期。
2.4.1 诱导期不良反应:诱导期不良反应如表3所示,各RCTs间在治疗诱发的不良事件(P=0.58,I2=0)、严重不良事件(P=0.89,I2=0)、感染(P=0.98,I2=0)、严重感染(P=0.89,I2=0)等方面无异质性,则采用固定效应模型。Meta分析结果表示:在诱导期,乌司奴单抗在治疗诱发的不良事件、严重不良事件、感染及严重感染方面与安慰剂比较,差异无统计学意义。
2.4.2 维持期不良反应:维持期不良反应如表4所示,各RCTs间在治疗诱发的不良事件(P=0.90,I2=0)、严重不良事件(P=0.99,I2=0)、感染(P=0.96,I2=0)、严重感染(P=0.38,I2=0)等方面无异质性,采用固定效应模型。Meta分析结果显示:在维持期,乌司奴单抗在治疗诱发的不良事件、严重不良事件、感染及严重感染方面与安慰剂组比较,差异无统计学意义(P>0.05)。

表3 诱导期不良反应[例数(%)]

表4 维持期不良反应[例数(%)]Tab 4 Adverse reactions in the maintenance period [n(%)]
3 讨论
CD是以慢性胃肠道炎症为特征的复发性疾病,药物治疗的目标是控制病情活动、维持缓解及防治并发症,提高患者生活质量。随着时间的推移,药物治疗已经从使用非特异性免疫抑制剂发展到具有靶向活性的药物[17]。近年来的实验和临床研究表明[18],乌司奴单抗是一种针对IL-12和IL-23共有的p40亚单位的人IgG1-κ单克隆抗体,通过干扰信号传导、分化和细胞因子释放,亦可减少体外单核细胞分泌IFN-g和TNF-α影响CD的发生和发展,已于2016年获得美国FDA批准用于对常规治疗或TNF-α拮抗剂反应不足或不耐受或有医学禁忌证的中-重度活动性CD[19]。目前,乌司奴单抗尚未在我国用于治疗CD,因此,进行乌司奴单抗治疗中-重度CD的Meta分析具有重要意义。
本研究纳入10篇RCTs,结果显示,乌司奴单抗治疗中-重度活动性CD在诱导期(无论有无TNF-拮抗剂治疗失败或常规治疗失败)和维持期疗效均优于安慰剂。本研究还发现,在诱导期和维持期均有治疗诱发的不良反应,乌司奴单抗组与安慰剂组相比,发生率差异无统计学意义,但具体发生机制目前尚无定论。对感染和恶性肿瘤风险的关注是任何新型免疫抑制药物开发的重要因素,在本研究中感染主要有肛门脓肿、咽炎和外阴阴道念珠菌病等,严重感染有艰难梭菌感染、病毒性胃肠炎、尿路感染、肛门脓肿和阴道脓肿等,只有1个RCT在维持期有1例患者发生皮肤细胞基底癌,但样本数过少,尚不能表明乌司奴单抗恶性肿瘤发生风险。
本研究有严格的纳入标准和排除标准,在常用的英文文献数据库内共搜集到符合条件的10个RCTs,对纳入的研究均采用Jadad评分,保证文献均为高质量。本研究的局限性:(1)这些研究在设计上具有异质性,包括结局指标具体测量项目和随访时间等,可能对结果造成影响;(2)纳入的文献中存在会议摘要,可能会对文章质量产生影响;(3)所纳入数据均为已发表数据,忽略未发表数据,可能导致发表偏倚;(4)本研究所纳入文献均为英文文献,可能导致遗漏其他语种的研究。
综上所述,乌司奴单抗对中-重度活动性CD的诱导和维持缓解均有效,甚至可以达到黏膜愈合,但对于乌司奴单抗治疗中-重度活动性CD的远期疗效及不良反应的相关报道较少,需继续进行RCTs和长期随访,才能更好的证实乌司奴单抗的疗效和安全性。但乌司奴单抗作为新型生物制剂之一,我们相信在未来治疗CD上具有很好的前景。

