提取温度对青砖茶多糖组分含量与生物活性的影响 *
柯钦豪,王世越,王自瑶,周宏福,王 彩,郑 敏
(湖北科技学院,湖北 咸宁 437100)
青砖茶(qingzhuan dark tea)为一种黑茶,是我国传统边销砖茶之一,已有数百年生产历史,湖北省咸宁市为青砖茶的产地之一,咸宁市赤壁在2013年被中国茶叶流通协会正式命名为“中国青砖茶之乡”[1]。青砖茶减肥降脂、健脾和胃、安神及止泻的传统药用价值也已逐渐得到现代药理学试验的证实[2-4],有研究表明青砖茶还具有新的生物活性,如刘云涛等[5]发现青砖茶能改善2型糖尿病患者的胰岛素抵抗和脂质代谢;青砖茶多糖由青砖茶水提物经过高浓度乙醇沉淀而得到,为青砖茶水提物有效成分之一,能够竞争性抑制α-葡萄糖苷酶[6],还具有一定的抗氧化性[7]。具有抑制α-葡萄糖苷酶活性的物质能够抑制机体对单糖的吸收,稳定糖尿病患者的餐后血糖,对糖尿病患者起到一定的治疗作用,这说明青砖茶多糖具有治疗糖尿病的药用价值。
提取温度对青砖茶多糖得率、纯度及生物活性均有重要影响。张云天[8]通过响应面实验确定了提取时间3.3h,料液比1∶16g/mL,提取温度是95℃时,青砖茶多糖的得率最高,为11.03%。但没有不同提取温度对青砖茶多糖糖含量及生物活性影响的相关报道。本实验以青砖茶为原料,探究提取温度对青砖茶多糖组分含量和生物活性的影响。以期找到生物活性最好的青砖茶多糖的提取温度,为进一步开发和利用青砖茶提供科学依据。
1 材料与方法
1.1 材料与仪器
2008年生产的青砖茶,购自湖北省赵李桥茶厂有限责任公司;石油醚(60℃~90℃沸程)、乙醇、聚酰胺(100~200目)、氢氧化钠、对硝基苯-α-D-葡萄糖苷(PNPG)、α-葡萄糖苷酶(50U/mg)、二甲基亚砜(dimethyl sulfoxide,DMSO)等购自上海麦克林生化科技有限公司;1,1-二苯基-2-苦肼基(1,1-diphenyl-2-picrylhydrazyl,DPPH)购自梯希爱(上海)化成工业发展有限公司;1-苯基-3-甲基-5-吡唑啉酮(5-Methyl-2-phenyl-1,2-dihydropyrazol-3-one,PMP)等分析纯购自国药集团化学试剂有限公司;核糖、木糖、阿拉伯糖、鼠李糖、岩藻糖、甘露糖、葡萄糖、半乳糖、半乳糖醛酸、葡萄糖醛酸等色谱纯购自上海阿拉丁生化科技股份有限公司。
ME204E型精密电子天平,梅特勒公司;TGL-20M型高速低温离心机,沪康公司;N-1300型旋转蒸法仪,东京理化器械(株)独资工厂;LC-MS-8040型液相色谱-三重四级杆质谱联用仪、LC-20ADXR型二元梯度泵、SIL-20AC型自动进样器、CTO-20AC型柱温箱、CBM-20A型系统控制器,日本岛津公司;ELX800型酶标仪,美国Bio-Tek公司。
1.2 方法
1.2.1 多糖的除杂及提取
青砖茶粉碎过60目筛,80℃干燥至恒重。首先,除去干燥青砖茶里的脂质及小分子物质[9],称量一定质量的干燥青砖茶粉末和石油醚溶液,按料液比1∶10g/mL混匀,于60℃冷凝回流3h,然后抽滤,晾干滤渣;再用10倍体积80%乙醇,于80℃冷凝回流2h,以除去多酚、苷类等小分子物质,然后抽滤,晾干滤渣,得脱脂除小分子后的青砖茶。
多糖的提取:参照张云天[8]通过响应面实验确定的青砖茶粗多糖提取率最高的提取条件,不同之处为设置若干个提取温度,即分别取脱脂除小分子后的青砖茶,按料液比1∶16g/mL加入蒸馏水,于20℃、40℃、60℃、80℃及100℃热水冷凝回流提取3.3h,再分别离心(5 000rpm,10min)取上清,50℃真空旋蒸至1/5容积,然后加入无水乙醇至乙醇浓度为75%,4℃放置8h使多糖沉淀,再离心(5 000rpm,10min)取沉淀。沉淀加水复溶,再在50℃真空旋蒸以除去乙醇并浓缩多糖溶液,-45℃冻干,得到青砖茶粗多糖,计算青砖茶粗多糖得率:青砖茶粗多糖得率(%)=[粗多糖质量(g)/茶粉质量(g)]×100%。
1.2.2 青砖茶多糖的精制[10]
聚酰胺的预处理:通过预实验得知,10g聚酰胺预处理后的柱体积(bed volume,BV)约为45mL。称量一定质量的聚酰胺,按比例用4BV 95%的乙醇溶液浸泡聚酰胺8h,然后用超纯(ultrapure,UP)水洗至没有乙醇的味道,用2.5BV 5%NaOH的水溶液浸泡聚酰胺4h,用UP水洗至中性,用2.5BV 10%HCl的水溶液浸泡聚酰胺4h,再用UP水洗至中性,湿法上柱,得5个直径为26mm、高度为85mm的聚酰胺层析柱,每个层析柱用UP水以4.5mL/min平衡135mL。
青砖茶多糖的精制:用不同温度提取得到的青砖茶粗多糖配制10mg/mL的水溶液,超声5min促进多糖充分溶解,然后离心除去不溶物。分别取各多糖溶液20mL(即使用青砖茶粗多糖的质量为0.2g),上样到各个层析柱上,每个层析柱用225mL的UP水以4.5mL/min的速度洗脱,收集洗脱液,50℃真空旋蒸至约10mL容积,再-45℃冻干,得到青砖茶精制多糖TPS-20、TPS-40、TPS-60、TPS-80及TPS-100,计算精制多糖得率:青砖茶精制多糖得率(%)=青砖茶粗多糖得率(%)×[精制多糖质量(g)/青砖茶粗多糖质量(g)]×100%。
1.2.3 精制多糖糖含量的分析
多糖含量的分析依照国标SN/T 4260-2015号粗多糖的测定方法,即苯酚浓硫酸法,离心管里加入0.2mL浓度依次为0.1、0.2、0.3、0.4、0.5mg/mL葡萄糖的水溶液与0.2mL 5%苯酚的水溶液,混匀后加入1mL浓硫酸,避光静置10min,再30℃水浴20min,以0.2mL UP水加0.2mL 5%苯酚的水溶液再加入1mL浓硫酸为校零组在490nm处检验吸光度,再做吸光度-葡萄糖浓度标准曲线。分别配制0.5mg/mL五种多糖的水溶液,用制作吸光度-葡萄糖浓度标准曲线的方法检测五种多糖水溶液的吸光度,代入标准曲线方程,求出的糖浓度再除以0.5mg/mL即为糖含量。每种多糖3次配液,求3次糖含量。
1.2.4 多糖的单糖种类测定
多糖的水解:以2mol/L的HCl作为溶剂,分别配制1mg/mL的五种多糖溶液,各取1mL,90℃水浴3h使多糖水解,冷却至室温,离心(8 000rpm,10min)取上清,得水解液。
多糖的衍生:取各水解液0.5mL,分别加入0.5mL氨水及0.5mol/L PMP的甲醇溶液,涡旋3min,70℃避光水浴30min,再冷却至室温,均加入10%的冰乙酸调至pH为7。分别加入1mL氯仿,涡旋3min,离心(8 000rpm,10min)去除下层氯仿,重复加氯仿,离心,去氯仿3次。取水层,得到5种PMP衍生多糖。
内标及混标的衍生:称取10mg内参单糖葡萄糖醛酸,蒸馏水定容至10mL,即得1mg/mL内参单糖标准储备液,又称内标。精密称取9种标准单糖(核糖、木糖、阿拉伯糖、鼠李糖、岩藻糖、甘露糖、葡萄糖、半乳糖、半乳糖醛酸)各10mg,混匀,蒸馏水定容至10mL,即得1mg/mL混合标准单糖储备液,又称混标。取内标及混标各0.5mL按多糖的衍生方法进行操作,得到PMP衍生内标及混标。
衍生多糖及衍生混标上样前准备:分别取五种衍生多糖及衍生混标各0.5mL,分别加入0.1mL衍生内标,再分别用0.22μm的滤膜过滤,得到单糖检测样品TPS-20、TPS-40、TPS-60、TPS-80、TPS-100及混标溶液。
5种多糖的单糖检测,具体条件如下:色谱柱:shim-pack VP-ODS228-34937-92(5.0μm,250mm×4.6mm i.d.);流动相A:83%-乙酸铵(5mmol/L),流动相B:17%-乙腈;流速:0.9mL/min;柱温:27℃;进样体积:5μL;电喷雾离子源进行正离子模式检测(质电荷比m/z为100-600,电喷雾电压为3.5KV,高纯氮气为碰撞气体,碰撞气压力:230KPa;雾化气流速:3.0L/min;干燥器流量:15.0L/min);分别取单糖检测样品TPS-20、TPS-40、TPS-60、TPS-80、TPS-100及混标溶液,进行液质分析。记录出峰时间,与混标比较各多糖含有的单糖种类。
1.2.5 DPPH自由基清除实验
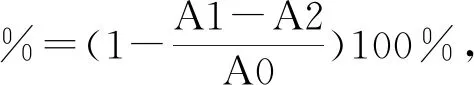
1.2.6 羟自由基清除实验[12]
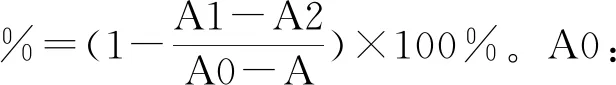
1.2.7 抑制α-葡萄糖苷酶活性实验[13]
配制溶液:磷酸盐缓冲液(pH 6.8):取0.2mol/L磷酸二氢钾溶液250mL,加0.2mol/L氢氧化钠溶液118mL,用纯水稀释至1 000mL;α-葡萄糖苷酶溶液:称取适量α-葡萄糖苷酶粉末,用磷酸盐缓冲液溶解定容,配成0.5U/mL的α-葡萄糖苷酶溶液;PNPG溶液:精密称取188.31mg PNPG,先加1mL DMSO溶解,再加磷酸盐缓冲液定容至25mL,配制成25mmol/L的母液,用磷酸盐缓冲液稀释至10mmol/L。碳酸钠溶液:准确称取5.30g碳酸钠,加250mL蒸馏水溶解,配制成0.2mol/L碳酸钠溶液。

1.3 统计学方法
2 结 果
2.1 精制多糖的得率
粗多糖及精制多糖的宏观形貌分别见图1、图2(封二)。5种粗多糖的得率分别为(4.34±0.06)%、(5.65±0.08)%、(6.63±0.09)%、(6.65±0.07)%、(7.26±0.09)%(n=3,F=624.5,P<0.05),说明粗多糖的得率随着提取温度的升高而升高,可能与温度升高后破坏细胞壁更彻底,及溶出成分内能增加,热运动更加剧烈,溶出增多有关。5种精制多糖TPS-20、TPS-40、TPS-60、TPS-80及TPS-100的得率分别为(2.02±0.02)%、(2.94±0.05)%、(3.18±0.07)%、(3.03±0.09)%及(2.11±0.06)%(n=3,F=237.6,P<0.05),60℃以后,随着提取温度的升高,粗多糖的得率继续增加,但精制多糖的得率却在降低,说明随着温度的继续升高,提取出来更多的是杂质,杂质通过后期的聚酰胺层析柱被除去,而且温度的进一步升高,可能会破坏原先已经溶出的多糖成分,所以60℃为提取本实验精制多糖的最佳温度。
2.2 精制多糖的糖含量
5种精制多糖TPS-20、TPS-40、TPS-60、TPS-80及TPS-100的糖含量依次为(36.87±2.39)%、(44.71±2.91)%、(52.76±4.24)%、(52.33±4.01)%及(35.93±1.73)%(n=3,F=12.74,P<0.05),通过F检验可知TPS-20及TPS-100分别与TPS-60相比较具有显著性差异,在α=0.05的前提下认为,TPS-60的糖含量大于TPS-20及TPS-100。实验结果表明,60 ℃为提取本实验精制多糖的最佳温度,此时精制多糖的得率最高,精制多糖的糖含量也较高。
2.3 多糖的单糖分析
混标(a)及5种多糖(b-f)中单糖的HPLC-MS分析见图3(封二)。根据5种多糖质荷比和出峰时间,可以确定五种多糖TPS-20、TPS-40、TPS-60、TPS-80及TPS-100均含有核糖、木糖、阿拉伯糖、鼠李糖、岩藻糖、甘露糖、葡萄糖、半乳糖、半乳糖醛酸。
2.4 多糖的DPPH自由基清除活性
五种多糖TPS-20、TPS-40、TPS-60、TPS-80及TPS-100的DPPH自由基清除活性见表1,从中可知,每一种多糖均具有DPPH自由基清除活性,当多糖浓度为0.6、0.8及1.0 mg/mL时,TPS-40、TPS-60、TPS-80之间的DPPH自由基清除活性没有显著性差异,但TPS-40、TPS-60、TPS-80分别与TPS-100比较具有显著性差异,且TPS-20在不同浓度时,分别与TPS-40、TPS-60、TPS-80比较也有显著性差异,即TPS-40、TPS-60、TPS-80的DPPH自由基清楚活性优于TPS-20和TPS-100,可能在40 ℃以前,随着温度的升高,具有自由基清除活性的多糖的溶出增加,当温度高于80 ℃时,具有自由基清除活性的多糖被高温改变了结构,失去部分自由基清除活性,还有可能与80℃过后,多糖的糖含量降低有关。
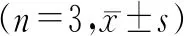
表1 不同提取温度多糖的DPPH自由基清除活性
2.5 多糖的羟自由基清除活性
五种多糖TPS-20、TPS-40、TPS-60、TPS-80及TPS-100的羟自由基清除活性见图4(封二)。从结果可以发现,各种多糖均有羟自由基清除活性,但统计分析结果提示,相同浓度不同多糖的羟自由基清除率均无显著性差异,提示提取温度并未对青砖茶多糖的羟自由基清除活性产生影响。
从以上两个检验青砖茶多糖抗氧化活性的实验可知,不同提取温度的青砖茶多糖均具有抗氧化活性,且TPS-40、TPS-60、TPS-80的DPPH自由基清除活性优于TPS-20、TPS-100。
2.6 多糖的α-葡萄糖苷酶抑制活性
五种多糖TPS-20、TPS-40、TPS-60、TPS-80及TPS-100的α-葡萄糖苷酶抑制活性见图5(封二)。不同提取温度多糖均具有α-葡萄糖苷酶抑制活性,统计分析结果提示仅多糖浓度为0.6 mg/mL时,TPS-60的α-葡萄糖苷酶抑制活性强于TPS-40,可以认为提取温度并未对青砖茶多糖的α-葡萄糖苷酶抑制活性产生影响。
3 讨 论
本实验以青砖茶为原料,料液比等其他提取条件不变的前提下,采取不同提取温度,经提取纯化得到了5种青砖茶多糖TPS-20、TPS-40、TPS-60、TPS-80及TPS-100,通过实验检测其糖含量、单糖种类、抗氧化活性及抑制α-葡萄糖苷酶活性,发现他们均含有核糖、木糖、阿拉伯糖、鼠李糖、岩藻糖、甘露糖、葡萄糖、半乳糖、半乳糖醛酸,说明此实验中温度对青砖茶多糖中单糖的种类不会产生影响,不会改变多糖中单糖的组成,只会改变多糖的溶出率。其中TPS-60的得率及糖含量较其他多糖高,且不同提取温度青砖茶多糖均具有抗氧化活性及α-葡萄糖苷酶抑制活性,40到80℃之间提取得到的青砖茶多糖的抗氧化活性更优。
总而言之,本实验得出了近似白色的精制青砖茶多糖的提取及纯化方案, 确定了青砖茶多糖其中单糖的种类,且在一定温度范围内,单糖种类与提取温度无关,证实了青砖茶多糖具有抗氧化活性及抑制α-葡萄糖苷酶活性,并且60 ℃提取得到的青砖茶多糖TPS-60提取率、糖含量均较高,具有自由基清除活性及α-葡萄糖苷酶抑制活性,因此,青砖茶多糖可以作为天然抗氧化剂及治疗糖尿病的药物加以研发利用。

