猪唾液中DNA的获取方法研究
李朝阳,罗武,杨凯,邵勇钢,翟曼君,董新星,韦伟,陈杰,张立凡*
(1. 南京农业大学动物科技学院,江苏 南京 210095;2. 新疆农业大学动物科学学院,新疆 乌鲁木齐 830052;3. 云南农业大学动物科学技术学院,云南 昆明 650201)
猪遗传资源保护研究主要通过采集猪的血液或耳组织等样本来获得个体的DNA,这些方法具有操作简便,提取出的DNA样品质量较好等优点。然而,采集猪的血液或组织或多或少都会伤害到动物的健康,不利于动物福利。另外,对于一些珍贵且种群数量较少的猪遗传资源,反复采集其血液或组织样本也对猪本身的伤害较大。因此,开发猪无损伤DNA获取方法不但可以提升猪的福利水平,减轻采集过程对个体生长发育的影响,节省人力成本,同时也将会为猪的各类研究,DNA基因组样本规模化收集以及现今新的分子选育技术(如基因组选择)提供巨大的技术支撑。
过去的数十年里,人们对于猪无损伤DNA获取方法也进行了很多探索,最为典型的是从猪的毛发中提取DNA样品。印崇等[1]研究了5个猪种不同数量毛发提取DNA的效果,结果显示毛发提取出来的DNA主要在毛囊部位,毛干几乎没有提取出DNA,这也意味着需要从猪身上拔去包含毛囊的完整毛发,造成在实际操作过程中尤其是对成年猪进行毛发收集时增加了采集难度。因此从猪的毛发中提取DNA样品鲜有规模化的实际应用。
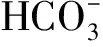
因此,本研究首次尝试和开发了从猪的唾液中获取DNA的方法,此方法可以有效避免采集样本时对动物本身造成伤害,从而改变了以往从耳组织和血液获取DNA的现状,同时提升实验动物的福利水平,减轻试验本身对动物生长发育的影响[7]。本研究对于提升猪的福利水平、群体遗传研究以及我国珍稀地方猪种遗传资源的DNA样品获取都具有非常重要的应用价值。
1 材料与方法
1.1 采样动物
以常州市焦溪二花脸猪合作社的二花脸猪为对象,分别采集5头二花脸公仔猪(15日龄)和成年公猪(180日龄)的唾液,以及5头采集过唾液的成年公猪屠宰后的背最长肌肌肉为对照提取样品。
1.2 唾液采集方法
唾液采集方法一:医用棉签。先将仔猪固定好,采用多根康每乐10 cm长度的医用棉签放入仔猪的口腔中,棉签与舌头以及口腔上皮擦拭2 min后取出,放入冻存管,标记后低温下保存。
唾液采集方法二:自制海绵采样工具(图1)。自制约5 cm×3 cm×1 cm大小的海绵块,在中线的1/3处开孔。采集杆为塑料材质,长度较长,可以防止采集过程中被动物咬伤。采集工具的前端为夹子状,前端1/4处的卡口用于夹紧海绵。采集时将海绵采集工具伸到猪的面前,吸引猪上前并咬住采集工具,咀嚼海绵。前后咬2 min左右时海绵完全湿润即可完成采集。再将海绵取下并放入自封袋,进行标记和密封,清洗采集工具并换上新的海绵。采集的海绵放在低温下保存。

图1 唾液采样工具
1.3 试验试剂及仪器
主要试剂:组织裂解液,由十二烷基硫酸钠(SDS)、Tris、EDTA和NaCl溶液混合配制;高保真DNA聚合酶,DNA Marker,DNA Loading buffer,TS-GelRed 核酸凝胶染料,琼脂糖,10×TBE溶液,购自北京擎科生物科技有限公司。主要仪器:高速离心机(德国艾本德股份公司)和NanoDrop 2000分光光度计(美国赛默飞世尔科技公司)。
1.4 猪唾液DNA提取
1.4.1 裂解法提取猪唾液DNA
将含有唾液的棉签和海绵取下,并放入装有DEPC水的采集管中,完全浸没约2 h后11 000 r/min离心10 min,获得唾液沉淀物;将唾液沉淀物置于2 mL离心管中,加入800 μL组织裂解液和20 μL蛋白酶K溶液,放入水浴锅内55 ℃放置2 h;加入约800 μL饱和酚,在摇匀器上摇匀10 min,11 000 r/min离心10 min;取上清液置于新的2 mL离心管中,加入500 μL饱和酚和500 μL氯仿异戊醇溶液,摇匀10 min,11 000 r/min离心10 min;取上清液置于新的2 mL管,加入1 000 μL氯仿溶液,摇匀10 min,11 000 r/min离心10 min;取上清液置于新的1.5 mL管中,加800 μL低温处理过的无水乙醇,摇匀10 min,11 000 r/min离心10 min;弃去管中液体,在沉淀里加70%乙醇清洗后吸干液体,放置于通风橱内;干燥后加入50 μL TE溶液,溶解DNA;提取的DNA进行琼脂糖凝胶电泳检测,同时检测其OD260/OD280和OD260/OD230值以获取DNA样品的浓度和纯度。
1.4.2 碘化钾方法提取唾液DNA
参考文献[8]对采集的唾液样本进行DNA提取。对照组肌肉组织样品采用经典酚仿法提取DNA。
1.5 基因组DNA体外PCR扩增
以不同方法从唾液和肌肉组织样品中提取的DNA作为模板,选取猪的持家基因GAPDH作为扩增目的基因,按照高保真酶试剂盒要求配制PCR反应体系,接着在PCR扩增仪上进行扩增,之后采用1.5%琼脂糖凝胶电泳检测PCR产物。
PCR反应体系为25 μL:DNA模板链1 μL,引物F和R均为1 μL,ddH2O为9.5 μL,高保真酶为12.5 μL。GAPDH基因引物为,F:5′-ACGTGTCGGTTGTGGATCTG-3′,R:5′-CAGGGGGCACCAGA-CTTGAT-3′。PCR循环参数为: 98 ℃ 2 min;98 ℃ 10 s,60 ℃ 30 s,72 ℃ 1.5 min,循环35次;72 ℃ 5 min。引物设计的PCR扩增产物大小为462 bp。
1.6 PCR产物测序及序列比对
扩增结束后将PCR产物送到南京擎科生物科技有限公司进行测序,测序结果通过DNAMAN软件的多序列对比工具进行比对和分析。
1.7 数据统计与分析
应用SPSS 17.0软件进行统计学分析,DNA纯度和浓度比较采用单因子方差分析法,多重比较使用Tukey法,数据采用“平均值±标准误”表示。
2 结果与分析
2.1 不同裂解液体积对猪唾液基因组DNA的提取效果比较
如表1所示,不同的裂解液体积对唾液DNA质量的影响主要表现在DNA浓度和OD260/OD230比值上,裂解液量在800 μL时获得的DNA量最多。不同量的裂解液对OD260/OD280影响不明显,OD260/OD230值在裂解液量达到600 μL时基本不会提升,因此得出裂解液最佳使用量是800 μL。

表1 不同裂解液体积获得的DNA浓度和纯度对比(n=2)
2.2 唾液基因组DNA的得率和纯度比较
从表2可以看出,仔猪、成年公猪的唾液与肌肉样品中获取的DNA浓度相近(P>0.05),但不同个体间存在差异。来源于肌肉样品DNA的OD260/OD280值平均在1.95左右,和仔猪唾液DNA的OD260/OD280值相差不大。仔猪唾液DNA的OD260/OD280和OD260/OD230值好于成年公猪。碘化钾方法从唾液中获取的DNA浓度和OD260/OD230值显著低于裂解法(P<0.05)。
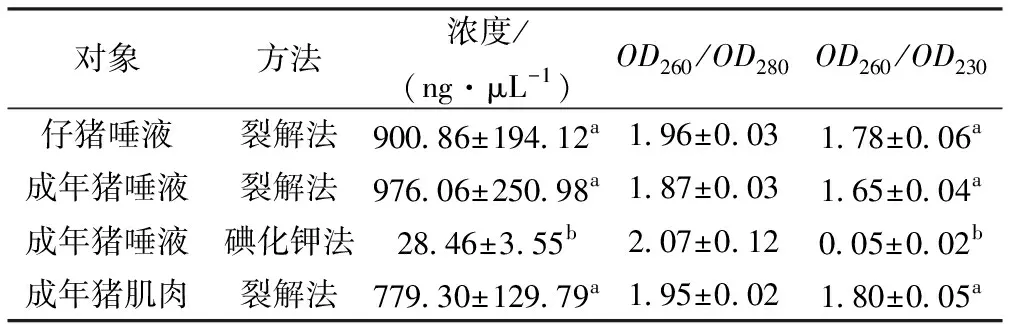
表2 不同方法提取的DNA浓度和纯度表(n=5)
2.3 唾液DNA的电泳检测
从图2中可以看出从唾液和肌肉组织样品中获得的DNA条带亮度较高且相差不大,前15个样品均有较为完整的DNA条带,图中无明显杂带,说明DNA降解现象较少发生。泳道16~20为碘化钾法提取的DNA条带,其亮度模糊偏暗并有很明显的杂质存在。
2.4 唾液基因组DNA的PCR扩增
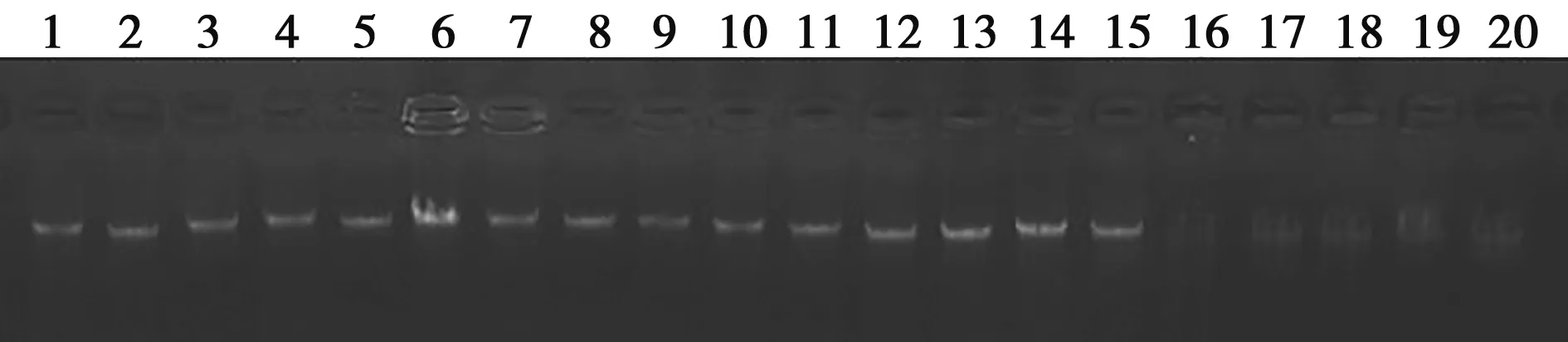
由图3可以看出PCR产物均为单一条带,位于500 bp条带下方,与设计的462 bp长度相符合,其中仔猪和成年猪唾液提取的DNA扩增产物的荧光条带亮度较高,并且与肌肉组织的DNA扩增产物相比亮度差异不大。碘化钾法提取的成年公猪唾液DNA条带较暗,说明碘化钾法可以从唾液中获得二花脸猪DNA,但由于DNA本身浓度低,扩增效果不好。
1~5.裂解法提取的仔猪唾液的DNA;6~10.裂解法提取的成年猪唾液的DNA;11~15.裂解法提取的成年猪肌肉组织的DNA;16~20.碘化钾法提取成年猪唾液的DNA
M. DL2000 DNA Marker;1~5.裂解法提取的仔猪唾液的DNA扩增产物;6~10.裂解法提取的成年猪唾液的DNA扩增产物;11~15.裂解法提取的成年猪肌肉组织的DNA扩增产物;NC.不加模板DNA的阴性对照组;16~20.用碘化钾法提取成年猪唾液的DNA扩增产物
2.5 测序结果比对
对上述扩增出GAPDH基因的PCR产物进行测序,结果发现15个DNA的PCR产物测序结果与原GAPDH序列几乎一致,一致性为95.94%(图4)。

B1~B5.裂解法提取的成年猪唾液DNA扩增产物;J1~J5.裂解法提取的成年猪肌肉DNA扩增产物;S1~S5.裂解法提取的仔猪唾液DNA扩增产物;GAPDH. 设计的模版序列
3 讨论
通过采集动物的唾液并从中提取出DNA是一种方便且不以损伤动物健康为代价的DNA获取方法,理论上可以应用于所有能够分泌唾液的哺乳动物,然而对于不同的动物,其采集与提取方式也不尽相同。Lobo等[9]曾经用软木塞、聚苯乙烯泡沫和木块结合食物诱饵采集狗的唾液,发现通过聚苯乙烯泡沫采集到的唾液量最多。Subharat等[10]采用棉签来收集绵羊的唾液。本试验先从采集唾液最为容易的仔猪开始研究唾液的采集方法。生活中医用棉签是最为常用的样品采集工具,由于仔猪容易固定,医用棉签采集相对安全,因此对仔猪的唾液采集使用了医用棉签。成年猪体型和力量较大,难以固定,棉签采集唾液容易被咬断,因此自制海绵采集工具。此工具可以通过海绵来收集猪的唾液,同时较长的杆柄可以保持采样者与猪个体间的距离,采集过程中海绵会与口腔表面和舌头进行摩擦使得更多的口腔细胞附着于海绵上,从而采集到足够量的唾液和细胞。结果发现2种采集方法都可以收集到猪的唾液并提取出基因组DNA。尽管海绵采集工具获得的唾液量和杂质比棉签多,但比对2种方法提取的DNA浓度和纯度上没有发现明显差异。
在人类医学上对唾液进行采集和提取DNA的研究已经相对成熟,比如李子怡等[11]探究了Chelex100法提取口腔黏膜细胞DNA的效果;孙佳蕊等[12]采用煮沸法和碱裂解法从人的口腔黏膜上皮细胞提取DNA,发现碱裂解法提取的浓度优于煮沸法;Nemoda等[13]探讨了不同介质如海绵、棉签、脱脂棉以及直接采集唾液的效果。本研究主要参考了杨泽民等[8]的碘化钾提取唾液DNA的方法,同时也对组织裂解法进行了改进。结果发现碘化钾法相对简单,DNA的提取耗时短,但是获得的DNA纯度较低,其OD260/OD230值低于0.5。一般而言,DNA的OD260/OD230值低于1.6说明提取出的DNA中含有较多的盐离子、糖类物质。相对于碘化钾法,裂解法步骤较多,但无论是浓度还是纯度,裂解法都比碘化钾法提取效果好,并且与猪肌肉中提取的DNA质量接近。结合DNA凝胶电泳和PCR产物测序检测,发现此方法可以成功地获得合格的猪唾液基因组DNA,其质量完全可以用于基因扩增等分子生物学研究。
此外,我们发现成年公猪和仔猪唾液提取的DNA浓度、OD260/OD280和OD260/OD230值,以及PCR产物都没有明显的差别,这也说明尽管成年公猪和仔猪口腔里的唾液量和杂质量各不相同,但并没有影响唾液提取的DNA质量。
虽然从猪唾液中提取DNA的优点很多,但也存在一些问题。从唾液中提取的DNA可能还会含有细菌等其他生物的DNA,因此在进行猪唾液样品采集时除了多给动物饮水之外,还需要更多的有效措施来清洁个体的口腔。

