姜黄素对猪瘟病毒复制的抑制作用
高雅,李晓晗,孙睿聪,娄锦秀,陈茜,周斌
(南京农业大学动物医学院,江苏 南京 210095)
姜黄素(curcumin)是姜科植物姜黄等根茎提取而来的橙黄色脂溶性酚类色素,性状一般为粉末,分子式为C21H20O6,相对分子质量368.39,主链由芳香族基团及不饱和脂族构成,有光热敏性[1]。因其具有天然生物活性,包括抗肿瘤、抗突变、抗氧化、抗菌抗病毒等[2-3],近年来备受瞩目。姜黄素还可提高动物免疫力,促进动物生长,提高动物制品质量,也有研究其在动物饲料添加剂等方面的应用[4]。
猪瘟(classical swine fever,CSF)是由猪瘟病毒(classical swine fever virus,CSFV)引起的高度接触性传染病,具有高发病率和死亡率,猪瘟的暴发对养猪业打击巨大,猪瘟的典型临床特征是高热、出血以及白细胞减少,还可导致母猪流产[5]。猪瘟病毒属于黄病毒科瘟病毒属。截至目前,姜黄素抑制黄病毒科诸多病毒已见相关报道,如日本乙型脑炎病毒[6]、登革热病毒[7]等。CSFV是囊膜病毒,其复制周期包括吸附、膜融合、内化、病毒蛋白转录、翻译、基因组复制、病毒粒子的装配和释放等过程,以上过程缺一不可。姜黄素可作用于多种信号转导途径[2],会减少病毒产物和感染性病毒粒子的释放,可能对CSFV病毒复制周期的多个过程均发挥抑制作用。本研究拟证明姜黄素及其衍生物对猪瘟病毒具有抑制作用,进一步探究姜黄素抑制猪瘟病毒的具体作用路径。
1 材料与方法
1.1 毒株和细胞
猪肾上皮细胞(PK-15)、CSFV(石门株;序列号:AF092448)由本实验室保存。
1.2 试剂
细胞培养所用试剂(DMEM、胎牛血清、青链霉素),购于Gibco ; 姜黄素(HY-N0005)、去甲氧基姜黄素(HY-N0006)、双去甲氧基姜黄素 (HY-N0007),购于MCE ;RIPA-PMSF,购于Solarbio;预染蛋白质分子量Marker,购于Bio-Rad;鼠源抗β-actin单抗、羊抗鼠、羊抗兔IgG HRP,购于Santa Cruz;TRIzol试剂,购于TaKaRa;5×All-In-One RT Master Mix(with AccuRT Genomic DNA Removal Kit)(Cat. No. G492),购于Abm;Cell Counting Kit-8(CCK-8,K1018),购于APExBIO;兔抗CSFV-Npro抗体,为本实验室保存;兔抗热休克蛋白70(HSP70)抗体,购于Abcam;兔抗RhoA(ras homolog family member A),购于Cell Signaling Technology;异硫氰酸荧光素(FITC)标记鬼笔环肽,购于上海碧云天生物技术有限公司;增强型ECL化学发光检测试剂盒,购于上海天能科技有限公司;AR级纯度化学试剂,购于南京寿德试验器材有限公司。
1.3 姜黄素工作浓度配制
姜黄素溶于DMSO,配制浓度为10 mg/mL储存液,存放于-80 ℃。试验组姜黄素浓度设置为2.5、5、10、15 μmol/L,对照组添加0.1% DMSO。
1.4 细胞处理
在24或6孔板中培养PK15细胞,37 ℃ 5% CO2培养箱中培养,待细胞长至85%时,用无血清DMEM洗涤细胞,接种CSFV石门株(MOI=0.5,MOI为感染复数),37 ℃培养1 h后,洗涤,根据试验目的分别加入含姜黄素(10 μmol/L)、去甲氧基姜黄素(10 μmol/L)、双去甲氧基姜黄素(10 μmol/L)的2% DMEM(含血清)维持,设空白对照(MOCK)。
1.5 Western blot检测
弃去细胞上清,然后用预冷的PBS将细胞洗涤3遍。使用组织裂解液(RIPA)于冰上裂解细胞获得蛋白,加入5×SDS Loading buffer,经煮沸变性处理后存于-80 ℃。制12.5% SDS-PAGE凝胶,于凝胶上电泳分离样品中蛋白,经湿转法将蛋白转移至PVDF膜上,10%脱脂奶粉封闭1.5 h,一抗4 ℃过夜孵育,PBST洗净,二抗室温孵育45~60 min,PBST洗净后,经ECL发光,由成像仪拍照记录结果。
1.6 激光共聚焦试验
PK-15细胞在培养皿上生长至80%汇合度时,用含10 μmol/L姜黄素的2% DMEM孵育细胞4 h,以CSFV感染1 h(MOI=10),更换2% DMEM维持液,分别于30、60和90 min收获细胞。将收获的单层细胞用含4%多聚甲醛的PBS室温固定15 min,并用0.1% TritonX-100室温透膜处理,然后与按说明书稀释后的FITC标记鬼笔环肽共同孵育。通过软件(Nikon A1;Nikon,Japan)拍摄照片。
1.7 核酸提取和实时荧光定量(RT-qPCR)
按试验所需的时间点收取全细胞样本,使用TRIzol法抽提总RNA,使用快速反转录试剂盒获得cDNA。采用实时荧光定量方法采集信号分析细胞CSFV、环氧化酶2(COX-2)和过氧化物酶体增殖物激活受体(PPAR-γ)mRNA水平。引物由金斯瑞生物科技股份有限公司合成(表1)。

表1 荧光定量PCR引物
1.8 数据统计与分析
采用GraphPad Prism 5进行t检验比较组间数据,各试验均独立重复3次。数据均以“平均值±标准差”来表示。
2 结果与分析
2.1 姜黄素及其衍生物对CSFV增殖的抑制作用
在前期细胞活性试验中,与空白对照组相比,姜黄素的浓度低于15 μmol/L时对细胞活性影响差异不显著(P>0.05)(结果未显示),因此后续选取以5、10、15 μmol/L为主要试验浓度。经Western blot证明,细胞内病毒蛋白Npro减少,见图1。灰度值分析可知,与DMSO组相比,在感染后24和48 h双去甲氧基姜黄素可将Npro的总量降至62%和84%;姜黄素可将Npro的总量降至71%和70%;去甲氧基姜黄素可将Npro的总量降至73%和69%。
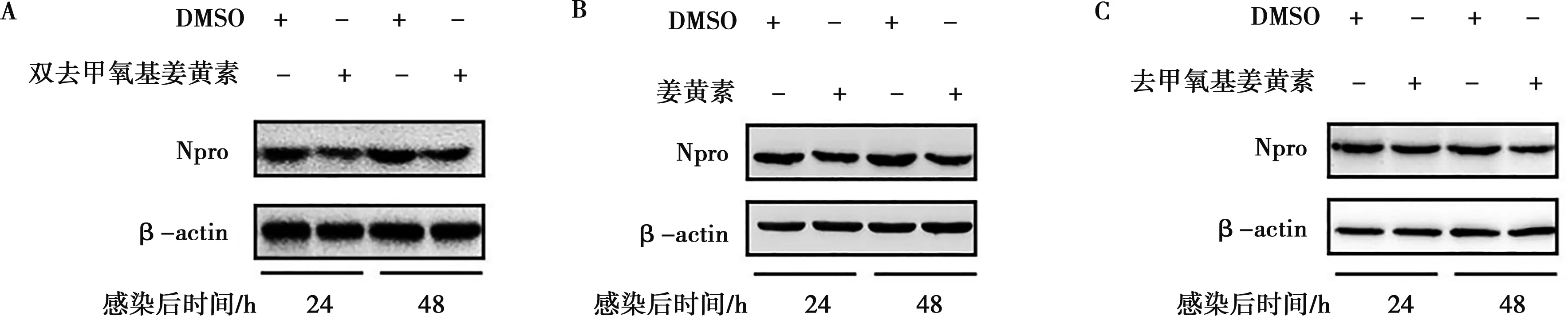
图1 双去甲氧基姜黄素(A)、姜黄素(B)和去甲氧基姜黄素(C)抑制CSFV病毒蛋白的Western blot比较
按照上述处理细胞方式提取获得细胞全基因组后,使用RT-qPCR检测细胞中CSFV的含量,如图2所示,结果也同样证明姜黄素及其衍生物均具有抑制CSFV的作用,且差异显著(P<0.05)。

与DMSO组相比,**表示差异极显著(P<0.01),*表示差异显著(P<0.05)。下同
2.2 姜黄素影响病毒感染后纤维状肌动蛋白(F-actin)形成与重排
姜黄素预处理细胞4 h后,用CSFV感染细胞,更换2% DMEM培养24 h,不能显著抑制病毒增殖。延长药物预处理时间至16 h,姜黄素对病毒的复制产生明显了影响,且呈剂量依赖关系(图3)。5 μmol/L药物处理后显著降低CSFV水平(P<0.05),10和15 μmol/L药物处理后产生极显著抑制作用(P<0.01)。
共聚焦试验结果如图4所示,姜黄素干扰病毒进入时对F-actin的解聚作用,降低病毒感染性,并且在60 min时影响最为明显。姜黄素预处理会对细胞产生一定的保护效力,阻止病毒进入时对细胞骨架的重排作用。
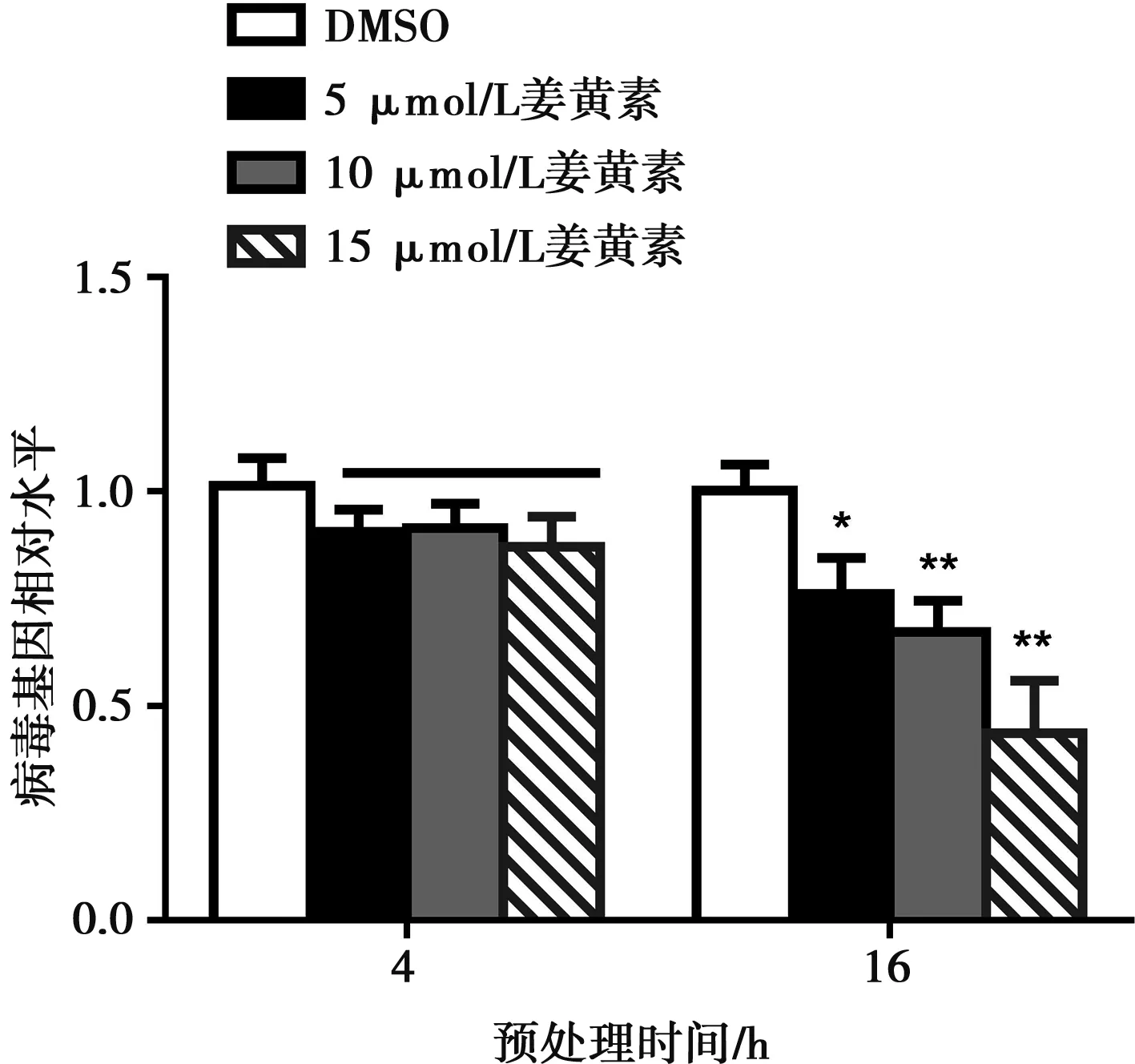
图3 不同浓度姜黄素预处理不同时间对CSFV水平的影响
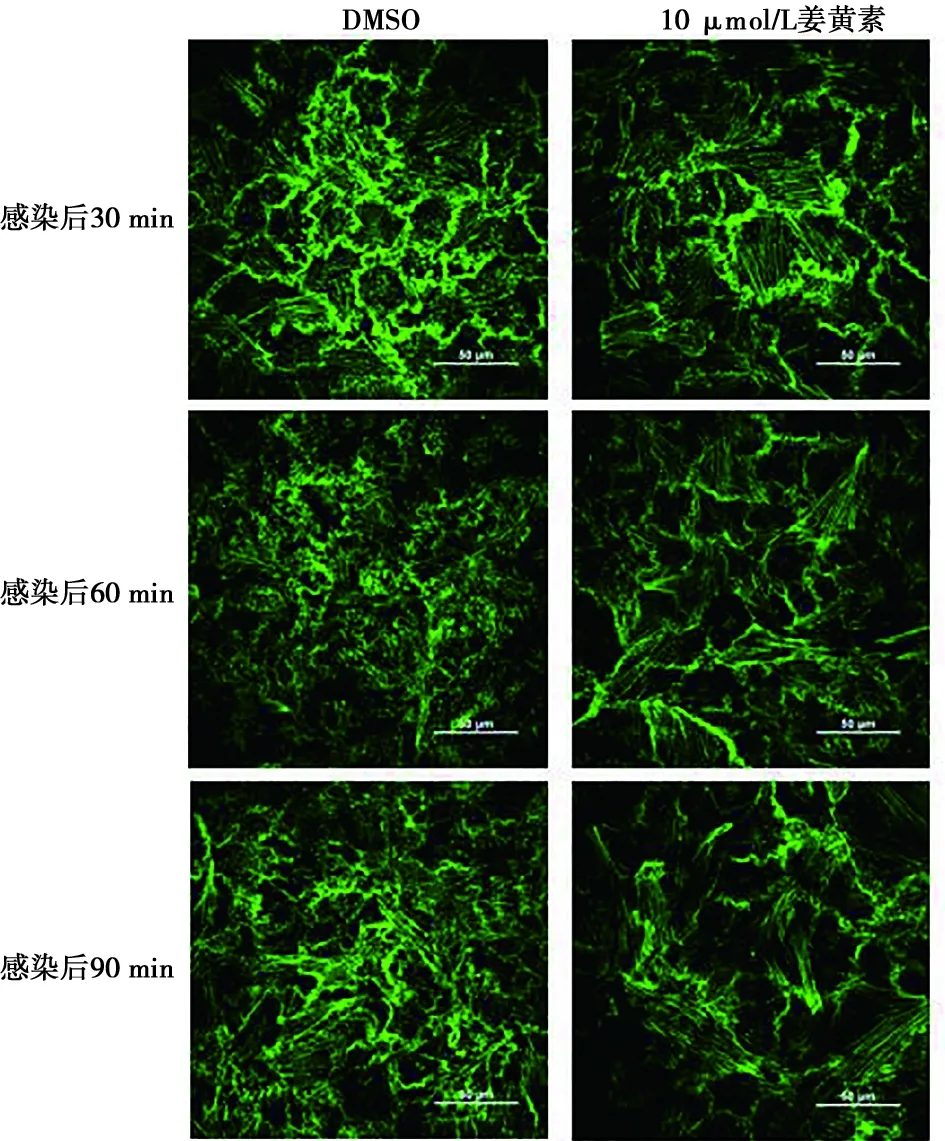
图4 PK-15细胞感染CSFV后不同时间姜黄素(10 μmol/L)抑制CSFV介导的F-actin重排的激光共聚焦比较(标尺=50 μm)
如图5所示,不同浓度姜黄素作用24 h后,随姜黄素浓度升高,细胞骨架结构被破坏,同时F-actin蛋白表达减少。
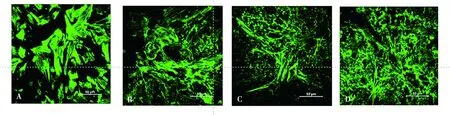
A. DMSO;B. 5 μmol/L;C. 10 μmol/L;D. 15 μmol/L
对调节F-actin的上游分子RhoA进行检测,发现不同浓度的姜黄素对细胞中RhoA的蛋白水平并未产生明显影响(图6)。

图6 Western blot检测不同浓度姜黄素对RhoA蛋白水平的影响
2.3 姜黄素通过抑制细胞应激抑制CSFV复制
通过对药物处理后细胞蛋白样本的提取,经Western blot分析可知,不同浓度作用下的姜黄素可减少细胞中与CSFV复制相关的HSP70表达,使用Image J分析灰度值可知,不同浓度药物处理后,能分别降低病毒感染细胞中HSP70的含量达10%、24%、31%(图7)。
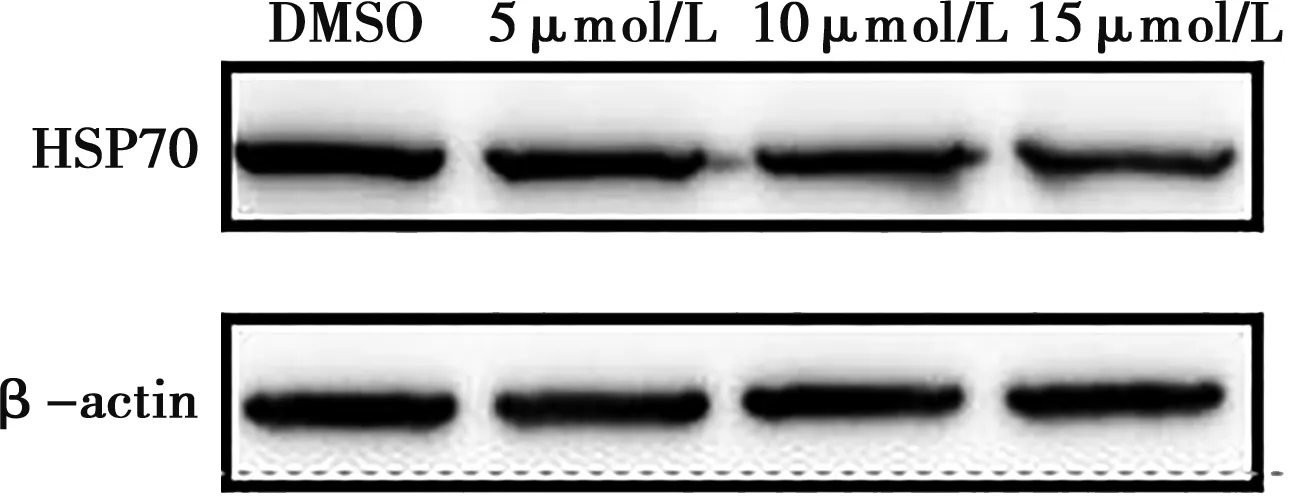
图7 不同浓度姜黄素影响HSP70蛋白水平的Western blot比较
对感染后24和48 h收获的细胞样本进行RT-qPCR检测,通过与DMSO对照组相比,姜黄素均显著下调病毒氧化应激相关因子COX-2(P<0.01或P<0.05,图8A)和上调PPAR-γ(P<0.01或P<0.05,图8B)。根据以上结果推测,姜黄素还可减轻CSFV引起的细胞氧化应激,从而减少CSFV的复制。
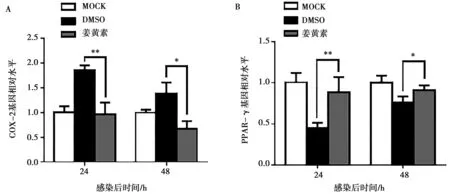
图8 RT-qPCR检测COX-2(A)和PPAR-γ(B)的mRNA水平
3 讨论
姜黄素具备天然产物所特有的生物活性,药理作用广泛、毒性较低,受到研究者的广泛关注。近年来关于姜黄素抗病毒作用和机理已有许多研究。冯春等[8]发现姜黄素可抑制马立克病病毒复制;Du等[9]发现姜黄素通过抑制病毒内化进入细胞,阻碍病毒脱衣壳,减轻病毒介导的细胞融合现象,来抑制猪繁殖与呼吸综合征病毒,保护细胞;朱光等[10]还发现姜黄素可通过诱导血红素加氧酶抑制该病毒复制;Ali等[11]证明姜黄素促进Tat蛋白降解从而抗人类免疫缺陷病毒;Narayanan等[12]研究得出姜黄素抑制 NF-κB通路来抑制裂谷热病毒的复制;Leonardo等[7]研究表明姜黄素干扰登革热病毒Ⅱ型感染宿主的过程来抵御病毒感染宿主;Kim等[13]发现姜黄素可抑制Akt-SREBP-1途径,减少丙型肝炎病毒复制;Dutta等[6]发现姜黄素诱导泛素-蛋白酶体系统的异常表达,减少子代病毒粒子来抑制日本乙型脑炎病毒。
本研究证实了姜黄素及其衍生物均具有抗CSFV的作用。药物预处理时间增长后,会产生抑制病毒入胞的影响,但无论预处理4或16 h,这种抑制均与CSFV入胞相关蛋白Rab5、Rab7、发动蛋白、网格蛋白[14]无关(结果未显示)。病毒进入细胞过程依靠细胞骨架的重塑,F-actin是病毒内吞囊泡形成的关键[15]。病毒介导的F-actin的重排和降解是加速病毒感染进程的关键,研究已发现姜黄素对F-actin具有调节作用[16]。因此,为了解姜黄素预处理对细胞产生何种影响,选取了已被证明在病毒早期复制过程中发挥重要作用的F-actin。共聚焦试验结果显示,在病毒入侵细胞阶段,会阻止病毒引起的F-actin解聚,保留微丝结构,从而阻止病毒进入,但作用时间过长,又会影响细胞自身正常形态,使细胞受损,这也解释了姜黄素作用时间过长,浓度过高,会对细胞的活性产生影响,以上结果提示姜黄素可能对F-actin存在不同的调节方式,安全剂量下的姜黄素长时间预处理细胞可通过抑制病毒对F-actin的重排作用来抑制病毒进入,进而减少病毒的侵袭,但姜黄素对F-actin上游调节因子RhoA并无明显影响[16]。因此,姜黄素对F-actin的作用机制有待进一步研究。
CSFV利用宿主细胞器合成自身相关的病毒组分[17],推测姜黄素可作用于病毒复制的多种过程和多条途径发挥抗病毒作用。通过后续试验可知,除了病毒早期复制阶段,姜黄素还可影响病毒复制后期。猪瘟可引起细胞氧化应激,而姜黄素是常见的抗氧化应激药物[5]。HSP70是热激蛋白伴侣分子,已被证实通过与CSFV NS5A蛋白互作帮助CSFV的复制[18],本试验中证明姜黄素可抑制病毒感染后HSP70的表达。此外,NS5A对CSFV的复制发挥重要作用,其能引起细胞炎性反应[18]。COX-2和PPAR-γ是重要的促炎性介质[19]。猪瘟感染后,细胞内抗炎因子PPAR-γ水平会明显下降,而COX-2会显著升高,二者呈现动态平衡[20]。为了探究姜黄素处理后对细胞的保护作用,分别选取不同的时间点对细胞中这两种重要介质进行检测,结果发现姜黄素可抑制COX-2并且升高PPAR-γ的水平,说明姜黄素可减轻CSFV感染后引起的氧化应激反应来保护细胞。一系列结果表明姜黄素可通过多途径抑制CSFV,达到保护细胞的作用。

