锦葵啶葡萄糖苷酶促酰化反应体系的研究及效果评价
王 政,黄名勇,周 彦,呙亚波,彭 非,邓洁红
(1.湖南农业大学 食品科技学院,长沙 410128;2.湖南省天香生物科技有限责任公司,湖南邵阳 422000;3.湖南食品药品职业学院,长沙 410208)
0 引言
花色苷(Anthocyanins)广泛存在于植物的根、茎、叶、花、果实等植物器官的细胞液中,是一种重要的天然植物色素,色泽鲜艳。同时具有广泛的生理和药理活性[1],拥有强大的抗氧化与清除自由基的作用;能降低血脂、甘油酯和胆固醇的水平;具有抗变异、抗肿瘤、抗过敏、保护胃黏膜等多种功能[2-3]。因此,花色苷在各种食品、药品和化妆品工业中具有很好的应用前景[4]。但由于花色苷自身结构稳定性较差,在加工贮藏过程中易受光、氧、温度、pH值、金属离子等因素影响[5-6],限制了其在食品工业及其他领域的应用。提高花色苷的稳定性,是开发利用花色苷的当务之急。
花色苷酰化是指花色苷糖基上的羟基被各种有机酸部分或完全酯化的现象,通过应用化学方法,花色苷上所有的羟基都能在特定条件下被酸酯化[7],花色苷母核结构上糖苷基团上的羟基通常能与一个或多个苹果酸、咖啡酸、香豆酸、脂肪酸、对羟基苯甲酸和阿魏酸反应形成单酰、二酰或多酰花色苷[8-9],酰化后的花色苷光、热稳定性得到提升[10],证明花色苷酰化是提高其结构稳定性的重要手段。
传统化学法酰化存在许多缺陷[11]:催化反应选择区域性差,副产物较多;试验操作复杂,耗时长,产物稳定性较差。酶法酰化对催化底物有良好的专一性和选择性,反应条件温和,催化效果显著,有效避免传统化学法的缺陷,同时酶在非水介质下作用还发挥出了在水溶液中没有的优势[12-13]:非水介质中酶结构稳定性好,区域选择性专一;酶易固定,便于回收;固化后酶热稳定性高,可防止微生物污染。目前能在非水介质中起到催化作用的酶已有数十种,能够催化多种反应,包括酰化反应[14-15]。
本研究旨在建立花色苷酶促酰化的反应体系:通过单因素试验,根据酶在不同反应介质中的酶活确定最佳有机溶剂,利用花色苷浓度与呈色变化关系以及花色苷在光照条件下易分解的特定,对比酰化前后花色苷的残留率和色差,确定最佳酶试剂、酶添加量、分子筛添加量和酰基供体;通过对比酰化反应前后锦葵啶葡萄糖苷的亲脂性和热稳定性,探讨酶促酰化效果。
1 材料与方法
1.1 原料与试剂
刺葡萄:采于湖南省中方县刺葡萄果园,自来水淋洗、晾干表面水分后手剥皮,-24 ℃冷冻贮藏备用。
Candila antarctica 脂肪酶 B(CAL-B,Novozym 435) Rhizomucor miehei脂肪酶(RML,Lipozyme RM IM)购于诺维信生物技术有限公司;猪胰脂肪酶(Lipase from pocine pancreas)、植物脂肪酶(Lipase from plant)购于合肥博美生物科技有限责任公司。
四氢呋喃(西陇科学股份有限公司);二甲基四氢呋喃,对羟基苯甲酸(上海阿拉丁生化科技股份有限公司;苯甲酸乙烯酯,肉桂酸乙烯酯(梯希爱化成工业发展有限公司)。
甲醇、乙醇、正辛醇、盐酸、丙酮、乙酸乙酯、乙醚、分子筛4A型(钠-A型分子筛)、蔗糖、均为国药集团化学试剂股份有限公司分析纯。
1.2 仪器与设备
AEY-220电子分析天平(湘仪天平仪器设备有限公司);UV-2450紫外分光光度计(日本岛津公司);RE-2000B旋转蒸发器(巩义市予华仪器有限责任公司);SHZ-D(Ⅲ)循环水式真空泵(巩义市予华仪器有限责任公司);TDZ5台式低速离心机(湖南赫西仪器装备有限公司);HH-8 数显恒温水浴锅(上海浦东物理光学仪器厂);THZ-92A气浴恒温振荡器(上海浦东物理光学仪器厂);BZ24/29 φ1.6×30 cm 玻璃层析柱(上海沪西分析仪器厂);真空冷冻干燥机(丹麦Heto公司);HJ-4A数显恒温多头磁力搅拌器(上海比朗仪器有限公司);PHSJ-3F pH计(上海仪电科学仪器股份有限公司);SMY-2000测色色差计(北京天创尚邦仪器设备有限公司)。
1.3 试验方法
1.3.1 刺葡萄花色苷单体的制备
以刺葡萄皮为原料,以料液比1:6加入80%乙醇(含0.03%盐酸)提取,避光浸提24 h,抽滤。滤液于0.1 MPa真空度下40 ℃条件下浓缩回收乙醇,取色素浓缩液经无水乙醚,无水乙酸乙酯萃分别萃取2次,脱除有机溶剂,真空蒸发得到花色苷粗提液。
锦葵花色苷的纯化:HP-20树脂预处理后湿法装柱,花色苷粗提液进样至吸附饱和(流出液吸光度值为上样液的1/10时。)首先用2BV蒸馏水冲洗,再用酸化乙醇(体积分数80%、含0.05%盐酸,8BV)洗脱,收集洗脱液于40 ℃真空浓缩,脱除乙醇[16]。
锦葵花色苷的单体分离[17]:Sephadex LH-20凝胶经预处理后湿法装柱,上述脱除乙醇后的洗脱液经0.22 μm微孔滤膜过滤后进柱上样,然后用酸化甲醇(体积分数50%、含0.1%的TFA)洗脱,分部收集得到3种色素,真空冻干,结构鉴定后,选取其一锦葵素-3,5-O-双葡萄糖苷(Malvidin-3,5-O-diglucoside)为试验单体。
1.3.2 有机溶剂脱水
在350 ℃条件下活化4A型分子筛8h。冷却后置于干燥器中,添加有机溶剂过夜脱水12h,取液体部分备用。
1.3.3 脂肪酶活性的测定
参考GBT 23535—2009《脂肪酶制剂》测定4种脂肪酶的活性[18]。测量脂肪酶CAL-B,脂肪酶RM IM,猪胰脂肪酶,植物脂肪酶水解比活分别是 0.25 U/mg,1.20 U/mg,0.17 U/mg,0.98 U/mg。
1.3.4 脂肪酶的筛选
在4个带塞小瓶中加入2 mL脱水2-MeTHF、0.01 mmol锦葵啶葡萄糖苷、0.10 g分子筛、0.15 mmol肉桂酸乙烯酯混合均匀,置于恒温振荡器中(45 ℃,200 r/min),分别加入40 U不同来源的脂肪酶(脂肪酶RM IM,CAL-B,猪胰脂肪酶,植物脂肪酶)启动酶促反应2 h,中止反应[19]。将溶液抽滤,收集滤液。取1 mL滤液用体积分数为0.01%的盐酸甲醇溶液稀释摇匀,定容至50 mL。测量并计算其花色苷残留率及色差。空白组参照上述方法以不添加酶样进行对照。
1.3.5 不同有机溶剂对酶活的影响
在3个带塞三角瓶中分别加入2 mL溶剂(丙酮、四氢呋喃、二甲基四氢呋喃),40 U酶(CAL-B、脂肪酶RM IM、植物脂肪酶、猪胰脂肪酶),放置于60 ℃恒温振荡器内24 h,中止反应。将溶液过滤后,置于35 ℃通风干燥箱内干燥后,测定脂肪酶活性,对比有机溶剂处理前后脂肪酶酶活变化。
1.3.6 酶添加量对花色苷酶促酰化反应的影响
在6个带塞小瓶中加入2 mL脱水2-MeTHF、0.01 mmol锦葵啶葡萄糖苷、0.10 g分子筛、0.15 mmol肉桂酸乙烯酯混合均匀,置于恒温振荡器中(60 ℃,200 r/min),分别加入不同量的CAL-B(0 U、25 U、35 U、40 U、45 U、50 U)启动酶促反应24 h,中止反应[20]。溶液抽滤,收集滤液。取1 mL滤液用体积分数为0.01%的盐酸甲醇溶液稀释摇匀,定容至50 mL。测量并计算其花色苷残留率及色差。以未添加脂肪酶作为参照组。
1.3.7 最佳分子筛添加量的确定
在5个带塞小瓶中加入2 mL脱水2-MeTHF、0.01 mmol锦葵啶葡萄糖苷、分别加入不同量的分子筛(0 g、0.05 g、0.1 g、0.15 g、0.2 g)、0.15 mmol肉桂酸乙烯酯混合均匀,置于恒温振荡器中(60 ℃,200 r/min)加入50 U脂肪酶CAL-B启动,酶促反应24 h。中止反应后,溶液抽滤,取1 mL滤液用体积分数为0.01%的盐酸甲醇溶液稀释摇匀,定容至50 mL,备用。测量并计算其花色苷残留率及色差。以未添加分子筛作为空白对照组。
1.3.8 酰基供体的筛选
在4个带塞小瓶中加入2 mL脱水2-MeTHF、0.01 mmol锦葵啶葡萄糖苷、0.15 g分子筛、0.15 mmol(肉桂酸乙烯酯、苯甲酸乙烯酯、对羟基苯甲酸)混合均匀,置于恒温振荡器(60 ℃,200 r/min)中,加入50 U脂肪酶CAL-B启动反应24 h,中止反应。将溶液抽滤,取1 mL滤液用体积分数为0.01%的盐酸甲醇溶液稀释摇匀,定容至50 mL。测量并计算其花色苷残留率及色差。空白组参照上述方法处理以不添加酰基供体对照。
1.3.9 花色苷残留率的计算
根据朗博比尔定律,溶液的浓度与其吸光度呈正比,故而可以利用紫外-可见分光光度法测量花色苷含量。对段煜[21]评定花色苷酰化效果方法进行适当修改。
取10 mL定容稀释后的滤液放置于常温条件下中避光静置1 h。在波长530 nm处测定吸光度作为初始值A0,然后置于日光光照条件下,经3 h后测定溶液在波长530 nm处的吸光度为At,以锦葵素-3,5-O-双葡萄糖苷单体进行对照。
花色苷残留率=At/A0×100%
式中 At——在40 ℃光照3 h后花色苷溶液的吸光度;
A0——光照前花色苷溶液的吸光度。
1.3.10 色差值的测定
色泽以亮度L*值、红绿a*值、黄蓝b*值表示[22]。吸取定容稀释后滤液5 mL,在40 ℃光照3 h后用测色色差计测定其色泽。记录L*、a*、b*数值。
1.3.11 紫外-可见光谱分析
在带塞小瓶中加入2 mL脱水2-MeTHF、0.01 mmol锦葵啶葡萄糖苷、0.15 g分子筛、0.15 mmol肉桂酸乙烯酯混合均匀,置于恒温振荡器(60 ℃,200 r/min)中,加入50 U不同来源的脂肪酶CAL-B启动反应24 h,中止反应。将溶液抽滤后,取1 mL滤液用体积分数为0.01%的盐酸甲醇溶液稀释摇匀,定容至50 mL。在200~700 nm波长范围内进行紫外-可见光谱扫描,分析其光谱特征[23]。用锦葵啶葡萄糖苷参照上述方法处理但不添加酶样进行对照。
1.3.12 酰化产物的亲脂性测定
通过测定物质的油水分配系数对其亲脂性进行评价。将100 μm的未酰化的锦葵啶葡萄糖苷和己酰化的锦葵啶葡萄糖苷溶解于2 mL的正辛醇当中,分别加入2 mL的水,200 r/min下离心10 min后,静置,对正辛醇层和水层进行分液,分别用旋转蒸发仪旋转蒸干,测定正辛醇和水层中的物质含量,并计算分配系数,平行试验3次,取其平均值。结果以logP表示,方程式如下:
P= Co/Cw
式中 Co——平衡时物质在正辛醇相中的浓度;
Cw——平衡时物质在水相中的浓度。
1.3.13 数据统计
每组试验设定3次重复试验,结果以平均值±标准偏差表示。数据用SPSS 17.0进行显著性分析检验(显著性水平为p<0.05)。
2 结果与分析
2.1 最佳有机溶剂的确定
试验选取丙酮、二甲基四氢呋喃和四氢呋喃三种有机溶剂进行筛选,对比RM IM、CAL-B、猪胰脂肪酶和植物脂肪酶在不同有机溶剂中酶活的变化。结果如表1所示,四种酶在二甲基四氢呋喃和四氢呋喃溶剂中酶活损失均较小;RM IM和CAL-B在二甲基四氢呋喃溶剂中的酶活损失率最低,分别为21.67%和16%,因此选取二甲基四氢呋喃作为花色苷酶促酰化反应的反应介质。
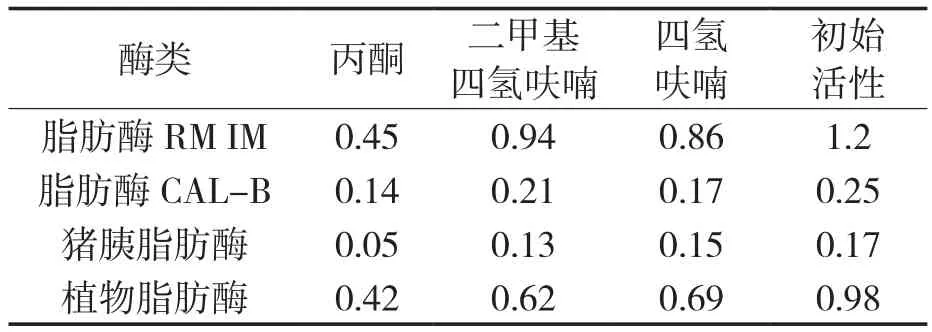
表1 不同有机溶剂中酶的活性Tab.1 The activity of enzymes in different organic solvents U/mg
2.2 脂肪酶种类对酶促酰化的影响
试验对比四种脂肪酶催化花色苷酶促酰化反应的效果,利用反应后花色苷的残留率和色差变化确定最佳脂肪酶试剂。花色苷残留率越高,说明花色苷在光照条件下分解的量越少,证明花色苷更稳定。由图1可知,四种脂肪酶催化花色苷酰化反应后,花色苷残留率均得到提升,进一步证明了酰化能有效地提升花色苷的稳定性。其中由脂肪酶RM IM和脂肪酶CAL-B催化效果最好,酰化后花色苷的残留率最高,由脂肪酶CAL-B催化后酰化产物残留率达88.1%。对比酰化后花色苷残留率,确定脂肪酶的优先选择为:CAL-B>RM IM。研究表明:花色苷的含量与L*亮度呈负相关,与a*红色色调呈正相关[24]。
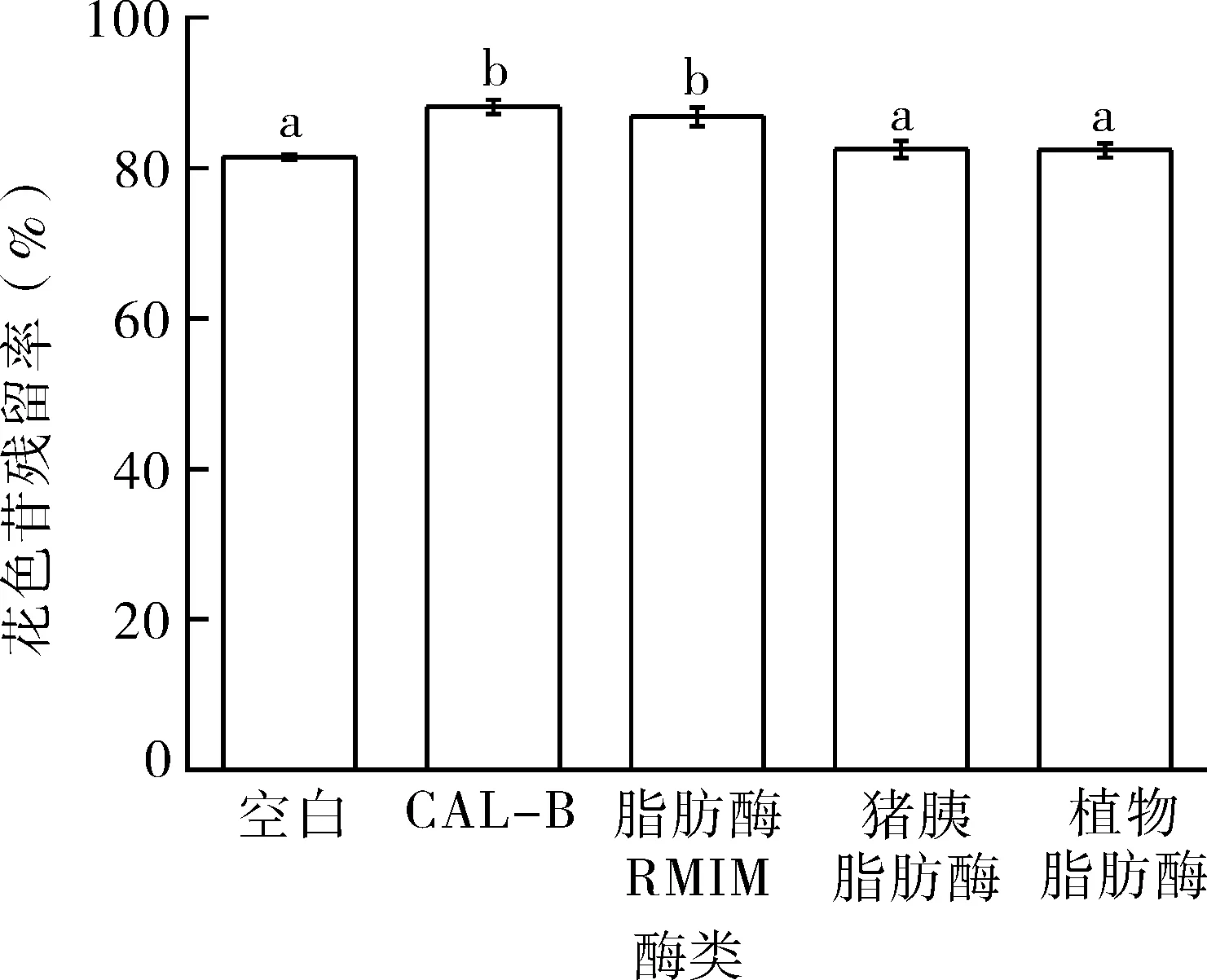
图1 脂肪酶种类对酰化产物花色苷残留率的影响Fig.1 The effects of lipases on the residue rate of anthocyanin in acylates
四种脂肪酶酶促酰化后花色苷的色差值如表2所示,与未酰化的花色苷相比,酰化花色苷的L*亮度下降,a*红色色调上升,光照处理后酰化花色苷的含量较未酰化花色苷的多,酰化花色苷更稳定,进一步证明了酰化能够提高花色苷的稳定性。其中使用脂肪酶CAL-B催化花色苷酰化反应,花色苷的L*亮度最低,a*红色色调最高,说明酶促酰化反应效果最好。综合比较不同脂肪酶对花色苷的残留率和色差值影响,脂肪酶CAL-B的酶促酰化效果最好,因此选择脂肪酶CAL-B作为花色苷酶促酰化反应体系的目的用酶。

表2 不同种类的酶对酶促酰化锦葵啶葡萄糖苷色差值的影响Tab.2 Effects of the types of enzymes on the color of enzymatic acylated malvidin glocoside
2.3 最佳脂肪酶添加量的确定
由图2可知,当脂肪酶添加量为0至45 U时,随着脂肪酶添加量的增加,酰化后花色苷的残留率呈增长趋势,此时脂肪酶添加量越多,花色苷更稳定,酰化效果越好。而脂肪酶添加量从45 U到50 U时,花色苷残留率虽有增大,但效果不显著。另根据花色苷色差值与其含量的关系,考察脂肪酶添加量对花色苷色差的影响,结果如表3所示。与空白对照对比,随着脂肪酶添加量的不断增加,花色苷的L*亮度不断降低,a*红色色调逐渐上升,随着酶添加量的增加,这一变化趋势不再显著。考虑酶在贮藏过程中容易失活,适当多添加脂肪酶易提高脂肪酶与底物作用,促进酰化反应进行,综合考虑选取50U为脂肪酶最佳量。
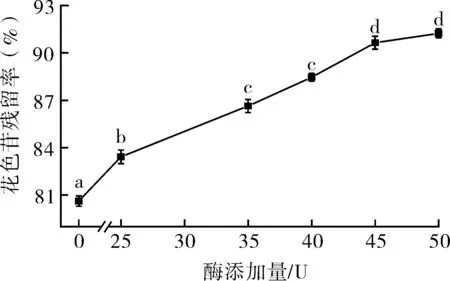
图2 酶添加量对酰化产物花色苷残留率的影响Fig.2 The effects of enzyme amount on the residue rate of anthocyanin in acylates
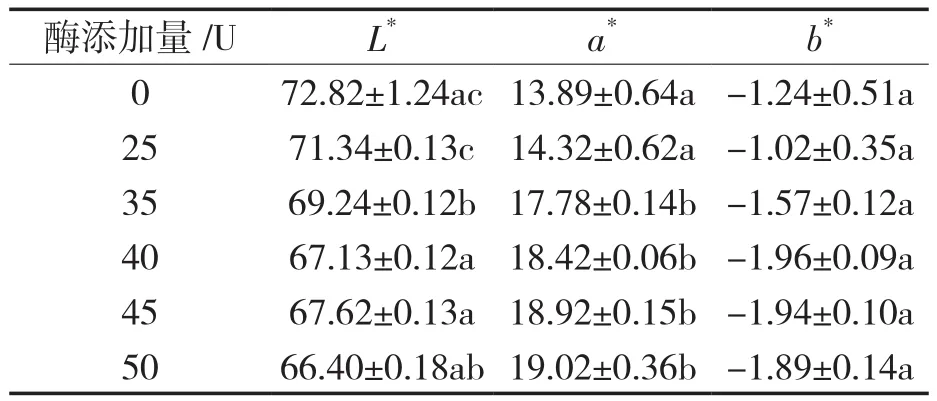
表3 酶添加量对酶促酰化锦葵啶葡萄糖苷差值的影响Tab.3 Effects of enzyme amount on the color difference of the enzymatic acylated malvidin glocoside
2.4 最佳分子筛添加量的确定
在花色苷酶促酰化反应中,添加分子筛的目的为控制酶反应体系的含水量,在适当的含水量下会促进酰化反应的进行[25]。不同分子筛添加量对花色苷残留率的影响如图3所示,添加分子筛后,酶促酰化反应体系中含水量降低,产物花色苷的残留率得到提高,花色苷的稳定性得到提升。其中,当分子筛添加量从0至0.15 g过程中,随着分子筛添加量的增加,产物花色苷残留率提高效果显著,而继续增加分子筛添加量至0.2 g,增速减缓,提升效果不显著。另外,分子筛添加量对酶促酰化锦葵啶葡萄糖苷色差同样具有显著影响,结果如表4所示。
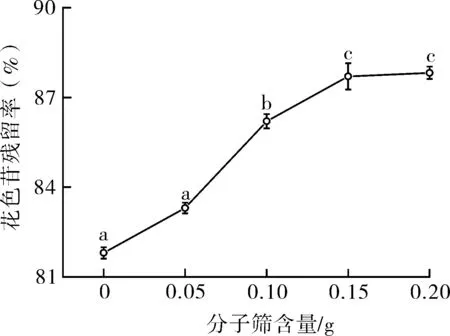
图3 分子筛添加量对酰化产物花色苷残留率的影响Fig.3 The effects of molecular sieve addition amount on the residue rate of anthocyanin in acylates
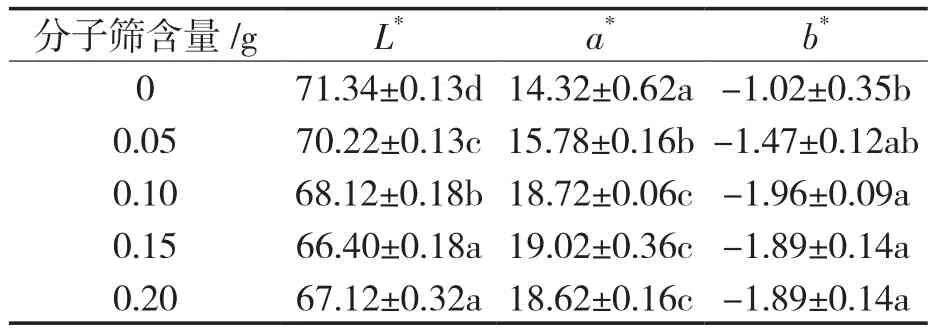
表4 分子筛添加量对酶促酰化锦葵啶葡萄糖苷色差的影响Tab.4 Effects of molecular sieve addition amount on the color difference of the enzymatic acylated malvidin glocoside
对比空白组,在分子筛添加量为0~0.15 g时,随着分子筛添加量的增加,产物的L*亮度呈降低趋势,a*红色色调呈上升趋势,此时分子筛添加量越多,反应体系含水量越少,酰化产物越稳定,酰化效果越好。当分子筛的添加量从0.15 g加到0.2 g时,花色苷的L*亮度反而增加,a*红色色调降低,这是因为在无水体系中,酶促酰化反应反应困难,底物转化率低于10%,当体系中水含量为10%左右时,底物的最大转化率提高到90%。因此,继续增加分子筛的添加量,反应体系的水含量会更低,反而不利于酰化反应的进行。综合考虑,确定分子筛的最佳添加量为0.15 g。
2.5 酰基供体的筛选
可用于酶促酰化反应的酰基供体可分为两类:(1)形成可逆反应的酰基供体,如羧酸烷基酯和羧酸等。选取此类酰基供体的酰化反应的反应速度和产率都较低。(2)形成不可逆反应的酰基供体,如乙烯酯类[26-27]。此类酰基供体具有很多优良性质,当受体与酰基供体发生作用后,生成的不稳定的烯醇产物会迅速转化成稳定的酮或醛。不同酰基供体对花色苷残留率和色差的影响如图4和表5所示。可以看出,选取肉桂酸乙烯酯作为酰基供体时,酰化产物的残留率最高,L*亮度最低,a*红色色调最高,说明酰化产物稳定性最好,因此选取肉桂酸乙烯酯作为酰化反应的酰基供体。
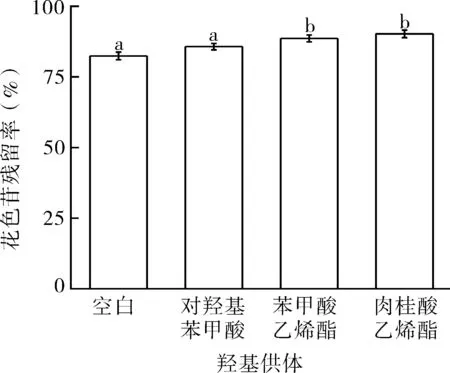
图4 酰基供体对酰化产物花色苷残留率的影响Fig.4 The effect of acyl donor on the residue rate of anthocyanin in acylates

表5 酰基供体对酶促酰化锦葵啶葡萄糖苷色差影响Tab.5 Effects of acyl donor on the color difference of the enzymatic acylated malvidin glocoside
2.6 紫外-可见光谱分析
酶促酰化前后的锦葵啶葡萄糖苷紫外可见光谱如图5所示。由图5可知,锦葵啶葡萄糖苷在530 nm,290 nm处附近均有明显特征峰最大吸收峰,样品可以确定为花色苷样品;酶促酰化处理后的锦葵啶葡萄糖苷样品在535 nm处以及290 nm有花色苷特征吸收峰,且在325 nm附近出现了酰化基团特征峰,证明酶促酰化处理具有酰化效果,生成得到酰化锦葵啶葡萄糖苷。
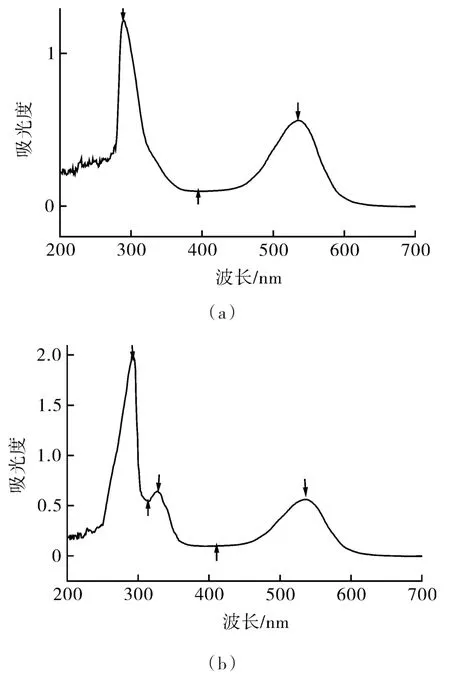
图5 酶促酰化前后锦葵啶葡萄糖苷紫外光谱图Fig.5 The ultraviolet-visible spectra of the sample before and after enzymatic acylation of malvidin glocoside
2.7 酰化锦葵啶葡萄糖苷亲脂性分析
由表6可知,未酰化的锦葵啶葡萄糖苷的油水分配系数为0.23,基本是没有亲脂性的,而经过酰基供体酰化后的锦葵啶葡萄糖苷的油水分配系数达到了3.68,亲脂性明显增强。此油水分配系数反应了物质的亲脂性,由此可以证明酰化后的锦葵啶葡萄糖苷具有良好的亲脂性,大大拓宽了锦葵啶葡萄糖苷的使用范围和应用领域。

表6 锦葵啶葡萄糖苷酰化前后脂溶性的比较Tab.6 Comparison of fat solubility before and after acylation of malvidin glocoside
3 结论
(1)建立得到锦葵啶葡萄糖苷酶促酰化反应体系。以酶活为指标,从三种有机溶剂反应介质(丙酮,2-MeTHF、THF),选出酶促酰化最佳反应溶剂。结果表明不同种类的酶,在有机溶剂介质中耐受度不同,四种酶均在2-MeTHF中保持有良好的酶活性,其中两种固定化脂肪酶优于两种酶粉,酶活损失较少,而CAL-B耐受性最好,筛选出最佳反应溶剂为2-MeTHF;以酰化产物花色苷残留率及色差值为指标,对比分析四种脂肪酶(CAL-B、脂肪酶RM IM、猪胰脂肪酶、植物脂肪酶)酰化效果,筛选出CAL-B为最佳用酶;对比三种酰基供体(肉桂酸乙烯酯,苯甲酸乙烯酯,对羟基苯甲酸),筛选得出肉桂酸乙烯酯为最佳酰基供体。
(2)以酰化产物花色苷残留率及色差值为指标,考查分子筛添加量,酶添加量对锦葵啶葡萄糖苷酶促酰化效果影响。结果表明分子筛以及酶量均对锦葵啶葡萄糖苷酶促酰化有促进效果,对L*值,a*值有显著性影响,试验结果表明分子筛添加量为0.15 g,酶添加量为50 U为最佳试验条件。
(3)按照所建立的反应体系,以2-MeTHF为有机溶剂,CAL-B为酰化酶,肉桂酸乙烯酯为酰基供体,分子筛添加量为0.15 g,酶添加量为50 U为酶促酰化反应条件,对结果进行紫外-可见光谱分析。对比酰化前后试样的紫外-可见光谱,在325 nm附近出现了酰化基团特征峰,说明发生了不可逆酰化反应。
(4)通过酰基化反应对锦葵啶葡萄糖苷进行分子修饰,提纯分离制备后旋干备用,通过测定其油水分配系数来测定其亲脂性。被酰化的花色苷的油水分配系数由0.23提高到7.68,亲脂性明显提高,为花色苷在食品领域广泛应用提供了保障。相较未酰化的锦葵啶葡萄糖苷,酰化后的锦葵啶葡萄糖苷的热稳定性显著提高,可以推断酰化是锦葵啶葡萄糖苷稳定性提高的根本原因。

