基于PI3K/Akt通路研究利拉鲁肽对2型糖尿病骨质疏松大鼠的作用
张莹 周艳红 李江雁 赵建林 吴苏豫 熊承云 孙超
新乡市中心医院,河南 新乡 453000
2型糖尿病性骨质疏松(type 2 diabetic osteoporosis,T2DOP)属全身性代谢疾病,主要影响骨量丢失和骨组织改变,诱发病理性骨折,导致致残率、死亡率增加[1]。寻找安全有效的治疗方法是目前治疗T2DOP的重点。利拉鲁肽作为一种人胰高血糖素样肽-1类似物,可直接或间接影响胰高血糖素分泌,从而改变胰岛功能[2]。磷脂酰肌醇-3-激酶/丝苏氨酸蛋白激酶(phosphateidylinositol-3 kinase/serine-threonine kinase,PI3K/Akt)通路是重要的胰岛素信号通路,是胰岛素发挥作用的重要传导通路[3];同时亦是骨代谢的主要调节因子,可以定向诱导骨分化,促进骨形成[4]。但利拉鲁肽是否通过PI3K/Akt通路在T2DOP中发挥作用尚不清楚。因此,本研究通过高脂高糖饲料、链脲佐菌素(streptozocin,STZ)并摘除卵巢诱导建立T2DOP大鼠模型,探究利拉鲁肽对T2DOP大鼠的作用及机制。
1 材料与方法
1.1 实验动物
健康雌性SD大鼠,SPF级,购自华中科技大学实验动物中心,体重(200±10)g,动物生产许可证号:SCXK(鄂)2019-0007,动物使用许可证号:SYXK(鄂)2019-0021,动物质量合格证号:JS19034721。在温度(24±0.5)℃、光照/黑暗(12/12) h、正常饮水摄食条件下饲养。对实验动物实行人道主义关怀,符合3R原则。
1.2 主要试剂与仪器
PI3K抑制剂LY294002(成都易莱生物科技有限公司,批号:T2008);利拉鲁肽注射液(诺和诺德中国制药有限公司,规格3 mL∶18 mg,批号:20190317);STZ(美国Sigma公司,批号:S0131);苏木精-伊红(hematoxylin-eosin staining,HE)染色试剂盒(上海生工生物技术公司,批号:E607318);聚偏氟乙烯膜(碧云天生物技术研究所,批号:FFP28);大鼠骨保护素(osteoprotegerin,OPG)、细胞核因子KB受体活化因子配基(receptor activator of nuclear factor-kB ligand,RANKL)酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒、羊抗鼠磷酸化-PI3K(p-PI3K)、PI3K、磷酸化-Akt(p-Akt)、Akt、GAPDH一抗、羊抗鼠IgG二抗(英国abcam公司,批号分别为:ab255723、ab269553、ab109006、ab139307、ab00133、ab8805、ab151279、ab6721)。血糖仪(上海罗氏制药有限公司,型号:BG-102);显微镜(日本奥林巴斯公司,型号:CKX53);双能X射线密度仪(上海硕舟电子科技有限公司,型号:CB3351MD);凝胶成像系统(美国伯乐公司,型号:Gel Doc XR+)。
1.3 动物分组及给药处理
高脂高糖饲料提前混匀,各组分比例:正常饲料66.5%、猪油30%、胆固醇2.5%、脱氧胆酸1%。大鼠参考文献[5]建立T2DOP模型,高脂高糖饲料饲养大鼠8周,8周末禁食12 h后腹腔注射30 mg/kg STZ建立2型糖尿病(type 2 diabetes mellitus,T2DM)模型,T2DM模型以尾静脉采血空腹血糖水平高于16.7 mmol/L为造模成功,42只大鼠模型成功30只,成功率71.43%;T2DM模型建立成功后采用摘除卵巢方法制备骨质疏松(osteporsis,OP)模型,30只大鼠按随机数表法分为模型组、利拉鲁肽组、利拉鲁肽+LY294002组,每组10只;另设正常饲养大鼠10只作为正常组。利拉鲁肽组皮下注射0.6 mg/kg利拉鲁肽[6],利拉鲁肽+LY294002组皮下注射0.6 mg/kg利拉鲁肽和1 mg/kg LY294002的混合物[7],正常组和模型组皮下注射等体积生理盐水,1次/d,连续8周。
1.4 指标检测
1.4.1体重检测:实验结束后称量大鼠体重。
1.4.2血糖仪检测血糖水平:尾静脉抽血,血糖仪检测尾静脉血中空腹血糖(fasting blood glucose,FBG)水平。
1.4.3HE染色观察大鼠股骨组织形态:立即处死大鼠,股骨组织置于4%多聚甲醛中固定,EDTA脱钙液脱钙处理。HE染色试剂盒检测大鼠股骨组织情况,显微镜下拍照观察。
1.4.4ELISA检测血清中OPG、RANKL水平:尾静脉血室温静置2 h,3 000 r/min离心15 min,取上清,大鼠OPG、RANKL ELISA试剂盒检测血清中OPG、RANKL水平。
1.4.5双能X射线吸收法测定股骨组织骨密度:双能X射线密度仪检测各组股骨组织骨密度。
1.4.6蛋白免疫印迹检测股骨组织中p-PI3K、PI3K、p-Akt、Akt蛋白水平:股骨组织立即浸入液氮中,研磨至细粉,加入RIPA强效裂解液,冰上匀浆30 min,4 ℃离心机3 500 r/min离心20 min,吸取上清即为股骨组织总蛋白。蛋白样品经聚丙烯酰胺凝胶电泳分离转至聚偏氟乙烯膜上,5%脱脂奶粉封闭;分别加入一抗p-PI3K、PI3K、p-Akt、Akt、GAPDH(均为1∶2000稀释),4 ℃孵育过夜;加入羊抗鼠IgG二抗(1∶5000稀释),室温孵育1 h。凝胶成像系统对条带进行灰度分析。
1.5 统计学分析

2 结果
2.1 利拉鲁肽对大鼠体重及FBG的影响
与正常组相比,模型组大鼠体重、FBG水平升高(P<0.05);与模型组相比,利拉鲁肽组大鼠体重、FBG水平降低(P<0.05);与利拉鲁肽组相比,利拉鲁肽+LY294002组大鼠体重、FBG水平升高(P<0.05)。见表1。

表1 4组大鼠体重、FBG水平比较Table 1 Comparison of body weight and FBG level among rats in 4 groups (n=10,
2.2 利拉鲁肽对大鼠股骨组织形态的影响
正常组骨小梁形态正常;模型组骨小梁破坏严重,出现明显断裂现象,变薄和分离明显;利拉鲁肽组骨小梁空隙间隔有所缓解,数量有所增加,厚度有所增厚;利拉鲁肽+LY294002组相较于利拉鲁肽组骨小梁断裂明显,厚度降低。见图1。
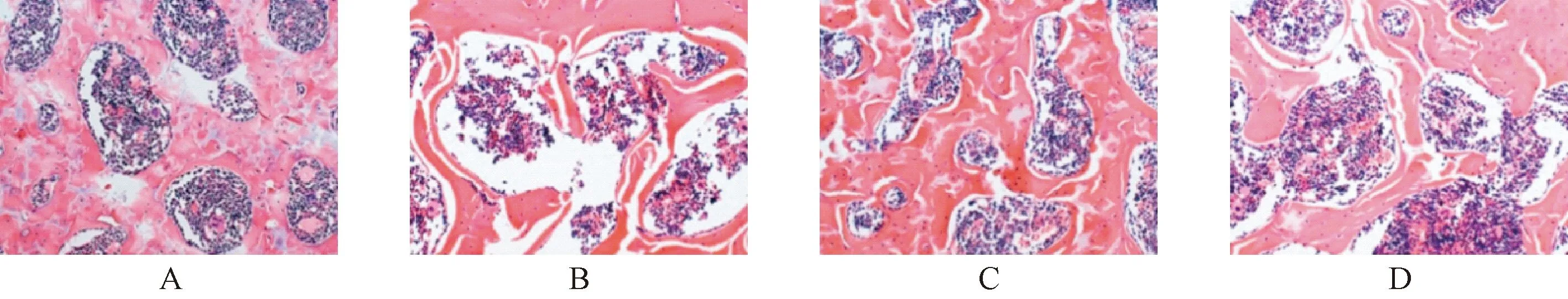
图1 4 组大鼠股骨组织形态情况(HE染色,400×)A:正常组,B:模型组,C:利拉鲁肽组,D:利拉鲁肽+LY294002组Fig.1 The morphology of the femur in rats of the 4 groups (HE staining, 400×)A: Normal group; B: Model group; C: Liraglutide group; D: Liraglutide + LY294002 group
2.3 利拉鲁肽对大鼠血清中OPG、RANKL水平的影响
与正常组相比,模型组大鼠血清中OPG水平降低、RANKL水平升高(P<0.05);与模型组相比,利拉鲁肽组大鼠血清中OPG水平升高、RANKL水平降低(P<0.05);与利拉鲁肽组相比,利拉鲁肽+LY294002组大鼠血清中OPG水平降低、RANKL水平升高(P<0.05)。见表2。

表2 4组大鼠血清中OPG、RANKL水平比较Table 2 Comparison of serum OPG and RANKL levels in rats of the 4 groups
2.4 利拉鲁肽对大鼠股骨组织骨密度的影响
与正常组相比,模型组大鼠股骨组织骨密度降低(P<0.05);与模型组相比,利拉鲁肽组大鼠股骨组织骨密度升高(P<0.05);与利拉鲁肽组相比,利拉鲁肽+LY294002组大鼠股骨组织骨密度降低(P<0.05)。见表3。
表3 4组大鼠股骨组织骨密度比较Table 3 Comparison of bone mineral density of the femur in rats of the 4 groups (n=10,
2.5 利拉鲁肽对大鼠股骨组织中p-PI3K、PI3K、p-Akt、Akt蛋白水平的影响
与正常组相比,模型组大鼠股骨组织中p-PI3K/PI3K、p-Akt/Akt蛋白水平降低(P<0.05);与模型组相比,利拉鲁肽组大鼠股骨组织中p-PI3K/PI3K、p-Akt/Akt蛋白水平升高(P<0.05);与利拉鲁肽组相比,利拉鲁肽+LY294002组大鼠股骨组织中p-PI3K/PI3K、p-Akt/Akt蛋白水平降低(P<0.05)。见图2、表4。
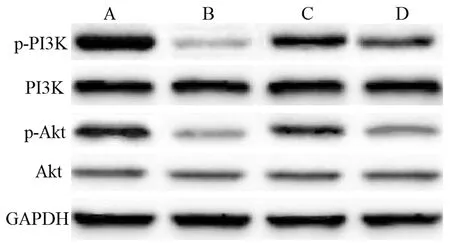
图2 4组大鼠股骨组织中p-PI3K、PI3K、p-Akt、Akt蛋白情况A:正常组;B:模型组;C:利拉鲁肽组;D:利拉鲁肽+LY294002组Fig.2 p-PI3K, PI3K, p-Akt, and Akt proteins in the femoral tissues of rats in the 4 groupsA: Normal group; B: Model group; C: Liraglutide group; D: Liraglutide + LY294002 group

表4 4组大鼠股骨组织中p-PI3K、PI3K、p-Akt、Akt蛋白水平比较Table 4 Comparison of protein levels of p-PI3K, PI3K, p-Akt, and Akt in the femur in rats of the 4 groups (n=10,
3 讨论
糖尿病可诱发多个系统和器官损害,在骨骼系统中导致骨质疏松、骨折愈合延迟或不愈合现象,造成骨形成和骨吸收打破,使骨代谢紊乱,影响患者生活质量及预后[8]。在发病机制中,胰岛素分泌不足、胰岛素抵抗,胰高血糖素分泌增加是2型糖尿病的重要发病机制[9]。而抑制胰高血糖素高分泌研究相对较少。胰高血糖素样肽-1不仅可改善胰岛β细胞功能、增加胰岛β细胞数量,同时可抑制胰岛α细胞上N型钙离子通道等,共同作用抑制胰高血糖素的分泌,从而改善胰岛α细胞对葡萄糖的敏感性,从而达到降血糖的目的[10],而利拉鲁肽作为胰高血糖素样肽-1类似物,可能具有类似效应。本研究发现,与正常组相比,模型组体重、FBG水平升高,骨小梁破坏严重、骨密度降低,提示T2DOP大鼠模型制备成功。而利拉鲁肽作用后发现大鼠体重下降、血糖水平有所降低,骨小梁结构有所缓和,骨组织功能得以缓解,骨密度升高,证明利拉鲁肽可以缓解T2DOP症状,但其作用机制尚需研究。
OPG作为可溶性糖蛋白,对骨组织有特异性作用,可诱导破骨细胞分化、成熟等,可增加骨密度、抑制破骨细胞生成,是骨细胞分化的决定性分子[11]。RANKL是破骨细胞前体细胞分化的关键因子,能够促进破骨细胞分化、促进骨吸收,是调节骨质重建的关键因子[12]。OPG与RANKL相互调节,可评估骨损伤情况,升高OPG、降低RANKL可阻断钙质流失和骨质流失[13]。PI3K/Akt通路存在于所有哺乳动物中,且受细胞外一系列信号的转导[14],其中PI3K作为一种信号分子,参与胰岛素信号通路过程,导致T2DOP的产生[15];LY294002作为PI3K抑制剂,可特异性抑制PI3K上p110亚单位,阻止下游3,4,5-三磷酸肌醇底物的产生[16]。Akt作为一种丝/苏氨酸蛋白激酶,PH结构域可与3,4,5-三磷酸肌醇底物结合,使得Akt激酶聚集于质膜上,使得相关基因磷酸化,进而影响下游的相关靶基因[17]。而Akt是由RANKL在破骨细胞生成过程中激活的一种信号转导分子,RANKL可进入细胞,介导骨髓基质细胞或成骨细胞分泌的相关因子与破骨细胞前体细胞表面的受体结合,同时再介导Akt通路等参与破骨细胞成熟[18]。且PI3K/Akt通路在糖尿病[19]和骨质疏松[20]中均研究广泛。本研究发现,与正常组相比,模型组大鼠血清中OPG水平、股骨组织中p-PI3K/PI3K、p-Akt/Akt蛋白水平降低,血清中RANKL水平升高,提示在T2DOP大鼠中PI3K/Akt通路受到抑制,从而降低骨密度、增加破骨细胞生成、分化,影响骨质重建。添加利拉鲁肽后PI3K/Akt通路被激活从而升高OPG水平、降低RANKL水平,导致骨密度增加且同时抑制破骨细胞分化,钙质流失和骨质流失,从而缓解高脂肪导致的骨质疏松。在利拉鲁肽基础上添加LY294002可逆转PI3K/Akt通路,且与单纯的添加利拉鲁肽相比,大鼠骨质疏松症状严重,说明利拉鲁肽在T2DOP中通过激活PI3K/Akt通路发挥作用。
综上所述,利拉鲁肽在T2DOP大鼠中通过激活PI3K/Akt通路增加骨密度、抑制破骨细胞生成从而缓解疾病。但PI3K/Akt通路对骨密度、破骨细胞的具体作用机制尚不清楚,是下一步研究重点。

