肉碱棕榈酰转移酶1的生物学功能及其对肉品质影响的研究进展
张 月 靳 烨 郭月英 要 铎
(内蒙古农业大学食品科学与工程学院,呼和浩特 010018)
动物机体贮存能量主要通过脂肪沉积实现,体内脂肪沉积的增加或减少都会影响肉品质,如嫩度和多汁性[1]。脂肪酸是机体重要的能源和功能性物质,其组成及含量能够改善肉类风味,提高肉类食用价值。其中,饱和脂肪酸(saturated fatty acid,SFA)能延长货架期,多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)是香味重要的前体物质,且在加热过程中能够生成酯、酮和醇等风味物质[2]。长链脂肪酸(long chain fatty acid,LCFA)进行β-氧化生成腺苷三磷酸(adenosine triphosphate,ATP),能够促进畜禽体内脂肪消耗,降低脂肪含量,提高瘦肉率,改善肉品质[3]。肉碱棕榈酰转移酶1(carnitine palmitoyl transferase 1,CPT1)作为脂肪酸氧化过程中的一种限速酶,参与调节脂肪酸氧化过程。目前,哺乳动物的CPT1主要有3种特异亚型,分别是肝脏型肉碱棕榈酰转移酶1(CPT1A)、肌肉型肉碱棕榈酰转移酶1(CPT1B)和脑型肉碱棕榈酰转移酶1(CPT1C)。研究表明,CPT1B在绵羊各个组织中的表达量存在明显差异,并且这种差异会影响各组织间的线粒体氧化能力,进而影响机体脂肪含量[4-5]。此外,高脂状态下敲除小鼠CPT1C后,CPT1A和CPT1B表达出现上调,同时小鼠血液中游离脂肪酸的浓度升高,肝脏和骨骼肌肌内脂肪酸氧化能力减弱,甘油三酯积聚,更容易导致小鼠患肥胖症和糖尿病[6]。因此,CPT1作为肉碱转运系统中调控脂质代谢的相关物质,参与调节脂肪酸氧化[7],改善机体脂肪沉积,影响畜禽肉品质,值得进一步研究。
1 CPT1的生物特性
1.1 CPT1的结构
CPT1是线粒体外膜内表面跨膜蛋白,反应底物为肉碱和脂酰辅酶A,产物为辅酶A和脂酰肉碱。CPT1有1个短的N端和1个长的C端结构域,其被2个跨膜结构和1个短连接环隔开。N端的疏水跨膜区域是定位丙二酰辅酶A(malonyl-Coa,M-CoA)敏感性和线粒体外膜的结构,C端是肉碱结合催化结构域[8]。CPT1A蛋白N末端在Nα(M-CoA敏感)和Nβ(M-CoA不敏感)构象之间移动,同时CPT1A可以形成寡聚复合物,可能与它对M-CoA的敏感性有关(图1-A),而CPT1C的N末端始终处于Nα构象(图1-B);CPT1C的C端结构域比其他亚型长约30个残基,编码含有798个氨基酸的蛋白[9-11]。研究表明,大鼠CPT1A基因位于1号染色体上,含有2 319个碱基,编码含有773个氨基酸残基的蛋白,而CPT1B基因位于22号染色体上,含有2 316个碱基,编码含有772个氨基酸残基的蛋白[12]。目前,大鼠的CPT1A、CPT1B的cDNAs都已经被克隆并测序。
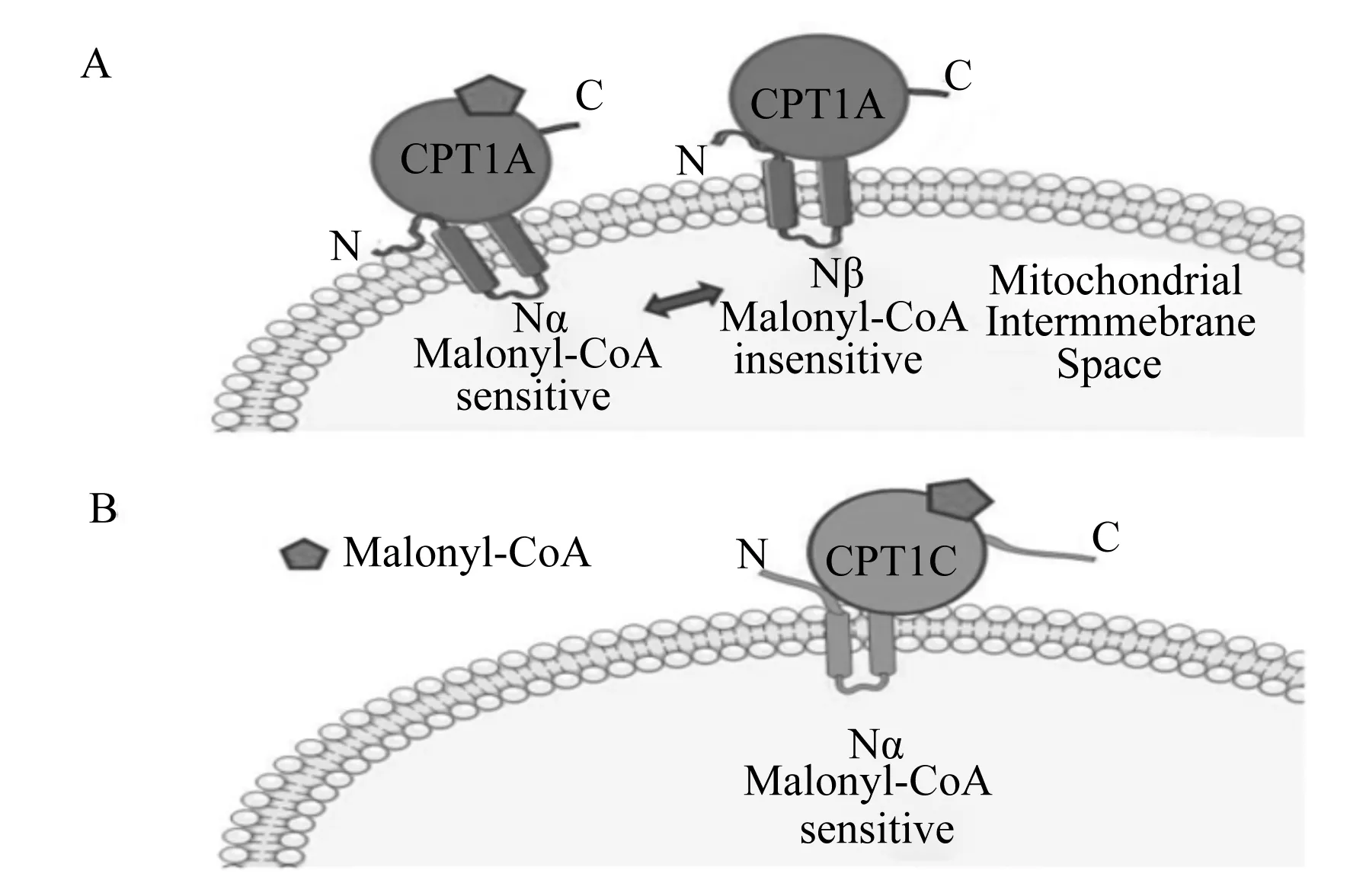
N:N末端 N terminatio;CPT1A:肝脏型肉碱棕榈酰基转移酶1 liver type carnitine palmitoyl transferase 1;C:C末端 C terminatio;Nα Malonyl-CoA sensitive:Nα构象 丙二酰辅酶A敏感;Nβ Malonyl-CoA insensitive:Nβ构象 丙二酰辅酶A不敏感;Mitochondrial Intermmebrane Space:线粒体膜内空间;Malonyl-CoA:丙二酰辅酶;CPT1C:脑型肉碱棕榈酰基转移酶1 brain type carnitine palmitoyl transferase 1。
1.2 CPT1的主要功能
脂酰辅酶A合成酶在脂肪酸氧化过程中作用于游离LCFA,活化为长链脂酰辅酶A,进行β-氧化。由于长链脂酰辅酶A缺乏穿越线粒体内膜的通透性,因此这一过程需要由长链脂酰辅酶A的脂酰基与CPT1的羟基结合形成脂酰肉碱,经脂酰肉碱/肉碱转位酶(carnitine-fatty acylcarnitine translocase,CACT)穿过内膜进入基质,最终在内膜内表面同工酶肉碱棕榈酰基转移酶2(carnitine palmitoyl transferase 2,CPT2)催化下,使脂酰基从肉碱的羟基上脱离,成为脂酰辅酶A和肉碱。完成β-氧化后,基质中的CACT转运到线粒体内外膜间隙,参加下一次转运[13](图2)。CPT1是脂肪酸β-氧化过程中的关键酶,能够调节机体脂质代谢,改善机体脂肪含量。

Long chain fatty acid:长链脂肪酸;LACS:长链酰基辅酶A long chain acyl coenzyme A;Acyl-CoA:脂酰辅酶A acyl coenzyme A;Carnitine:肉碱;CPT1:肉碱棕榈酰基转移酶1 carnitine palmitoyl transferase 1;Acylcarnitine:酰基肉碱;CACT:脂酰肉碱/肉碱转位酶 carnitine-fatty acylcarnitine translocase;CPT2:肉碱棕榈酰基转移酶2 carnitine palmitoyl transferase 2;β-oxidation:β-氧化;Cytoplasm:细胞质;Outer mitochondrial membrane:线粒体外膜;Inner mitochondrial membrane:线粒体内膜;Mitochondrial matrix:线粒体基质。
2 影响CPT1活性的因素
CPT1是脂肪酸氧化的调控因子,目前,影响CPT1活性的主要因素有M-CoA、细胞骨架蛋白磷酸化、微小RNA(microRNAs,miRNAs)、激素、运动等[14-15]。
2.1 M-CoA
M-CoA是CPT1主要的内源性抑制剂,是长链脂肪酸进行β-氧化的抑制因子,主要通过M-CoA含量急性调控CPT1活性,同时CPT1对M-CoA的敏感性也能改变CPT1活性[16]。Mc Garry等[17]最早发现,M-CoA对脂肪酸氧化有调节作用。细胞内M-CoA含量与LCFA氧化程度有关,在脂肪组织、肝脏及缺乏脂肪酸从头合成能力的心脏或骨骼肌中,其含量与脂肪酸氧化率成反比[18]。饥饿状态下,M-CoA对CPT1抑制减弱,CPT1活性增强,长链脂肪酸氧化增强,脂肪合成减少;进食后,CPT1被抑制活性较低,长链脂肪酸直接进行酯化反应进行能量储存,因此,CPT1对心脏和骨骼肌中的能量平衡有重要作用[19]。
M-CoA主要由丙二酰辅酶A脱羧酶(malonyl-CoA decarboxylase,MCD)和乙酰辅酶A羧化酶(acetyl-CoA carboxylase,ACC)调控,MCD上调或ACC下调都会降低M-CoA含量,导致CPT1活性上升,脂肪酸氧化作用增强,影响脂质和色素氧化。研究表明,脂肪酸过氧化会增加机体自由基和肉质脂质氧化性,破坏生物膜和酶活性,降低肉的色泽[20]。
动物机体中ACC通常以2种亚型(ACC1和ACC2)表达,ACC1主要在脂肪组织中表达,ACC2主要在骨骼肌中表达,在哺乳动物体中,ACC1和ACC2高度保守,2种亚型之间主要有2点不同,首先ACC1是细胞质蛋白,而ACC2是线粒体蛋白;其次ACC2的前200个氨基酸残基不存在于ACC1中,这段序列对线粒体脂肪酸氧化有独特的作用,即能够与线粒体外膜结合,从而竞争性抑制其与M-CoA结合,抑制CPT1活性[21-22]。Abu-Elheiga等[23]敲除小鼠ACC2,发现小鼠的心脏和骨骼肌中M-CoA含量显著降低,体内脂肪含量也较少,即使增加食物摄取量,小鼠体内脂肪含量仍较低,其可能的原因是ACC2与CPT1之间的通道受到了阻碍[24]。ACC2活性受AMP活化的蛋白激酶(AMP-activated protein kinase,AMPK)磷酸化调控,CPT1在外周组织中最主要的活性调节的方式为AMPK-M-CoA信号途径,对脂肪酸合成和氧化途径进行开关,调节生物体的能量状态和代谢需求[25]。AMPK的活性主要由腺苷一磷酸(adenosine monophosphate,AMP)与ATP的比值调控,机体在低能量状态时,消耗ATP,激活AMPK,ACC失活,M-CoA含量下降,促进脂肪分解。Ok等[26]研究表明,AMPK磷酸化能够促进CPT1蛋白表达,减少脂肪含量。
除了M-CoA含量影响CPT1活性外,CPT1对M-CoA的敏感性变化也会影响CPT1活性。在胰岛素水平不足或甲状腺激素过多时,CPT1变得更活跃,M-CoA和长链脂酰CoA竞争与CPT1结合,M-CoA抑制CPT1作用减弱,脂肪酸氧化加强。CPT1对M-CoA敏感性的作用机理与线粒体膜脂质环境的改变有关,当除去禁食大鼠线粒体外膜的脂肪时,M-CoA对CPT1抑制作用增强,但将心磷脂加入到大鼠分离得到的线粒体内能恢复M-CoA对CPT1的抑制,因此心磷脂可能是CPT1发挥作用所需的特异膜环境[27]。
2.2 细胞骨架蛋白磷酸化
细胞骨架在调节代谢途径、信号转导系统和线粒体动力学方面都有作用,因此细胞骨架作为潜在的CPT1活性调节因子具有较深的研究价值。CPT1蛋白大部分面朝线粒体外膜细胞质侧,增加了其与细胞骨架相互作用的可能性[28]。CPT1活性是由细胞骨架的聚集状态调节的,细胞组分由磷酸化激活,经渗透作用后从细胞中释放,这是影响细胞骨架聚集状态进而影响CPT1活性的必要因素。细胞骨架成分中细胞角蛋白8和18是最可能的调控CPT1在肝细胞中活性的主要候选成分。纯化的钙离子-钙调蛋白依赖性蛋白激酶Ⅱ(Ca2+-calmodulin-dependent protein kinase Ⅱ,Ca2+-CM-PKⅡ)能够解除细胞角蛋白对线粒体中CPT1的抑制,激活Ca2+-CM-PKⅡ可诱导细胞角蛋白8和18的磷酸化,破坏中间丝,增加CPT1活性(图3)。因此Ca2+-CM-PKⅡ的活化、中间丝断裂和CPT1活化之间有明显的联系,这种机制可能依赖于Ca2+/CM-PKⅡ的级联激活使细胞角蛋白磷酸化从而CPT1去抑制,导致脂肪酸氧化增加[29-30]。
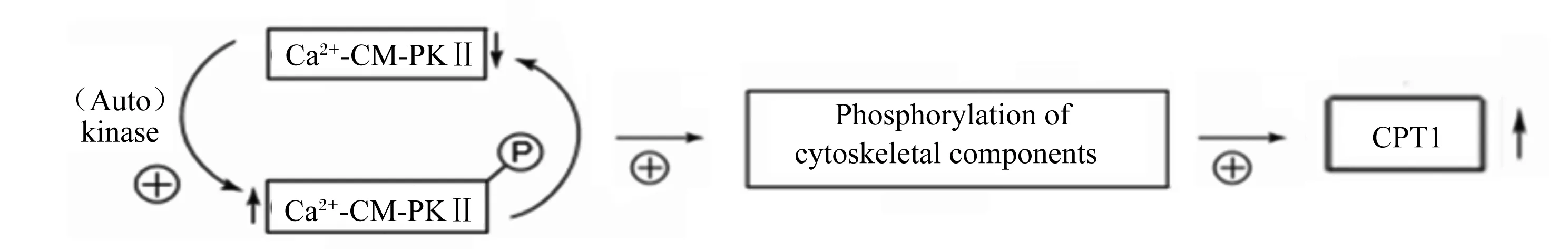
Ca2+-CM-PKⅡ:Ca2+/钙调蛋白依赖性蛋白激酶Ⅱ Ca2+-calmodulin-dependent protein kinase Ⅱ;(Auto)kinase:(自身)激酶;Phosphorylation of cytoskeletal components:细胞骨架成分的磷酸化;CPT1:肉碱棕榈酰转移酶1 carnitine palmitoyl transferase 1。
2.3 转录水平
CPT1 mRNA表达水平下降可导致CPT1活性降低,使进入到细胞的脂肪酸及其活化产物脂酰辅酶A沉积在胞浆内,难以进入线粒体基质中进行β-氧化产生能量,使细胞内脂肪堆积,影响脂肪沉积,进一步改变畜禽脂肪分布[32]。
过氧化物酶体增殖激活受体α(peroxisome proliferator-activated receptor α,PPARα)能通过与目标启动子结合激活目标基因,参与调节脂肪分解和氧化[33]。PPARα表达降低会使PPAR介导的脂肪代谢相关酶的目的基因CPT1表达水平降低,减弱脂肪酸氧化能力,影响脂蛋白合成代谢,而PPARα激活能够诱导肌肉CPT1的表达,促进线粒体棕榈酸的β-氧化[34]。过氧化物酶体增殖受体γ辅激活酶因子-1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)是PPARα最重要的辅助转录活化因子,也是线粒体生物合成的关键调节因子,能介导多种细胞能量代谢并激活许多核受体基因表达。PGC-1α通过激活脂肪酸氧化、糖异生以及线粒体呼吸的关键酶参加脂肪代谢、胰岛素抵抗等过程[35]。此外,PGC-1α是AMPK的底物,AMPK能使PGC-1α磷酸化,增强PGC-1α的转录活性,提高线粒体合成,促进细胞分解代谢。研究表明,敲除小鼠PGC-1α会使CPT1、乙酰辅酶A氧化酶活性降低,而活化PGC-1α能够提高CPT1的表达水平,调节脂肪酸β-氧化,促进长链脂肪酸代谢[36]。
2.4 miRNA
miRNAs是真核生物细胞内生的小RNA,miRNAs通过与靶基因的3’非翻译区互补配对,引起mRNA降解或抑制转录后翻译,对基因表达进行转录后调控,因此miRNAs在基因表达的抑制性调控中占有重要地位[37]。肝脏中miR-370和miR-122可调控脂代谢相关基因,CPT1A是miR-370的靶基因,miR-370能靶向CPT1A的3’非翻译区,抑制CPT1A表达,使脂肪酸β-氧化速率降低,促使脂肪沉积。此外,miR-370也能够通过上调miR-122间接抑制β-氧化,促进脂肪生成基因的表达,诱导脂肪沉积[38]。同时,Gracia等[39]通过培养肝脏细胞证明CPT1A是miRNA-107-3p的靶基因,白藜芦醇诱导大鼠肝脏脂肪减少的原因是降低了miRNA-107-3p表达,增加了CPT1A表达,促进脂肪氧化,减少脂肪沉积。
固醇调节元件结合蛋白(sterol regulatory element-binding protein,SREBP)是细胞胆固醇和脂肪酸代谢的的重要调节因子,而miRNA-33a和miRNA-33b是编码SREBP-2和SREBP-1基因的内含子,因此miRNA-33能够调控胆固醇和脂肪酸代谢。研究表明,敲除高脂饮食小鼠的miRNA-33能够增加甘油三酯循环水平,促进肝脏中脂质合成,同时在小鼠脂肪组织中,脂肪细胞前增殖增加,脂质摄取增强,脂肪分解受损[40]。
2.5 激素
胰岛素是降血糖的激素,但其对脂质代谢过程也有调节作用,胰岛素具有抗脂溶和脂质储存的功能。CPT1活性的增强及其基因表达的改变可能与胰岛素的减少有关,Zhuo等[41]在肝脏细胞中加入不同水平的胰岛素,结果表明胰岛素培养会增加脂肪酸合成酶(fatty acid synthase,FAS)的活性,降低CPT1的表达,促进了脂肪生成并减少脂肪分解。
甲状腺激素是胰岛素的拮抗剂,在机体生理状态下能够促进脂肪分解,研究认为甲状腺激素也能诱导CPT1A的表达,由于甲状腺激素反应元件(thyroid-hormone-response elements,TRE)位于CPT1A启动子中,其能和甲状腺素相互作用使CPT1A的表达水平升高;甲状腺激素会上调AMPK信号,使AMPK靶向的ACC磷酸化,促进CPT1A活化和肝脏脂肪酸氧化[42]。此外,无论是在体内还是细胞培养,甲状腺素均能促进PGC-1αmRNA的表达,上调CPT1表达,促进脂肪酸氧化[43]。
2.6 运动
运动时肌肉反复收缩和舒张需要大量的ATP,激活AMPK,引起ACC活性减弱和MCD活性增强,增强CPT1活性,引起脂肪酸氧化增加。脂肪酸转位酶(fatty acid translocase,FAT/CD36)是一种定位于骨骼肌线粒体外膜的与长链脂肪酸具有高度亲和力的转运蛋白,是脂肪酸跨膜转运的重要载体蛋白,参与长链脂酰辅酶A的转运[44]。耐力运动后,肌肉中FAT/CD36和CPT1活性增加,且FAT/CD36和CPT1与全身脂肪氧化呈正相关,因此骨骼肌脂肪酸氧化增加可能部分与FAT/CD36和CPT1活性有关。同时,利用免疫共沉淀法研究耐力训练对FAT/CD36与CPT1结合性的影响,发现耐力训练会使与FAT/CD36免疫共沉淀的CPT1增加,且免疫共沉淀量与机体脂肪氧化率成正比。因此耐力训练可能促进FAT/CD36定位,增加CPT1与其的结合能力,促进脂肪氧化[45]。
3 CPT1对肉品质的影响
近年来,通过对畜禽生长率和肉产量的遗传选择,肉类产量有了很大的提高。但是,随着生长率升高,肌纤维直径变大,糖酵解肌纤维比例增加,畜禽宰后肉pH会迅速下降,降低肉的保水性能,容易形成白肌肉(PSE肉),影响肉品质。肌内脂肪(intramuscular fat,IMF)是指沉积在肌肉之间的脂肪,适量的IMF能够构成瘦肉的大理石纹,是胴体等级评价标准中的重要指标。同时,IMF的含量与风味、多汁性、嫩度呈正相关。由于IMF的主要成分是磷脂,磷脂中富含的亚油酸、α-亚麻酸、花生四烯酸等PUFA,容易被氧化产生挥发性成分,因此,IMF的含量能够改善肉的风味[46]。
CPT1是线粒体脂肪酸氧化过程中的关键调节酶,对脂肪的分解供能具有重要的调控作用。Zhang等[47]研究表明,饲粮共轭亚油酸能够增加西门塔尔牛IMF沉积,减少皮下脂肪沉积;其原因是共轭亚油酸能够显著提高西门塔尔牛背最长肌中脂蛋白脂肪酶(LPL)、脂肪酸合成酶(FAS)和ACC活性,促进IMF沉积,提高肉的多汁性,同时也显著提高皮下脂肪中LPL、激素敏感脂肪酶(HSL)和CPT1活性,减少皮下脂肪沉积。长链脂肪酸(SLC27A1)也可通过下调CPT1介导的脂肪酸氧化来促进鸡肉IMF沉积,因此脂质分解代谢的减少更有利于鸡肉IMF沉积,增加鸡肉嫩度[48]。CPT1活性变化会改变骨骼肌中脂肪酸氧化速率,从而改变肌肉中脂肪酸组成,其中PUFA含量的高低会影响肉的抗氧化稳定性、货架期以及肉色的亮度,研究表明,当肉中C8~C17的中长链不饱和脂肪酸和支链脂肪酸含量上升时,肉的多汁性和整体适口性均会显著提高[49]。冷智贤[50]研究表明,甜菜碱通过促进肉碱的合成,加强线粒体β-氧化,提高CPT1活性,显著提高肌苷酸含量,肌苷酸及其分解产物肌苷是动物组织中重要的风味物质,是衡量肉质鲜味的重要指标,因此CPT1可能会通过影响肌苷酸含量进而影响肉的风味。综上所述,CPT1能够通过参与脂肪酸氧化过程,调节体内脂肪含量,进而改善肉品质。
4 小 结
CPT1主要参与机体脂质代谢的调节,因此调控CPT1的生物学效应将会对肌间脂肪沉积、脂肪分布、脂肪酸组成等产生影响,进而影响风味、嫩度、多汁性等肉品质指标。相对于通过调控CPT1改善肉品质,目前国内外主要是将CPT1作为许多慢性代谢疾病的治疗靶点,因此,研究机体脂质代谢过程中的关键酶CPT1及其上游信号通路有可能成为改善肉品质的重要靶点。

