基于金纳米颗粒信号放大ELISA检测食品中恩诺沙星
李 坚,张富源,刘敏轩,刘若冰,王向红
(河北农业大学食品科技学院,河北 保定 071000)
氟喹诺酮类药物凭借其强大的广谱杀菌活性而被广泛应用于预防和治疗动物细菌感染等疾病[1]。恩诺沙星(enrofloxacin,ENR)作为一种喹诺酮类药物具有抗菌谱广、吸收速度快等优点[2],其主要通过阻止原核生物中DNA的复制、转录和终止等过程从而具有抑菌功效[3],可有效抑制需氧性革兰氏阳性菌和阴性菌的生长繁殖,因而被广泛应用于畜禽养殖领域[4]。但非法或不当使用ENR易导致动物源性食品中ENR的残留超标[5],并通过食物链危害人体健康,包括引发过敏反应[6]、“三致”毒害[7]和急慢性毒性[8]等,且易导致细菌耐药性增加和环境生态毒性[9-10]。许多国家和政府已经设定了动物源性食品中ENR最大残留限量(maximum residue limit,MRL)[11],以确保食品安全。例如,美国已经禁止ENR在畜禽养殖中的应用[12];欧盟在《欧盟食品中农兽药残留限量标准》中,规定牛奶中ENR的MRL为100 μg/kg[13];日本等国家设定为50 μg/kg[14]。我国规定其在各类可食动物性组织中ENR残留不得超过300 μg/kg,在牛奶中的MRL为100 μg/kg[15]。但是近年来,动物源性食品中ENR检测超标事件频有发生。2019年,韩国因鸡蛋中ENR超标而宣布召回相应产品;2020年,贵州在对猪肉检疫中查出ENR超标[16-17]。因此,为维护食品安全及保障食品经济正常进行,建立针对ENR快速、灵敏、可靠的检测方法具有重要的现实意义。
目前,ENR检测方法主要有仪器检测法[18-19]、电化学方法[20]、荧光分光光度法[21]和免疫分析法[22]等。其中,高效液相色谱[23-24]等方法使用最为广泛,但所用仪器设备昂贵、前处理复杂、对操作人员要求高等限制了该类方法的普及。酶联免疫吸附测定法(enzyme linked immunosorbent assay,ELISA)等免疫分析技术由于具有快速、低成本、灵敏度高等优势备受关注[13,25-26],成为ENR重要的快速检测技术。
近年来,基于纳米材料的新型信号放大免疫分析方法逐渐被应用于食品安全和医学检测等领域,并展现出优异的检测性能。金纳米颗粒(gold nanoparticles,AuNPs)具有易于合成、尺寸可控、生物相容性好、易于修饰等特点[27-28],已被广泛用作信号放大和生物医学分析的信号载体提高免疫检测的性能[29]。Agrawal等[30]利用AuNPs固定鸟分枝杆菌副结核亚种重组蛋白,开发了一种对肺结核副结核病快速、经济、有效、灵敏而特异检测的新型生物传感器。Lee等[31]将黑曲霉孢子特异性结合肽固定在AuNPs表面,开发出一种简单快速的比色法检测过敏性真菌孢子,实现了在10 min内快速检测约50 个孢子的高灵敏度。
本实验利用AuNPs高比表面积、易于修饰、分散性好、稳定性高、能偶联多个辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗且不影响其活性等特点,将AuNPs作为信号放大载体,固定HRP标记的二抗(AuNPs-HRP-IgG),建立一种基于AuNPs的信号放大酶联免疫检测方法(AuNPs signal amplification enzyme-linked immunosorbent assay,AuNPs-HRP-IgG ic-ELISA),该方法与传统ELISA相比将显著提高检测灵敏度,适用于动物性食品中ENR的灵敏、稳定、可靠、快速检测。
1 材料与方法
1.1 材料与试剂
纯牛奶实际样品 河北农业大学宜家旺超市;ENR、诺氟沙星(norfloxacin,NOR)、氧氟沙星(ofloxacin,OFLO)、环丙沙星(ciprofloxacin,CIP)、牛血清蛋白(bovine albumin,BSA)上海源叶科技生物有限公司;HRP标记羊抗兔IgG北京索莱宝科技有限公司;包被原(ENR-OVA)北京博奥龙生物科技公司;3,3’,5,5’-四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine,TMB)、氯金酸美国Sigma公司;ENR兔多克隆抗体为河北农业大学食品科技学院食品分析与营养实验室前期制备;其他化学试剂均为分析纯。
1.2 仪器与设备
Multiskan Spectrum酶标仪 美国Thermo Scientific公司;IKA MS 3 digital微孔板振荡器 艾卡(广州)仪器设备有限公司;TGL-16G离心机 上海安亭科学仪器厂;96 孔不可拆卸酶标板(40301) 苏州海狸生物医学工程有限公司;UV-2800A紫外-可见光分光光度计尤尼柯(上海)仪器有限公司。
1.3 方法
1.3.1 AuNPs及AuNPs-HRP-IgG探针、HRP-AuNPs-IgG的制备
参考文献[32]的方法,将100 mL 0.01%氯金酸溶液置于圆底烧瓶,在控温搅拌器中加热至沸腾。迅速加入2 mL 1%柠檬酸三钠溶液,持续加热至溶液颜色均匀稳定,呈酒红色,继续煮沸15 min,室温自然冷却,定容至100 mL。采用扫描电镜进行表征。取制备好的AuNPs溶液10 mL,用0.1 mol/L的K2CO3溶液调节pH值至7.5~8.0,静置5 min。缓慢加入500 μL 1 mg/mL的羊抗兔IgG-HRP二抗,在4 ℃条件下避光反应1 h。然后,分别加入200 μL的20% BSA和100 μL的20%聚乙二醇,低温条件下振荡30 min进行封闭。将上述产物于3 000 r/min离心15 min,取上清液,10 000 r/min离心30 min,弃上清液,所得红色沉淀(记为AuNPs-HRP-IgG探针)用AuNPs存储液(0.01 mol/L PBS、pH 7.4、3%蔗糖、5%海藻糖、2% BSA)复溶,4 ℃冰箱贮存备用。
将羊抗兔IgG-HRP二抗替换为羊抗兔IgG抗体和HRP,制备步骤同AuNPs-HRP-IgG探针,即得产物(记为HRP-AuNPs-IgG)。
1.3.2 传统ELISA方法的建立
采用棋盘方阵法确定最佳抗原包被量及抗体作用质量浓度。将质量浓度为2 mg/mL的偶联抗原ENR-OVA分别稀释为1、0.5、0.25、0.1、0.05、0.01 μg/mL进行包被,每孔100 μL。抗ENR多克隆抗体从800 倍依次倍比稀释至51 200 倍,酶标二抗5 000 倍稀释后使用。选取最佳抗原包被量和抗体稀释质量浓度,进行后续实验。
根据优化的最佳实验条件,ENR标准品质量浓度从500 ng/mL依次倍比稀释到0.16 ng/mL,同时设置标准品稀释液和适宜稀释度的抗体溶液作为混合溶液为阴性对照,标准品稀释液作为空白对照,每个质量浓度设置3 个平行,构建间接竞争ELISA标准曲线。
1.3.3 AuNPs-HRP-IgG ic-ELISA的建立
检测原理见图1。包被抗原量和AuNPs标记羊抗兔IgG-HRP二抗的使用浓度优化同1.3.2节。抗原包被质量浓度设置同上,AuNPs-HRP-IgG探针初始稀释倍数为50,依次倍比稀释400 倍。选取最佳抗原包被量和AuNPs-HRP-IgG使用质量浓度进行实验,构建标准曲线。由于牛奶样品中其他物质会干扰检测结果,所以本实验采用直接稀释法消除样品基质的影响。用0.01 mol/L PBS将牛奶样品空白提取液进行梯度稀释后绘制基质添加标准曲线,与已建立的缓冲液标准曲线进行比较,分析基质的影响。选择ENR结构类似物CIP、OFLO、NOR以及ENR分别进行梯度稀释,进行交叉反应率的测定,按下式计算:
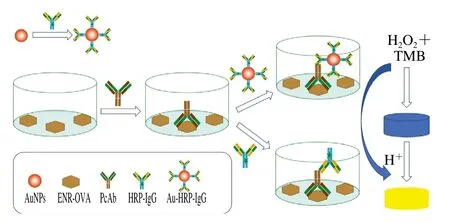
图1 AuNPs-HRP-IgG ic-ELISA示意图Fig.1 Schematic diagram of the developed AuNPs-HRP-IgG ic-ELISA

式中:IC50(ENR)为ENR半数抑制浓度/(ng/mL);IC50(结构类似物)为ENR结构类似物半数抑制浓度/(ng/mL)。
1.3.4 样品加标回收实验
取10 mL牛奶,3 500 r/min离心10 min,除脂,取5 mL除脂后的牛奶依次加入150 μL 0.36 mol/L的K4Fe(CN)6·3H2O与1 mol/L的ZnSO4溶液,混匀5 min。3 500 r/min离心10 min,取上清液,用0.01 mol/L PBS溶液进行稀释后,进行测定[33]。本实验牛奶样品选择的加标质量浓度为100、50、25 ng/mL。样品经前处理提取并稀释到适宜倍数后,利用新建的AuNPs信号增强ic-ELISA进行实验检测。计算样品的加标回收率。
1.4 数据统计及图表绘制
使用Excel 2019及Origin 2018软件进行数据统计和图表的绘制。
2 结果与分析
2.1 AuNPs及AuNPs-HRP-IgG探针的鉴定及表征
由图2a可知,本实验所制备的AuNPs溶液外观澄清透明,呈红色,无肉眼可见颗粒沉淀,AuNPs在400~700 nm波长区间内有单一最大吸收峰,且有较窄的半峰宽。由图2b可看出,所合成AuNPs粒径较为均一,粒径约为20 nm,分散均匀。将AuNPs与IgG-HRP结合后,吸光度明显下降,其最大吸收峰由519 nm红移至525 nm(图2c),修饰后的纳米颗粒粒径均一,分散性较好(图2d)。在包被有兔抗体的酶标板中分别加入AuNPs、IgG-HRP、HRP-AuNPs-IgG和AuNPs-HRP-IgG探针进行显色,结果显示(图3),在AuNPs孔中没有观察到明显的颜色变化,说明单一的AuNPs对本检测策略的背景影响较小,IgG-HRP孔可观察到明显的显色结果,其OD450nm约为0.5,说明所用羊抗兔酶标二抗能够识别所包被的兔抗体;HRP-AuNPs-IgG和AuNPs-HRPIgG探针孔,由于信号放大作用,其OD450nm明显大于IgG-HRP孔,同时HRP-AuNPs-IgG的显色说明了AuNPs-HRP-IgG的显色并不是残留的IgG-HRP作用的结果,这也表明了AuNPs-HRP-IgG探针标记成功。
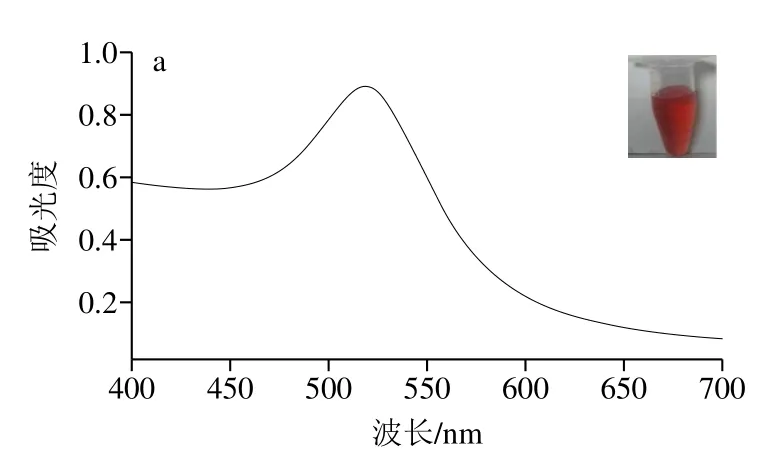
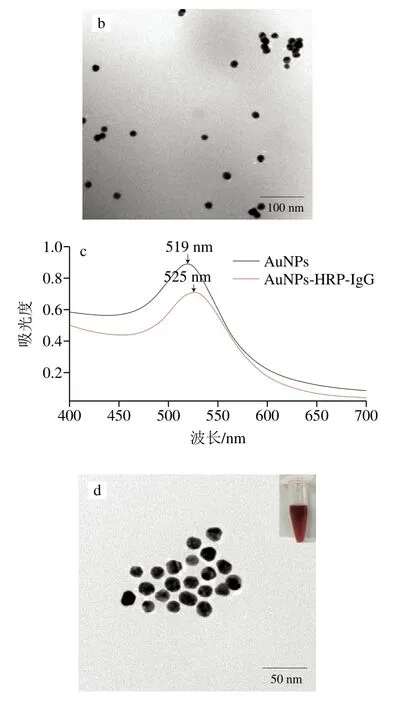
图2 AuNPs和AuNPs-HRP-IgG探针的紫外吸收光谱(a、c)和扫描电镜图(b、d)Fig.2 UV absorption spectra (a, c) and scanning electron micrographs (b, d) of AuNPs and AuNPs-HRP-IgG probes
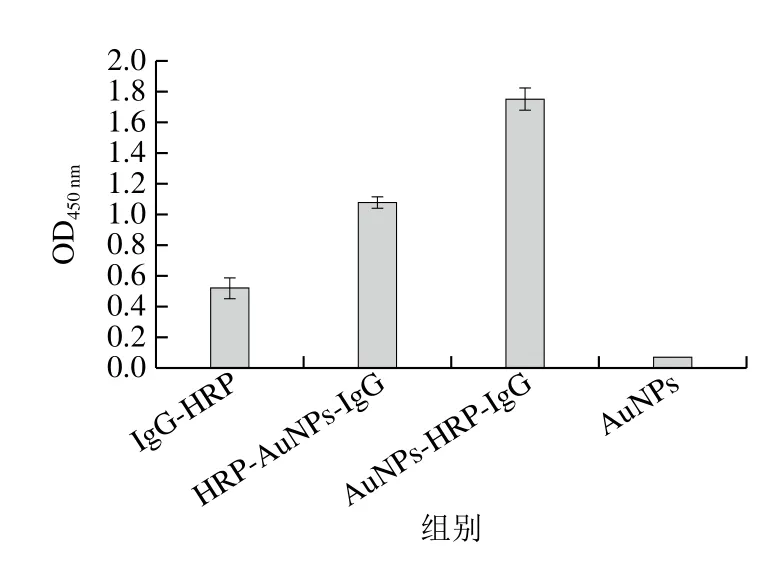
图3 IgG-HRP、HRP-AuNPs-IgG、AuNPs-HRP-IgG探针和AuNPs ELISA鉴定Fig.3 Identification of IgG-HRP, HRP-AuNPs-IgG, AuNPs-HRP-IgG probe and AuNPs
2.2 传统间接竞争ELISA方法的建立
按照1.3.2节方法,通过棋盘法确定了传统间接竞争ELISA的反应条件:抗原最佳包被质量浓度为0.5 μg/mL,封闭液为1% BSA,抗ENR多克隆抗体最佳稀释倍数为6 400 倍。以ENR标准品质量浓度为横坐标,以抑制率为纵坐标,绘制抑制率曲线(图4),曲线方程为y=0.133 5lnx+0.210 2(R2=0.994 3),检测范围为0.8~100 ng/mL,IC50为8.76 ng/mL,IC15为0.63 ng/mL,与CIP、OFLO、NOR的交叉反应率均小于0.1%,说明该抗体特异性良好,能够较为灵敏地特异性识别ENR。
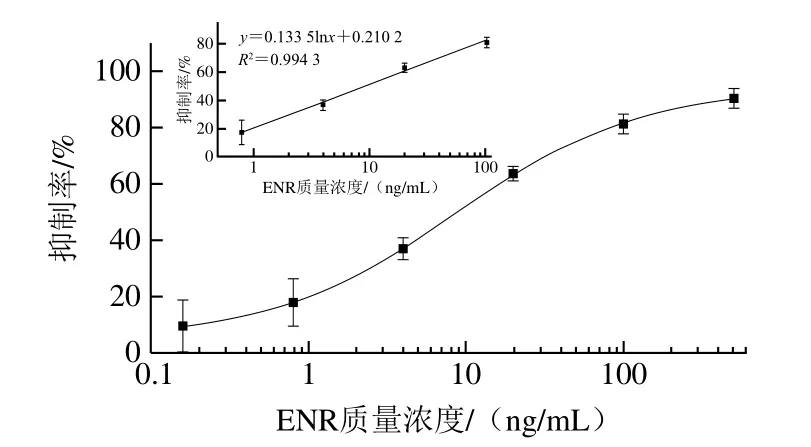
图4 传统ELISA检测ENR标准曲线Fig.4 Standard curve of traditional ELISA for ENR detection
2.3 AuNPs-HRP-IgG ic-ELISA条件的优化和建立
2.3.1 包被原及抗体稀释倍数的优化
选取包被原为1.00、0.50、0.25、0.10、0.05 μg/孔和0.01 μg/孔六个不同包被量进行包被,ENR多克隆抗体稀释倍数选取800、1 600、3 200、6 400、12 800、25 600、51 200七个倍数进行间接非竞争ELISA测定,结果见表1、2,选取不同包被原包被量、不同抗体稀释倍数下OD450nm值在1.0附近的组合为最佳组合,选择包被原包被量为1.0 μg/孔和0.5 μg/孔,抗体稀释倍数为6 400 倍的条件,进行后续实验。结果见表1、3,当包被原包被量为0.5 μg/孔,抗体稀释倍数为6 400时,显色稳定且IC50较低。因此,确定该组合为包被原包被量和抗体稀释倍数的最优条件。
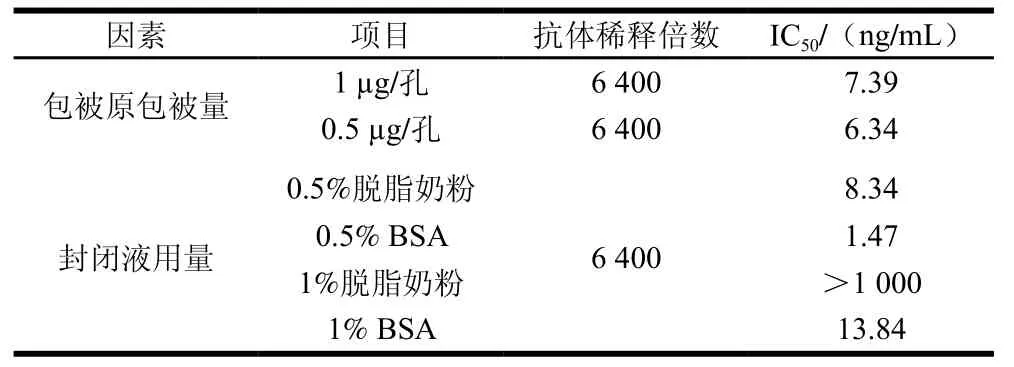
表1 AuNPs-HRP-IgG ic-ELISA实验条件优化Table 1 Optimization of experimental conditions for AuNPs-HRP-IgG ic-ELISA
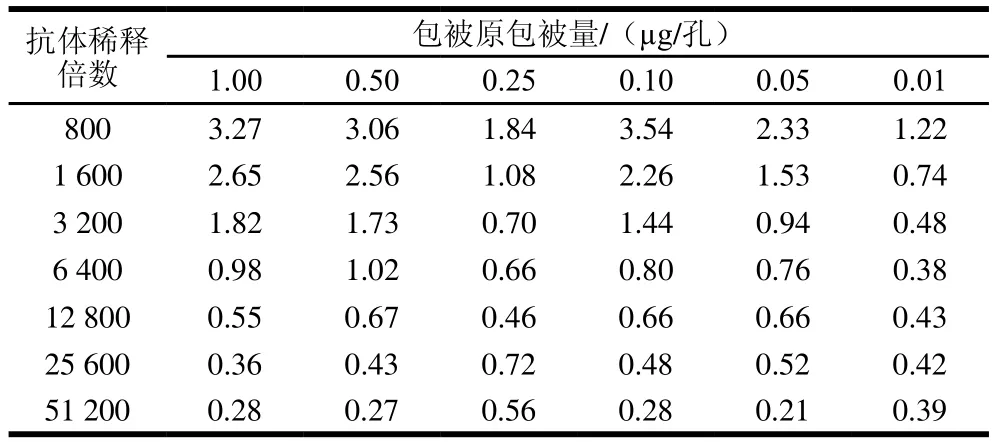
表2 包被原和抗体稀释倍数的优化Table 2 Optimization of dilution ratios of coating antigen and antibody
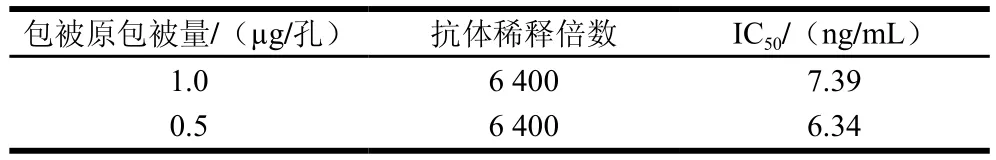
表3 最佳包被原和抗体稀释倍数下的检测效果Table 3 Detection efficiency at optimized coating antigen and antibody dilution factors
2.3.2 包被条件的优化
为了探究包被条件的影响,本实验将包被原分别在37 ℃ 2 h、4 ℃ 12 h和37 ℃ 1 h条件下进行包被。结果见图5,与37 ℃条件下包被相比,当包被原在4 ℃ 12 h条件下包被时,所建立标准曲线的IC50最低。可能是因为蛋白质与酶标板聚苯乙烯固相载体之间是非特异性的物理吸附,包被原在4 ℃下,其活性相对较高且稳定,同时包被时间长,更容易固定在微孔板的表面,从而包被更充分,所以选其作为最适工作条件。
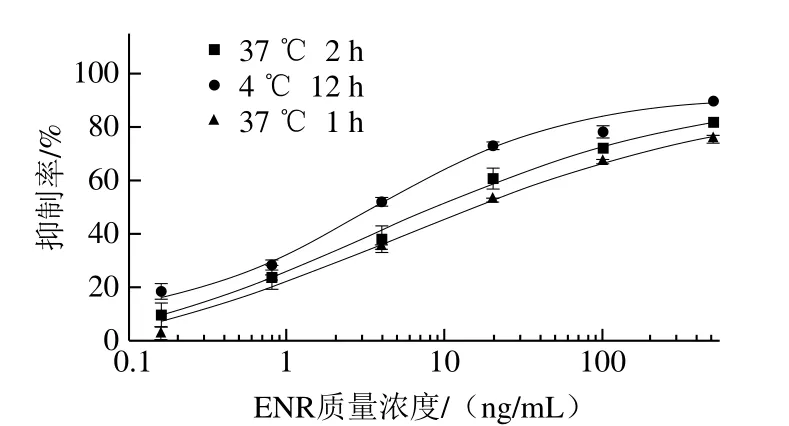
图5 包被条件的优化Fig.5 Optimization of coating conditions
2.3.3 封闭液的优化
封闭液的作用是封闭未被包被原包被的游离位点,避免抗体与固相载体之间非特异性结合,导致假阳性,影响实验结果,选择合适的封闭液溶度是ELISA的关键。本实验分别选择0.5%脱脂奶粉、1%脱脂奶粉、0.5% BSA、1% BSA 4种封闭液进行封闭,比较不同封闭条件下的ODmax值和IC50值,结果见表1、4。与其他3种封闭条件相比,0.5% BSA的封闭条件下所建立标准曲线的IC50(1.47 ng/mL)最低,灵敏度最高,表明0.5% BSA对酶标板上非特异性蛋白结合位点封闭效果较好,因此选择0.5%的BSA作为封闭液进行后续实验。
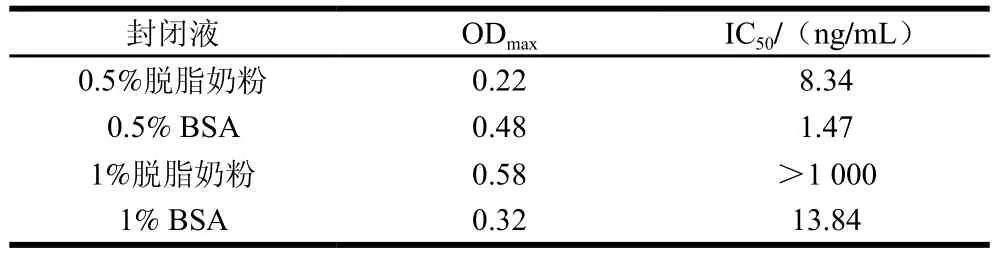
表4 封闭液的优化Table 4 Optimization of blocking solution
2.3.4 AuNPs-HRP-IgG探针稀释倍数的优化
基于上述优化条件,分别将制备好的AuNPs-HRPIgG探针从50~400 倍依次稀释,建立间接竞争ELISA,计算各条件下的IC50值。当AuNPs-HRP-IgG探针稀释50 倍时,显色稳定,IC50较低。因此,确定此条件为方法的最佳工作条件。确定AuNPs-HRP-IgG ic-ELISA的最佳反应条件抗原最佳包被质量浓度为0.5 μg/mL,AuNPs-HRP-IgG探针最佳稀释倍数为50 倍,封闭液为0.5% BSA。以竞争抗原ENR标准品质量浓度对数为横坐标,抑制率为纵坐标,绘制标准曲线,曲线方程为y=0.057 6lnx+0.582 6(R2=0.983 1),检测范围为0.16~500 ng/mL,IC50为0.24 ng/mL,IC15为5×10-4ng/mL。
利用同一ENR兔多克隆抗体,发现与常规ic-ELISA(IC50=8.76 ng/mL)相比,AuNPs-HRP-IgG ic-ELISA检测(IC50=0.24 ng/mL)更灵敏。本研究利用AuNPs高比表面积和表面易功能化的特点,将AuNPs作为纳米载体,固定多个辣根过氧化物酶标记的二抗,达到多聚HRP的效果,可以检测到分析物质量浓度较低的样品,从而提高检测灵敏度[34]。相对于游离的IgG-HRP,AuNPs-HRPIgG探针上的酶标二抗与检测抗体结合,固定于AuNPs上的IgG-HRP均会参与到后续显色反应中,使检测信号放大,相比传统ic-ELISA,检测灵敏度得到提升。
2.4 基质效应的消除
为探究基质效应,以获得样品预处理的最佳方法,本研究通过将样品提取液稀释一定倍数后,以消除样品基质对ELISA检测曲线的影响。阴性样品提取液用0.01 mol/L PBS稀释5、10 倍和20 倍,用于ENR标准品梯度稀释液,进行AuNPs-HRP-IgG ic-ELISA,绘制基质标准曲线。基质效应分析结果表明(图6),牛奶样品提取液经0.01 mol/L PBS 稀释10 倍后,所得基质标准曲线与缓冲液标准抑制曲线(0.01 mol/L PBS稀释)基本相同,此时基质对检测结果的影响很小,故后续检测时,样品提取液需经10 倍稀释,以消除基质效应。
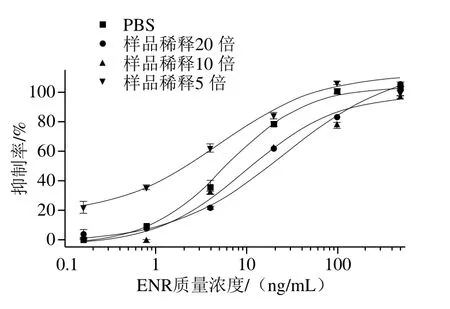
图6 牛奶提取液基质影响Fig.6 Matrix effect elimination for milk extract
2.5 AuNPs-HRP-IgG ic-ELISA检测法特异性分析
该方法特异性分析结果表明(表5),虽然CIP、OFLO和NOR的结构和ENR具有很大的相似性,但是交叉反应率均小于0.1%,均无交叉反应,所建立的AuNPs-HRP-IgG ic-ELISA可特异性的检测样品中的ENR,这与所建立的传统ELISA结果一致,表明所应用检测抗体和建立的ELISA方法具有良好的特异性。

表5 ENR及3种结构类似物的交叉反应率Table 5 Cross-reactivity of the developed ELISA toward three structural analogs of ENR %
2.6 加标回收实验结果
本研究向阴性牛奶样品中分别添加质量浓度为25、50 ng/mL和100 ng/mL的ENR标准品,并用0.01 mol/L PBS将样品提取物稀释10 倍,分别采用建立的AuNPs-HRPIgG ic-ELISA和商业ENR试剂盒进行检测,每份样品3 个平行,并重复3 次。结果见表6,AuNPs-HRP-IgG ic-ELISA和商业ENR试剂盒2种方法在牛奶样品中的加标回收率分别为80.52%~102.66%和91.06%~108.04%,AuNPs-HRP-IgG ic-ELISA的结果与商业ENR试剂盒的结果较为一致,半数抑制率均低于我国和欧盟规定的ENR最高限量标准,表明所建立AuNPs-HRP-IgG ic-ELISA能够用于实际牛奶样品中ENR的测定。
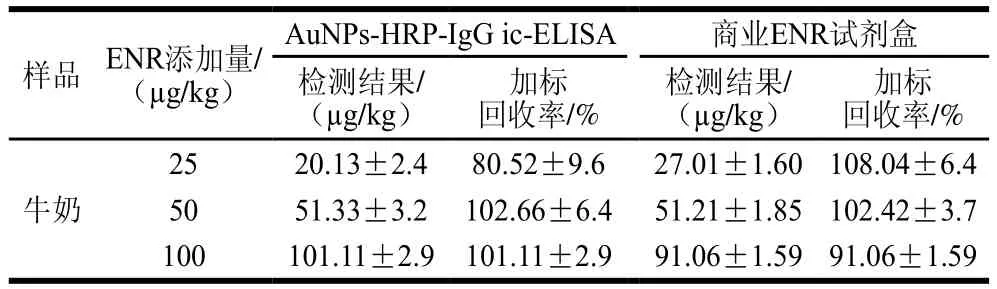
表6 牛奶样品加标回收率(n =3)Table 6 Recoveries for spiked milk samples (n = 3)
2.7 本研究与相关文献比较
由表7可知,本研究建立的AuNPs-HRP-IgG ic-ELISA灵敏度(IC50=0.24 ng/mL)较低,检测范围(0.16~500 ng/mL)较广,建立的AuNPs-HRP-IgG ic-ELISA在灵敏度方面具有一定优势。与建立的常规ELISA相比,明显提升了检测的灵敏度,这主要是由于AuNPs作为信号放大载体,结合了多个辣根过氧化物酶标记的二抗参与显色反应,从而增加了检测的信号强度和灵敏度。
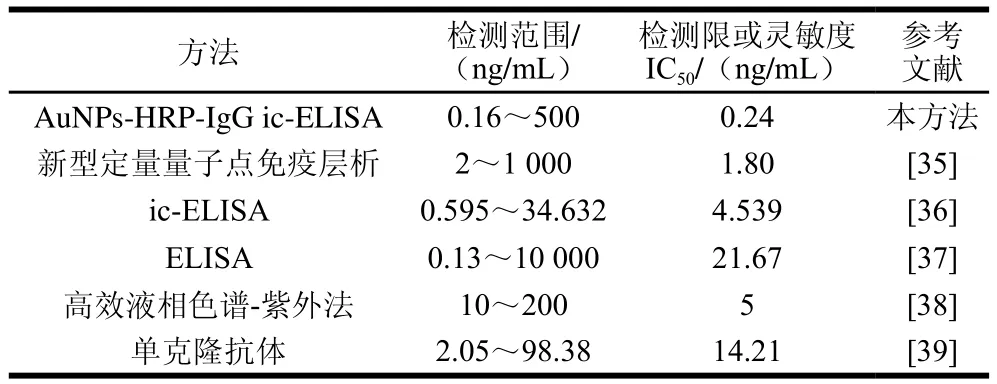
表7 AuNPs-HRP-IgG ic-ELISA与其他文献比较Table 7 Comparison of AuNPs-HRP-IgG ic-ELISA with other detection methods
3 结 论
本研究成功制备了AuNPs-HRP-IgG探针,用来替代传统ELISA中的酶标记二抗,建立基于AuNPs信号增强ELISA检测动物性食品中的ENR,以提高检测的灵敏度。与传统ELISA相比,灵敏度从8.76 ng/mL提高到0.24 ng/mL,检测限(IC15)下降至5×10-4ng/mL,与ENR结构类似物CIP、NOR、OFLO的交叉反应率均小于0.1%,牛奶实际样品加标回收率为80.52%~102.66%,能够用于实际样品中ENR的灵敏定量检测分析。结果表明,所提出的新型AuNPs-HRP-IgG ic-ELISA,可以明显提高传统ELISA的检测灵敏度,可作为高灵敏检测方法用于牛奶样品中ENR的灵敏检测,并对建立食品中其他抗生素及小分子有害物质的高灵敏检测方法具有重要指导意义。

