基于氧化石墨烯的荧光适配体传感器检测食品中真菌毒素
王 琦,杨庆利,吴 薇
(青岛农业大学食品科学与工程学院,山东 青岛 266109)
真菌毒素是真菌产生的一种低分子质量的天然次生代谢产物,对人和动物具有很强的毒性,其毒性主要表现在肝、肾损害、致畸、致癌、致突变等方面[1-3]。在玉米、花生等常见农作物种植、生长、收获、运输、存储以及加工的各个环节都有可能受到真菌毒素的污染,这不仅会降低作物产量和品质,还会造成重大的经济损失[4-5]。真菌毒素广泛存在于世界范围内,已经成为世界性关注问题[6-8]。黄曲霉毒素B1(aflatoxin B1,AFB1)和伏马毒素B1(fumonisin B1,FB1)是两种比较常见的真菌毒素,主要存在于玉米、花生以及小麦等农作物及其产品中,尤其是水分含量高的环境中更容易产生。迄今为止,AFB1和FB1传统检测方法主要有仪器检测法和免疫检测法。仪器检测法主要有薄层色谱、高效液相色谱、气相色谱、毛细管电泳等,免疫检测法常用的是酶联免疫吸附法和荧光免疫分析法[9-12]。这些检测方法虽然在目前阶段运用比较成熟,但是由于存在样品前处理复杂、检测时间长、设备昂贵而造成检测成本高、稳定性差以及不适用于现场检测等缺点而面临着巨大的挑战。此外,食物和动物饲料很有可能同时受到多种真菌毒素的污染。然而,单一的检测模式并不能提供对食品的全面监控。因此,有必要加强食品和饲料中真菌毒素的同时检测技术。此外,开发一种新型、省时、低成本、灵敏的同时检测真菌毒素的生物传感器十分必要。
适配体(aptamer,APT)是通过体外指数富集配体系统进化技术从核酸随机文库中筛选出来的短寡核苷酸序列[13-16]。APT的碱基序列、核苷酸序列长度和环境条件构成了它独特的三维立体结构[17],这使其拥有特殊的结合位点,并对靶标具有较高的特异性和亲和力。与抗体相比,APT具有可以大量体外合成、容易修饰、稳定性高等优点。近几年,基于APT的生物传感器成为研究热点,广泛应用于临床医学、化学分析、食品危害物检测等领域[18-19]。氧化石墨烯(graphene oxide,GO)是石墨烯的氧化产物,具有大量含氧官能团,有很好的亲水性和生物相容性。相比于其他猝灭剂,GO具有更优越的荧光猝灭性能[20-21],常常在荧光共振能量转移系统中作为荧光受体。基于GO的荧光传感器已广泛应用于金属离子、细胞、蛋白质、病原体、真菌毒素、DNA等小分子的检测[22-27]。此外,由于π-π堆积作用GO对单链DNA的吸附能力强于对双链DNA和G-四联体的吸附能力,这一特性为本研究的荧光开关检测系统提供了理论基础。
本实验设计一种基于GO为猝灭剂的荧光APT传感器,荧光基团作为荧光供体,GO作为荧光受体,成功用于食品中真菌毒素(AFB1和FB1)的同时荧光检测。
1 材料与方法
1.1 材料与试剂
白酒 市购。
GO 先锋纳米材料科技有限公司;甲醇(分析纯)国药集团化学试剂有限公司;所有实验均采用超纯水(18.25 MΩ·cm);AFB1、FB1青岛普瑞邦生物工程有限公司;AFB1适配体(APT1)和FB1适配体(APT2)的寡核苷酸序列参照文献[28-29]获得,荧光染料(Alexa Fluor 488和Cy3)修饰在DNA探针的5’端,APT由生工生物工程(上海)股份有限公司(中国)合成。APT1和APT2的寡核苷酸序列如表1所示。

表1 APT的寡核苷酸序列Table 1 Oligonucleotides used in this study
1.2 仪器与设备
F-2700荧光分光光度计 日本日立有限公司;SPM-9700型原子力显微镜 日本岛津有限公司;Trobot聚合酶链式反应(polymerase chain reactio,PCR)仪德国Biometra公司;3K15离心机 美国Beckman公司;KH5200E超声清洗仪 昆山禾创超声仪器有限公司。
1.3 方法
1.3.1 荧光APT传感器的构建
在磷酸盐缓冲液(phosphate buffered solution,PBS)(含NaCl 136.89 mmol/L,KCl 2.67 mmol/L,Na2HPO48.1 mmol/L,KH2PO41.76 mmol/L,pH 7.4)中将APT的冻干粉稀释至工作浓度(10 μmol/L),PCR处理后形成直链;将GO纳米片超声20 min,5 000 r/min离心10 min,除去沉淀,取上清液备用。然后,将30 μL GO纳米片(250 μg/mL)分别与4 μL APT1&2在室温下均匀混合5 min,形成GO-荧光APT传感器。
1.3.2 AFB1和FB1检测
将10 μL不同质量浓度的AFB1和FB1滴入GO-适体混合溶液中,加入PBS使最终体积达到1 mL,使AFB1和FB1终质量浓度为0、1、5、10、50、100、500 ng/mL。最终液体在一定温度下孵育1 h。整个实验需要在黑暗的环境下进行。最后用荧光分光光度计测量荧光强度,工作条件为狭缝宽度5 nm,电压700 V,APT1激发波长499 nm,APT2激发波长512 nm。将水浴中孵育后的样品(GO、GO-APT1&2、GO-APT1&2-AFB1&FB1)8 500 r/min离心10 min以获得GO纳米片。然后用超纯水将GO纳米片稀释至适当质量浓度(5 μg/mL),超声分散10 min,用原子力显微镜的相位模式扫描高度图像。每个样本平行扫描3 次。
1.3.3 温度优化
探究温度(30、35、40、45 ℃和50 ℃)对荧光APT传感器检测效果的影响。每组实验除温度不同外,其他操作均与1.3.2节相同。
1.3.4 实际样品检测
为验证基于GO的荧光APT传感器的实用性,采用白酒样品[30]进行测试。首先,将1 mL白酒样品用PBS稀释20 倍,将溶液调至pH 7.4。然后,将已知质量浓度的AFB1和FB1加入预处理样品中。根据1.3.2节操作,用荧光传感器对白酒样品进行靶标的定量检测。
2 结果与分析
2.1 基于GO的荧光APT传感器实验原理
依赖于APT的识别能力、GO的荧光猝灭和ssDNA吸附能力,本研究构建了基于GO的荧光APT传感器。图1显示了基于开启式荧光APT传感器同时检测两种真菌毒素(AFB1和FB1)的原理图。由于GO表面含有含氧官能团和共轭结构,可以通过氢键、π-π堆积作用将APT1和APT2吸附到GO表面。伴随着GO与APT之间的距离被拉近,APT的荧光因为荧光共振能量转移原理会被GO猝灭,因此APT和GO组装形成荧光APT传感器。在溶液中没有AFB1和FB1的情况下,真菌毒素同时检测系统的荧光处于关闭状态。当靶标加入时,由于APT与靶标的特异性高于GO-APT[31],APT1、APT2更倾向于与它们的特定靶标结合在一起,从GO表面游离出来,导致荧光共振能量转移原理被破坏,从而使APT1和APT2的荧光恢复。此时,真菌毒素同时检测系统处于荧光开启状态。相应地,随着加入的靶标浓度越来越大,荧光强度恢复值也随之逐渐变大。

图1 基于GO荧光的APT传感器检测AFB1和FB1的原理示意图Fig.1 Schematic illustration of fluorescence aptasensor based on GO for detection of AFB1 and FB1
2.2 验证实验的可行性
图2A显示了APT1&2、GO-APT1&2和GO-APT1&2-靶标1&2的荧光强度之间的关系。当溶液中只有APT1&2时,荧光强度表示荧光基团的荧光(图2A蓝色曲线)。当荧光APT1&2与GO一起孵育时,荧光强度急剧下降(图2A灰色曲线)。结果表明,由于GO的吸附作用产生了荧光共振能量转移效应,GO成功猝灭了APT1&2的荧光。当靶标出现在溶液中时,APT1&2和特异性靶标间的高亲和力使得APT优先与特异性靶标识别结合并从GO表面释放,恢复APT1&2的显著荧光信号(图2A红色曲线)。
用原子力显微镜测试原理设计的准确性。用原子力显微镜对GO的高度轨迹进行扫描。如图2B所示,GO片的平均高度约为(1.28±0.01)nm,这个结果与GO是单原子层的理论一致。GO-APT1&2复合物的高度为(2.19±0.007)nm,厚度的增加说明APT1&2被成功地吸附在GO表面。当GO-APT1&2复合物与靶标孵育时,其厚度显著降低至(1.65±0.025)nm。这一现象证实了适体从GO表面释放出来,因为APT和靶标的相互作用力大于GO和APT的相互作用力。以上两种方法均证明了实验设计的正确性。

图2 APT传感器检测的荧光光谱图(A)和原子力显微镜图像(B)Fig.2 Fluorescence emission spectra (A) and AFM images (B) of aptasensor
2.3 实验温度条件的优化
在室温下,向GO-APT中加入10 μL的AFB1和FB1(50 ng/mL)后荧光强度没有明显恢复。为提高加入靶标后的荧光恢复效率,采取温度优化措施。随着孵育温度的升高,GO与APT的相互作用减弱,APT从GO表面上释放出来。因此,提高温度是增强荧光恢复的理想方法。同时,过高的温度会破坏APT与靶标之间的结合。如图3所示,当无AFB1和FB1时,荧光强度恢复通常随温度的升高而增加。这一现象证实了先前的理论,即高温促进了APT从GO表面的释放。然而,在GO-APT1&2复合物中加入靶标时,这种现象不同。添加AFB1和FB1时,荧光信号在45 ℃以下呈现有规律地增加,但当温度超过45 ℃时,荧光强度恢复减弱。因此,45 ℃是荧光强度恢复的临界点。
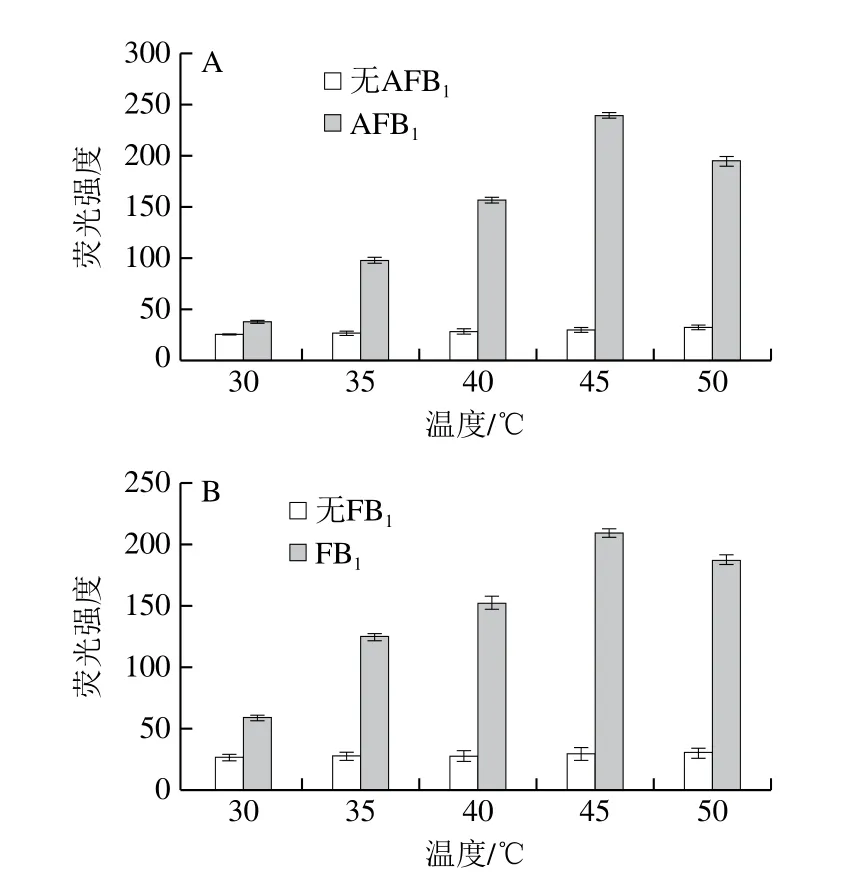
图3 AFB1(A)和FB1(B)检测温度的优化Fig.3 Optimization of detection temperatures for AFB1 (A) and FB1 (B)
2.4 APT传感器灵敏性分析
为了证明开启式荧光APT传感器的灵敏度,将不同质量浓度(0、0.1、0.5、1、5、10、50、100 、500 ng/mL)的靶标(AFB1和FB1)与GO-APT1&2复合物孵育。如图4所示,随着AFB1和FB1质量浓度的增加,在340 nm左右GO-APT1混合溶液的荧光强度从30.23增加到340.21,在560 nm左右GO-APT2混合溶液的荧光强度从30.58增加到243.09。AFB1的回归方程为y=82.516x+99.599(x为lgCAFB1),R2=0.988 0(图4A),检出限为0.15 ng/mL。FB1的回归方程为y=58.131x+85.87(x为lgCFB1),R2=0.989 9,检出限为0.12 ng/mL(图4B)。该荧光APT传感器可以实现对AFB1和FB1的灵敏性检测(表2),并且具有较宽的检测范围。

图4 荧光强度与靶标质量浓度的关系Fig.4 Relationship between fluorescence intensity and target concentration

表2 本研究APT传感器与其他方法的比较Table 2 Comparison of the aptasensor with other detection methods
2.5 APT传感器特异性分析
利用其他可能的干扰真菌毒素,如玉米赤酶烯酮(zearalenone,ZEN)、赭曲霉毒素A(ochratoxin A,OTA)、黄曲霉毒素M1(aflatoxin M1,AFM1)和棒曲霉素(Patulin),进一步检查APT传感器的特异性。分别向GO-APT1&2复合物中加入质量浓度为10 ng/mL的AFB1、FB1、ZEN、OTA、AFM1和Patulin。如图5所示,干扰真菌毒素的荧光恢复值无明显增加,而AFB1和FB1的荧光恢复值明显,其中,AFB1的荧光恢复值是其他干扰毒素的6 倍左右,而FB1的荧光恢复值是其他干扰毒素的4 倍左右。结果表明,该荧光APT传感器对AFB1和FB1具有很高的特异性。

图5 APT传感器特异性评估Fig.5 Selectivity assessment of the aptasensor
2.6 白酒样品的检测结果
用荧光APT传感器检测具有3种不同质量浓度AFB1和FB1的白酒样品。利用加标回收实验对实际样品的回收率进行进一步的可靠性评价。用上述方法测定AFB1和FB1的质量浓度,并用线性方程计算。如表3所示,回收率AFB1为92.00%~100.81%,FB1为89.00%~99.50%。该方法可同时检测真实食品样品中的AFB1和FB1。

表3 白酒样品中不同质量浓度AFB1和FB1的检测Table 3 Recoveries of AFB1 and FB1 from Chinese Baijiu samples at different spiked levels
3 结 论
利用荧光共振能量转移原理,设计一种以GO为荧光猝灭剂的荧光APT传感器用于食品中真菌毒素AFB1和FB1的同时检测。在最佳检测条件下,该荧光传感器对AFB1检测范围为0.1~500 ng/mL,检出限为0.15 ng/mL,对FB1检测范围为0.1~500 ng/mL,检出限为0.12 ng/mL,并且APT传感器对靶标具有很高的特异性。在实际样品的回收实验中表现出良好的回收率,AFB1回收率为92.00%~100.81%,FB1回收率为89.00%~99.50%。本实验构建快速高效的AFB1和FB1同时检测传感平台,为真菌毒素以及其他小分子靶标的检测提供了新的模型,适用于现场多重检测,在食品和饲料安全监测中具有广泛的应用价值。

