PD-1免疫检查点抑制剂联合TP方案治疗晚期食管鳞癌的效果分析
韩宪春
(山西省中西医结合医院肿瘤血液科,山西 太原 030013)
食管癌(esophageal cancer)是临床上常见的恶性肿瘤之一。此病的病理类型主要包括食管腺癌、食管鳞状细胞癌(食管鳞癌)等,其中食管鳞癌最为常见。手术治疗、放疗和化疗是现阶段临床上治疗食管鳞癌的主要手段,但治疗的效果不理想。因此,越来越多的医疗工作者将研究重心聚焦于寻找食管鳞癌新的治疗手段方面[1]。近年来随着肿瘤免疫治疗的发展及我国免疫抑制剂研究的不断深入,食管鳞癌逐渐步入了免疫治疗时代[2]。程序性细胞死亡蛋白-1(programmed death-1,PD-1)是一种重要的免疫抑制分子。随着我国PD-1 抗体药物的问世,PD-1 抑制剂成为了当前国内治疗食管鳞癌的重要手段[3]。本研究将50 例晚期食管鳞癌患者作为研究对象,探讨用PD-1 免疫检查点抑制剂联合TP 方案治疗晚期食管鳞癌的效果,以期为临床上治疗此病提供参考。
1 资料与方法
1.1 一般资料
选取我院2018 年6 月至2021 年6 月期间收治的50 例晚期食管鳞癌患者作为研究对象。其纳入标准是:病情符合美国国立综合癌症网络(national comprehensive cancer network,NCCN)食管癌诊疗指南[4]中关于晚期食管鳞癌的诊断标准,且经病理学检查得到确诊;认知功能正常,意识清晰,无沟通障碍;其本人及其家属均知晓本研究目的,签署了知情同意书。其排除标准是:患有其他恶性肿瘤;合并有肺栓塞、深静脉血栓或精神疾病;存在认知功能障碍。按照随机数表法将其分为对照组和观察组,每组各有患者50例。两组患者的一般资料相比,差异无统计学意义(P>0.05)。详见表1。

表1 两组患者一般资料的比较
1.2 方法
用TP 方案(紫杉醇+ 顺铂)对对照组患者进行治疗,方法是:每21 d 为1 个化疗周期,在1个化疗周期的第1 天,为患者静脉滴注135 mg/m2的紫杉醇(生产厂家:海南中化联合制药工业股份有限公司;批准文号:国药准字H20083957)。在1 个化疗周期的第2 天,为患者静脉滴注75 mg/m2的顺铂(生产厂家:锦州九泰药业有限责任公司;批准文号:国药准字H21020212)。共治疗2 个疗程(即2 个化疗周期)。用PD-1 免疫检查点抑制剂联合TP 方案(用药方案同上)治对观察组患者进行治疗。本研究所用的PD-1 免疫检查点抑制剂为帕博利珠单抗(生产厂家:MSD Ireland ;批准文号:进口药品注册证号S20180019),其用法是:以固定剂量静脉滴注,每次用药200 mg,每3 周用药1 次,共用药2 次。
1.3 疗效判定标准与观察指标
治疗前后,比较两组患者血清糖类抗原199(carbohydrate antigen 199,CA199)、 癌胚抗原(carcinoembryonic antige,CEA)和鳞状细胞癌抗原(squamous cell carcinoma antigen,SCC)的水平。上述指标的检测方法是:采集患者清晨空腹状态下的静脉血5 mL,对血液标本进行离心处理(离心机转速为3000 r/min,离心时间为10 min),分离出血清并将其置于-20℃的冰柜中保存待检。采用全自动微粒子化学发光免疫分析仪测定血清中CA199、CEA、SCC 的水平,严格按照试剂盒的说明书进行检测,检测所用的仪器和试剂盒均由美国贝克曼公司生产。比较两组患者的近期疗效。依据实体瘤的疗效评价标准[5]用完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、 稳定(stability diseas,SD)、进展(progressive disease,PD)评估其疗效。CR :治疗后患者的肿瘤病灶消失,无新病灶出现,且该疗效维持的时间≥4 周。PR :治疗后患者的肿瘤病灶缩小>30%,无新病灶出现,且该疗效维持的时间≥4 周。SD :治疗后患者的肿瘤病灶缩小≤30% 或增大<20%,无新病灶出现,且该疗效维持的时间≥4 周。PD :治疗后患者的肿瘤病灶增大≥20 或出现新病灶。客观有效率=(CR 例数+PR 例数)/ 总例数×100%。比较两组患者用药后发生不良反应的情况。
1.4 统计学方法
用SPSS 22.0 软件处理本研究中的数据,计量资料用±s表示,采用独立样本t检验,计数资料用% 表示,用χ² 检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 治疗前后两组患者血清肿瘤标志物水平的比较
治疗前,两组患者血清CA199、CEA、SCC的水平相比,差异无统计学意义(P>0.05)。治疗后,两组患者血清CA199、CEA、SCC 的水平均低于治疗前,且观察组患者血清CA199、CEA、SCC 的水平均低于对照组患者,差异有统计学意义(P<0.05)。详见表2。
表2 治疗前后两组患者血清肿瘤标志物水平的比较(± s)

表2 治疗前后两组患者血清肿瘤标志物水平的比较(± s)
注:*与本组治疗前相比,P <0.05。
组别血清CA199(U/mL)血清CEA(ng/mL)血清SCC(ng/mL)治疗前治疗后治疗前治疗后治疗前治疗后观察组(n=25)263.51±55.1262.83±7.93*161.25±36.1652.13±14.39*7.03±1.222.65±0.65*对照组(n=25)270.12±54.49138.61±33.15*163.05±35.2284.74±24.82*7.11±1.254.25±0.75*t 值0.42611.1160.1785.6830.2298.061 P 值0.672<0.0010.859<0.0010.820<0.001
2.2 两组患者近期疗效的比较
治疗后,观察组患者治疗的客观有效率高于对照组患者,差异有统计学意义(P<0.05)。详见表3。
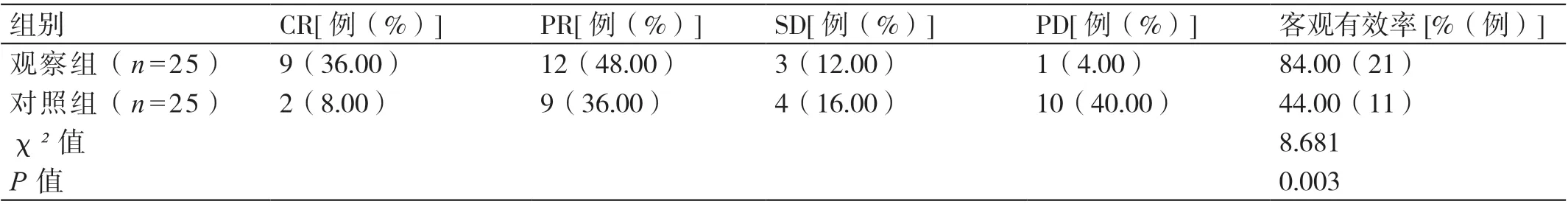
表3 两组患者近期疗效的比较
2.3 用药后两组患者不良反应发生率的比较
用药后,两组患者不良反应的发生率相比,差异无统计学意义(P>0.05)。详见表4。

表4 用药后两组患者不良反应发生率的比较
3 讨论
在肿瘤的免疫治疗中,肿瘤免疫检查点抑制剂(Checkpoint inhibitors)的临床研究较为成熟和充分,且应用最为广泛。此类药物主要分为两大类,一类是以PD-1 为代表的肿瘤免疫检查点抑制剂,另一类是目前尚处于临床研究阶段的肿瘤免疫检查点激活剂[5]。免疫检查点是一类免疫抑制性分子,可调节免疫反应的强度和广度,从而避免正常组织受到损伤和破坏。免疫检查点疗法是指通过共抑制或共刺激信号等一系列途径调节T 淋巴细胞的活性,进而杀伤肿瘤细胞的一种治疗方法[6]。本研究的结果显示,治疗后观察组患者血清CA199、CEA、SCC 的水平均低于对照组患者,差异有统计学意义(P<0.05)。这说明,用PD-1免疫检查点抑制剂联合TP 方案治疗晚期食管鳞癌能显著降低患者血清肿瘤标志物的水平。PD-1 作为免疫球蛋白家族成员,可激活抑癌基因PTEN,调节T 淋巴细胞的活性。本研究中所用的帕博利珠单抗属于PD-1 通路阻断剂。研究证实,用常规化疗药物联合帕博利珠单抗治疗晚期癌症的效果较好[7]。这与本研究的结果基本相符。此外,帕博利珠单抗还可对免疫系统起到刺激作用,促进免疫系统识别肿瘤细胞,进而可抑制肿瘤细胞的生长[8-9]。
本研究的结果证实,用PD-1 免疫检查点抑制剂联合TP 方案治疗晚期食管鳞癌的效果显效,能降低患者血清CA199、CEA、SCC 的水平,促进肿瘤细胞的凋亡,且治疗的安全性较高。

