胰腺导管内嗜酸性乳头状瘤的临床病理学特征(附5例报告)
杨春雪,许海敏,笪 倩
(上海交通大学医学院附属瑞金医院病理科,上海 200025)
胰腺导管内嗜酸性乳头状肿瘤(intraductal oncocytic papillary neoplasm,IOPN)是罕见的胰腺肿瘤,是胰腺癌的癌前病变之一。1996年,Adsay等[1]首次报道11例IOPN,其具有复杂分支的乳头状结构,乳头衬覆的上皮细胞呈嗜酸性。该肿瘤在导管内生长,有复杂的乳头状结构及细胞异型性等,具有与胰腺导管内乳头状黏液瘤(intraductal papillary mucinous neoplasm,IPMN)相似的特征。2010年消化系统WHO分类中,将其归于IPMN的4个亚型之一,即嗜酸细胞亚型,其他3个亚型为胃型、肠型、胰胆管型。然而,最近的研究表明,嗜酸细胞亚型的IPMN具有与其他亚型不同的分子遗传学特点,如KRAS、GNAS等,所以在2019年消化系统WHO分类中,将嗜酸细胞型的IPMN从IPMN中独立出来,命名为IOPN[2]。由于该肿瘤较罕见,现结合我院5例病例及文献复习报道如下。
资料与方法
一、临床资料
收集我院2015年7月至2021年11月诊断IOPN共5例,其中女3例,男2例,平均年龄(60.0±10.4)(47~72)岁。
二、方法
5例病人的标本均经10%中性福尔马林液固定,石蜡包埋,4 μm连续切片,HE染色,光镜观察。免疫组织化学采用EnVision二步法。一抗细胞角蛋白 7(CK7)、细胞角蛋白 20(CK20)、黏蛋白 1(MUC1)、黏蛋白 2(MUC2)、黏蛋白 5AC(MUC5AC)、黏蛋白6(MUC6)、肝细胞抗原Hep Par 1、突触素(SYN)、嗜铬素A(CgA)均购自Dako公司。分析病人年龄、症状、病史、血清学、影像学及病理学特点,并进行电话随访。
结 果
一、临床特点
5例IOPN病人均无慢性胰腺炎及胰腺癌家族史。临床症状为2例伴有腹部隐痛,其中1例半年内体重减轻5 kg。3例体检发现,其中2例病程分别为10年和16年。肿瘤位于胰头部2例,胰头及胰体部1例,胰颈部1例,胰体部1例。1例血清CA724升高,其他血清学指标均正常。胰腺术前分期MR增强检查显示胰腺囊实性(3例)、囊性(1例)、实性占位(1例),3例与主胰管相通。5例胰腺术前分期MR增强检查,均考虑为IPMN,其中2例为混合型IPMN,即混合发生在主胰管及分支胰管内(见表1)。其中4例获得随访结果,均无复发及转移,1例失访。
二、病理特征
5例IOPN肿瘤的平均体积为(5.75±2.25)cm×(3.85±1.15)cm×(3.50±1.50)cm,切面呈多房囊性、囊实性、实性(见表1)。实性区呈灰白色、质脆,囊性区部分囊内壁可见乳头样突起,囊内可含有黏液。显微镜下肿瘤在导管内生长,肿瘤细胞形成复杂的分支状乳头结构,伴有纤细的纤维血管轴心,乳头衬覆肿瘤性立方或柱状上皮。细胞异型性大。比较显著的特点是胞质丰富,呈嗜酸性,富含嗜酸性颗粒,肿瘤细胞核大而圆,核仁明显。上皮间可见黏液细胞,类似杯状细胞,分泌黏液但不显著,可见核分裂象(见图1)。所有病例均为高级别异型增生,但未见伴浸润性癌的成分。免疫组织化学结果:可评估 4 例,CK7 阳性(3/4),MUC1、MUC6 阳性(4/4),MUC5AC 阳性 (3/3),Hep Par 1 阳性(3/4),CK20或MUC2个别肿瘤细胞阳性,SYN及CgA阴性(2/2)(见图 2)。
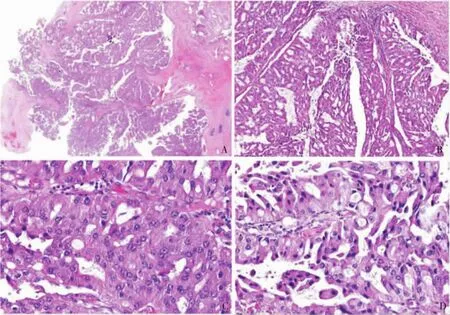
图1 IOPN
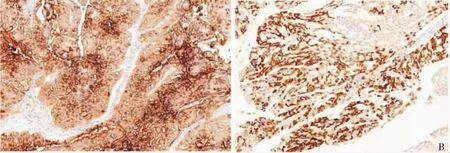
图2 IOPN免疫组织化学
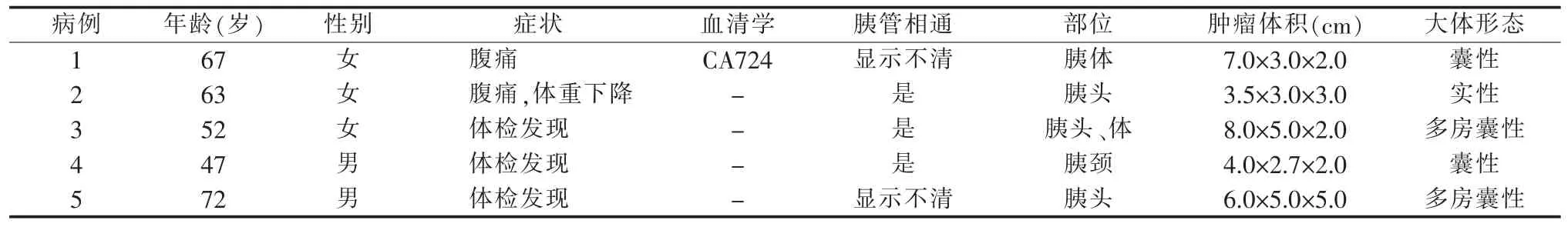
表1 5例胰腺IOPN的临床病理特点
讨 论
IOPN约占所有胰腺导管内肿瘤的4.5%[3],较罕见。其与导管内乳头状黏液性肿瘤的分子遗传学不同,并在组织学形态及免疫表型上独特。2019版WHO消化系统肿瘤分类将其从IPMN中独立出来,WHO定义IOPN为生长在扩张胰腺导管内、肉眼可见的囊性上皮性肿瘤,由衬覆嗜酸性腺上皮的外生性结节状突起组成。如有浸润性癌的成分,则定义为IOPN伴有相关浸润性癌。目前IPMN嗜酸细胞型也是可被接受的名称。
一、临床特点
IOPN多发生于中老年人(36~87岁)[4],本研究平均年龄为(60.0±10.4)岁,女性稍多。也有文献报道两性无显著差异[5]。常起病隐匿,体检时偶然发现。本研究5例中3例体检发现,其中1例病史长达16年。且4例随访结果均无复发,预后良好,可见IOPN侵袭性较低。部分病人有腹部隐痛、腰背放射痛、慢性胰腺炎、肿块导致的黄疸、体重减轻等症状[6]。IOPN可发生于胰腺的任何部位,以胰头常见[6],本研究结果与文献报道相似。
胰腺术前分期MR增强检查显示,IOPN既可发生于主胰管,也可发生于分支胰管,或两者混合[6-7]。3例明确肿瘤与主胰管相通,其中2例为混合型。胰腺囊实性(3例)、囊性(1例)、实性占位(1例)。囊肿壁常伴有实性结节。肿瘤在T1加权像上低密度,T2为高密度。
5例MRI增强检查均诊断为IPMN,胰腺CT或MRI检查尚不能区分IOPN与IPMN。本研究1例血清CA724升高至20.11 U/mL(正常值<8.20 U/mL)。其他肿瘤血清学指标如CA19-9、CEA等均正常。
二、病理学特征
(一)大体表现
Adsay等[1]报道 IOPN的平均直径 6.0(1.6~15.0)cm。本研究平均体积为 (5.75±2.25)cm×(3.85±1.15)cm×(3.50±1.50)cm,肿瘤通常在扩张的胰腺导管内生长或与胰管相通,呈囊性或囊实性。囊性区可由薄的纤维囊壁形成多房或单房的囊腔,囊内可见灰白色或灰褐色、质软、易碎的乳头,或有附壁灰白色结节。但若肿瘤细胞呈实性生长,扩张的胰管结构可能不明显,影像学及大体观察识别导管内病变有一定困难。此外,IOPN产生的黏液一般较其他类型IPMN少[8]。本研究2例肿瘤大体上可见黏液样物。
(二)组织学形态
目前2019版消化系统WHO将IOPN归入胰腺良性上皮性肿瘤及癌前病变。IOPN低倍镜下为导管内生长,可见纤维囊壁形成的囊腔,囊内伴有复杂的分支乳头状结构,部分乳头可融合填满整个导管,呈实性或筛状结构,乳头被覆单层、复层立方或柱状上皮细胞。与其他类型IPMN显著不同的是多数肿瘤细胞胞质内含有丰富的嗜酸性颗粒。IOPN黏液分化常不明显,然而肿瘤细胞间常见含黏液的杯状细胞或含黏液的上皮内腔隙形成筛孔状结构[9]。其他类型IPMN具有更多、更均匀的黏液分化[1,10]。肿瘤细胞核圆形或卵圆形,异型性(核分裂象、核多形性、核染色质粗、显著的核仁等)明显。基于其复杂的结构(复杂分支乳头)及细胞核的异型性,所有IOPN均伴高级别异型增生,而IPMN并不总有这个特点。Liszka等[6]报道的非浸润性IOPN病例中,79%具有重度异型性 (11/14例)。同样,Kang等[11]研究的2例 IOPN病例均为重度异型。约30%IOPN可伴有相关浸润癌,浸润癌具有与导管内肿瘤相似的嗜酸性细胞特点。胃型及胰胆管型IPMN常进展为导管腺癌,肠型IPMN进展为胶样癌[12]。本研究均未见浸润性癌的成分。
(三)免疫组织化学
IOPN CK7/CK8/CK18/CK19阳 性,MUC5AC阳性(同其他类型IPMN一样),MUC1和MUC6阳性,而胃型和肠型IPMN常阴性。MUC2及CK20一般为阴性,但散在于嗜酸性细胞之间的杯状细胞可表现阳性[13]。肠型IPMN MUC2及CK20常阳性。此外,IOPN肿瘤细胞Hep Par 1可阳性。Basturk等[14]的研究显示,61%的IOPN病例Hep Par 1阳性。Hep Par 1染色阳性一般提示具有肝细胞分化,并与细胞质内丰富的线粒体表达一致,但原位杂交未显示其有肝细胞分化[14]。尽管细胞质的嗜酸性表现可由许多原因引起,但IOPN细胞质嗜酸性改变是线粒体增多导致[15]。这可解释IOPN显示Hep Par 1阳性。Mattiolo等[16]研究发现,94.1%的IOPN(16/17例)CD117呈现显著细胞膜阳性,与IPMN有一定的鉴别意义。提示CD117可能是潜在的辅助诊断标志物。本研究可评估 4例,CK7阳性(3/4),MUC1、MUC6 阳性(4/4),MUC5AC(3/3),Hep Par 1阳性 (3/4,75%),CK20或MUC2个别肿瘤细胞阳性,SYN及CgA阴性(2/2)(见表2)。免疫组织化学结果基本与文献一致。

表2 IOPN的免疫组织化学特点a)
(四)分子遗传学特点
IOPN分子遗传学特点的文献报道较少。IPMN最常见的突变基因为KRAS、GNAS和RNF4,其突变频率分别为60%~80%、50%~70% 和50%[17-19]。典型IOPN缺乏KRAS、GNAS和 RNF4等的分子改变。也有文献报道IOPN中存在上述突变,但突变率低于IPMN及胰腺癌[2,20]。Basturk等[2]研究发现,IOPN具有ARHGAP26、ASXL1、EPHA8 和 ERBB4的基因突变,不同于其他类型IPMN的基因特征。Singhi等[21]研究发现,胰腺及胆管IOPN存在ATP1B1-PRKACB、DNAJB1-PRKACA 或 ATP1B1-PRKACA基因融合,且不发生在其他胰胆管肿瘤中,可能是IOPN的驱动基因。但病例均较少,需更多病例进一步研究证实。
三、鉴别诊断
IOPN需与其他胰腺导管内病变和嗜酸性病变鉴别诊断。①IPMN:包括胃型、肠型、胰胆管型。其中胃型与肠型有丰富的黏液分泌,形态上与IOPN较好区分。胰胆管型细胞质内黏液分泌相对较少,同样具有复杂的分支乳头结构,且角蛋白及MUC家族表达基本一致,与IOPN形态学及免疫组织化学表现有交叉。但胰胆管型IPMN乳头更细长。IOPN胞质内显著嗜酸性改变和上皮内腔隙形成的筛孔结构是其特点。Hep Par 1阳性也可帮助鉴别。②胰腺导管内管状乳头状肿瘤(intraductal tubulopapillary neoplasm,ITPN):IOPN和ITPN均发生于导管内。典型ITPN为管状结构或筛状结构,坏死明显,缺乏IOPN的乳头状结构和上皮内腔隙。且ITPN不表达 MUC5AC,其他胰腺导管内肿瘤均表达[22]。③腺泡细胞癌:文献报道偶尔可发生于胰腺导管内,胞质也可呈嗜酸性改变,但其富含酶原颗粒,常呈腺泡状、管状、梁状及实性生长,很少出现乳头状生长。且免疫组织化学标志外分泌酶,如胰蛋白酶、糜蛋白酶等阳性,糖原染色阳性。④胰腺神经内分泌肿瘤:偶可在导管内生长,胞质嗜酸性时,需与IOPN鉴别。免疫组织化学神经内分泌标志CgA和SYN阳性可帮助诊断。⑤实性假乳头状肿瘤:具有典型的假乳头状结构,细胞较一致,核仁不明显,有核沟,间质可见泡沫细胞、胆固醇结晶和透明小球。免疫组织化学CD56、SYN、PR、CD10阳性,β-catenin细胞核和细胞质阳性。⑥胰母细胞瘤:非导管内生长,儿童多见,实性IOPN需与之鉴别。典型的鳞样小体是胰母细胞瘤的诊断要点,且鳞样小体EMA、β-catenin细胞核和细胞质阳性。⑦胰腺黏液性囊性肿瘤:非导管内生长,好发于胰体、尾部,胰头较少见,上皮下具有典型的卵巢样间质,且ER、PR阳性,易与IOPN鉴别。
四、治疗与预后
手术切除治疗。IOPN预后较好。即使伴有浸润性癌,5年生存率仍为100%。45%的病例局部复发,甚至会在肿块切除后10年复发。手术切除时要确保切缘阴性,减少复发。即使复发,再行手术预后仍较好[4]。
IOPN是较罕见的胰腺低度恶性上皮性肿瘤,是胰腺癌的癌前病变。在组织形态学、免疫组织化学及基因遗传学方面有独特的表现。表明IOPN是一类与IPMN完全不同的肿瘤。随着精准医疗时代的到来,病理医师结合临床、形态、免疫及分子遗传学的研究,能精准地作出诊断,有助于精准治疗。

