基于急性胃肠损伤分级的精细化营养干预在结直肠癌手术患者中的应用效果
张晴, 周慧
(徐州市中心医院 胃肠外科,江苏 徐州,221009)
外科手术是当前临床治疗结直肠癌的首选方式,腹腔镜技术的发展也为结直肠癌根治性手术创伤的减轻、术后恢复质量的提高奠定了良好基础[1]。中国结直肠癌诊疗规范(2020年版)建议在辅助治疗中常规评估患者的营养状态,并给予适当的营养支持,倡导肠内营养支持[2]。因此,对于结直肠癌患者而言,开展积极的围手术期营养干预不仅是促进其术后康复的关键环节,也是降低术后并发症发生风险的重要手段。2012年欧洲危重病学会[3]提出,急性胃肠损伤分级是指急性疾病引起的胃肠道功能受损而引发的胃肠道症状,常导致机体代谢紊乱、免疫功能下降及营养吸收障碍。为此,本研究将急性胃肠损伤分级应用于结直肠手术患者的精细化营养干预中,旨在提高营养干预的个体化、针对性,从而实现患者快速恢复。
1 对象与方法
1.1 研究对象
将徐州市中心医院于2018年3月至2021年3月收治的140例结直肠癌患者纳入研究,且研究内容经本院医学伦理委员会审核批准。纳入标准:① 符合结直肠癌诊断标准[4];② 接受结直肠癌根治性手术治疗;③ 术前1 d的营养风险筛查量表2002(NRS 2002)[5]评分<3分;④ 知情同意,自愿参与研究。排除标准:① 合并急腹症;② 合并其他恶性肿瘤;③ 合并心、脑、肺等脏器严重病变;④ 合并凝血功能障碍或代谢性疾病。以便利抽样法将患者分别纳入观察组(70例)、对照组(70例)。观察组中,男39例,女31例;年龄50~75岁,平均(62.95±7.81)岁;病灶部位为结肠44例,直肠26例;急性胃肠损伤分级为Ⅰ级34例,Ⅱ级26例,Ⅲ级5例,Ⅳ级5例;Dukes分期为A期5例,B期29例,C期31例,D期5例。对照组中,男37例,女33例;年龄50~74岁,平均(62.33±8.04)岁;病灶部位为结肠41例,直肠29例;急性胃肠损伤分级为Ⅰ级31例,Ⅱ级28例,Ⅲ级6例,Ⅳ级5例;Dukes分期为A期6例,B期27例,C期30例,D期7例。比较2组患者的年龄、性别、病灶部位、急性胃肠损伤分级及Dukes分期,均未见统计学差异(P均>0.05)。
1.2 方法
2组患者均接受结直肠癌根治性手术治疗,手术均由同组医师完成,术中均试行腹腔镜肿瘤根治术,必要时中转开腹术式。并均接受常规围手术期护理,包括健康宣教、活动指导、遵医嘱用药等,术后给予止痛剂,尽早将胃肠引流管拔除并定期更换切口敷料。
1.2.1 常规营养干预 对照组患者接受常规营养干预,持续至其出院。① 术前干预:嘱患者禁食10 h、禁水8 h。② 术后干预:嘱患者排气后先进食流食,再逐渐过渡至半流食、普食;静脉滴注脂肪乳、氨基酸,开展营养支持;对患者呕吐、胃肠道动力不足等症状予以对症支持。
1.2.2 以急性胃肠损伤分级为基础的精细化营养干预 观察组患者接受基于急性胃肠损伤分级的精细化营养干预,持续至其出院。
1.2.2.1 成立营养支持小组并组织培训 由1名科主任、2名临床医师、2名营养专科护士及1名营养师组建营养支持小组,小组成员可熟练掌握并运用相关培训知识。由科主任安排各项工作,临床医师可熟练进行急性胃肠损伤分级状态的评估;营养专科护士可动态观察患者营养支持的耐受过程,熟练掌握专科技术操作;营养师参与患者的营养评估与观察,并与医师根据“五阶梯营养干预”共同为患者制定精细化营养支持方案。
1.2.2.2 分级评估 参照欧洲急性胃肠损伤分级对患者的胃肠损伤状态进行评估。0级为无胃肠道功能障碍;Ⅰ级为胃肠道功能部分损伤,并以原因明确、一过性胃肠道症状为主要表现,存在发生胃肠道功能障碍或衰竭风险;Ⅱ级为消化道难以充分完成消化、吸收功能,机体营养、水吸收受限;Ⅲ级为胃肠道功能丧失,干预后未见改善;Ⅳ级为胃肠道衰竭,伴多器官功能障碍或休克[3]。
1.2.2.3 分级干预 针对患者的分级评估结果开展精细化营养干预。Ⅰ级患者给予肠内营养支持,以经口进食为主,辅以喂养管营养输注;营养支持期间尽量避免使用影响胃肠道动力的药物。Ⅱ级患者给予胃肠动力药及少量肠内营养支持,肠内营养不耐受或胃瘫患者给予肠外营养支持;选择富含膳食纤维的整蛋白型肠内营养剂,行缓慢喂养,营养目标为20 kcal·kg-1·d-1。Ⅲ级患者先行营养支持不耐受病因干预,处理肠麻痹、胃潴留等基础疾病,再积极纠正代谢紊乱状态,尽早给予肠外营养。Ⅳ级患者行禁食干预,停止肠内营养,积极开展器官功能支持,控制肠道出血、坏死症状,尽早开展手术。
1.2.2.4 实时动态评估 术后每日清晨7时再次评估患者的急性胃肠损伤分级,根据当日分级评估结果设定对应的营养干预方案。待患者恢复经口进食后,嘱其尽量摄入易消化且富含热量、蛋白质和维生素的食物。若患者食物营养摄入量不达标,则增加肠外营养支持干预。
1.3 观察指标
① 记录2组患者的胃肠道功能恢复情况,包括术后进食时间、首次排气时间、首次排便时间及肠鸣音恢复时间。② 比较2组患者的康复情况,包括引流管留置时间、切口愈合时间及术后住院时间。③ 评估2组患者在术前、术后3 d及7 d的营养指标变化,包括白蛋白、总蛋白水平及NRS 2002评分。NRS 2002评分<3分,可能存在营养风险;评分≥3分,存在营养风险。④ 记录并比较2组患者术后并发症(腹泻、腹水等)的发生情况。
1.4 统计学方法
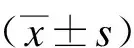
2 结果
2.1 胃肠道功能恢复情况
相比于对照组,观察组的术后进食时间、首次排气时间、首次排便时间及肠鸣音恢复时间均更早(P均<0.05),见表1。

表1 2组胃肠道功能恢复情况比较
2.2 康复情况
相较于对照组,观察组的术后引流管留置时间、切口愈合时间、住院时间均更短(P均<0.05),见表2。

表2 2组康复情况比较
2.3 营养指标变化
术前,比较2组的各项营养指标均未见统计学差异(P均>0.05)。与术前相比,2组在术后3 d及7 d的白蛋白及总蛋白水平均较升高(P均<0.05),且观察组的上述指标水平均优于对照组(P均<0.05)。2组在术后3 d的NRS 2002评分均较术前升高,在术后7 d的NRS 2002评分均较术后3 d降低(P均<0.05);观察组在术后3 d及7 d的NRS 2002评分均优于对照组(P均<0.05),见表3。
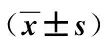
表3 2组营养指标比较
2.4 并发症发生情况
与对照组的并发症总发生率(24.29%)相比,观察组的总发生率(11.43%)更低(P<0.05),见表4。

表4 2组术后并发症发生率比较 [例(%)]
3 讨论
近年来,越来越多的学者开始关注营养因素对恶性肿瘤患者术后康复的影响。有学者[6]指出,营养不良不仅与术后并发症发生风险有关,也是导致患者术后康复缓慢甚至预后不良的重要原因。尤其是对于结直肠癌等消化道恶性肿瘤而言,肿瘤消耗、组织分解代谢增强及胃肠道功能损伤均使其进行性营养不良的风险显著上升[7]。
针对结直肠癌患者开展围手术期营养支持已达成共识,但关于营养支持的方式尚无统一标准。既往临床多采取固定营养支持方式,如术前禁食、术后早期肠外营养,给予流食、半流食、普食过渡性饮食等,但营养支持缺乏针对性,效果有限[8]。为弥补常规营养干预方案缺乏个体性和时效性的弊端,本研究将急性胃肠损伤分级应用于患者的精细化营养干预中。这种新型营养干预模式可根据患者的胃肠道功能特点给予其针对性营养支持,能够提高胃肠道活动和传导能力,从而在维持肠道功能、黏膜完整性的前提下,有效降低胃肠道应激反应、抑制炎症介质释放[9]。得益于这一优势,观察组患者的术后胃肠道功能恢复更早、康复时间更短(P均<0.05),且更早的胃肠道功能恢复时间有助于促使患者早期进食,进而实现营养状态的进一步改善,形成良性循环,促进患者康复。此外,与对照组相比,观察组在术后3 d及7 d的营养指标改善效果更为明显(P均<0.05),说明基于急性胃肠损伤分级的精细化营养干预能够刺激患者胃肠道内分泌系统功能激活与恢复,对于肠道内正常菌群的维持及胃肠道激素、胃酸的分泌均具有积极意义,故可促进患者胃肠道器官血流恢复及消化吸收功能恢复[10]。由此可知,新型精细化营养干预方案能够通过改善患者营养状态,促进机体整体状态的恢复,有助于术后并发症风险的控制及患者预后的改善。本研究中,观察组的术后并发症总发生率(11.43%)较对照组(24.29%)更低(P<0.05),也印证了上述结论。
综上所述,基于急性胃肠损伤分级为基础的精细化营养干预不仅能够缩短结直肠癌患者的术后恢复时间、改善其营养状态,还能降低术后并发症发生的风险,建议推广应用。

