小麦热激蛋白基因TaHSP90-1的克隆与表达分析
陆青, 梁婷, , 王伟伟, 汪德州, 吴娴, , 王小燕*, 唐益苗*
(1.长江大学农学院, 湖北荆州 434025;2.北京市农林科学院杂交小麦研究所, 北京 100097)
热激蛋白(heat shock protein, HSPs)是具有高度保守序列的应激蛋白, 广泛存在于各种生物体内[1]。该蛋白有助于维持蛋白质稳态, 在信号转导、蛋白质运输和降解及生长发育过程中发挥关键作用[2]。热激蛋白又称为热休克蛋白, 其表达由热激转录因子[3](heat shock factor,HSF)控制。热激转录因子通过结合热激蛋白启动子区域的热休克因子(heat shock elements,HSEs)调控热激蛋白的表达[4]。根据蛋白质分子量大小 可 将HSP分 为5大 类:HSP100、HSP90、HSP70、HSP60和sHSP[5]。据报道, HSP90是植物正常生长发育的必需蛋白, 它不仅受非生物和生物胁迫诱导表达, 还参与植物的免疫应答过程[6]。在ATP供能的驱动下, HSPs可促进新合成蛋白质的折叠、功能成熟和稳定, 以及应激后变性蛋白质的复性, 故也称之为分子伴侣。HSP90家族蛋白是热激蛋白家族的重要成员, 包含2个典型的结构域:N端的ATP酶结构域和C端 的HSP90结 构 域[7]。
非生物胁迫通常会导致蛋白质功能障碍。维持蛋白质的功能构象和防止非天然蛋白质的聚集对细胞在压力下的生存尤为重要[1]。HSPs在许多正常细胞代谢过程中负责蛋白质折叠、组装、易位和降解, 稳定蛋白质和膜, 并在应激条件下协助蛋白质折叠。HSPs通过重建正常的蛋白质构象来维系细胞内环境稳定, 在保护植物免受胁迫损伤方面发挥关键作用。拟南芥HSP90家族有7个成员, 对过表达AtHSP90.2、AtHSP90.5和AtHSP90.7的拟南芥植株进行干旱和盐胁迫, 其苗期鲜重明显低于野生型, 表明过表达AtHSP90.5和AtHSP90.7基因在干旱和盐胁迫下抑制了拟南芥的生长, 且AtHSP90.5和AtHSP90.7较AtHSP90.2更加敏感;在高水平Ca2+处理下, 过表达植株的鲜重高于野生型, 表明转基因幼苗对高浓度Ca2+的耐受性高于野生型[8]。拟南芥的Athsp90.1和Athsp90.3敲除突变体与RNAi株系中HSP90的缺失会导致YODA通路中MPK3和MPK6磷酸化减少, 无法正常激活调节下游靶点, 气孔数目减少,从而降低植株对高温的耐受性[9]。水稻HSP90家族有9个成员, 在高温和渗透胁迫下HSP90基因(OsHSP50.2)在各个组织中均被诱导表达, 过表达HSP90水稻的水分损失减少, 转基因植株对干旱和渗透胁迫的耐受性增强;与干旱胁迫下的野生型植株相比, 过表达植株的电解质渗漏和丙二醛(malonaldehyde, MDA)含量显著降低, 叶绿素下降[10]。过表达OsHSP90-4基因的转基因植株在苗期受高温胁迫时的失水率明显低于野生型, 同时ABA会对转基因植株造成明显的抑制[11]。玉米ZmHSP90-1在高温和高盐胁迫下被显著诱导[12]。由此表明, HSP90基因在非生物胁迫响应中具有重要作用。
在气候温暖的小麦主产区, 小麦等温带谷类作物在生殖生长阶段经常会遭遇干旱与高温胁迫, 从而严重影响碳同化和淀粉合成, 导致谷物产量和品质降低。拟南芥、水稻和玉米中HSP90-1基因在植株受到非生物胁迫后表达量发生显著变化, 且转基因植株对非生物胁迫的耐受性明显提升。小麦中HSP90基因成员在不同程度上响应高温胁迫, 大多数基因在转录水平和剪接水平均受到热调控, 且剪接调控早于转录调控[13], 但TaHSP90-1功能尚未见报道。本研究筛选并克隆获得小麦HSP90基因成员中响应干旱和热胁迫的关键基因TaHSP90-1-A、TaHSP90-1-B和TaHSP90-1-D, 分析其在小麦不同耐受性品种的表达变化, 为探讨TaHSP90-1在小麦非生物胁迫响应过程中的生物学功能奠定基础。
1 材料与方法
1.1 供试材料及处理方法
供试材料包括旱热敏感小麦品种小白麦, 旱敏感小麦豫麦13和豫麦47, 耐旱小麦品种皖麦33、宁冬10和川麦44, 耐热小麦品种矮抗58和鲁麦15, 普通小麦京冬18、京411、BS366和BS1453, 均由北京市农林科学院杂交小麦研究所分子育种实验室提供。挑选饱满的小麦种子, 使用5%的NaClO消毒15 min, 无菌水冲洗3遍确保无NaClO残留;在发苗盘上铺1层滤纸, 倒入适量无菌水浸湿滤纸, 将消毒处理后的种子置于滤纸上, 无菌水浸泡48 h;待种子发芽后, 将种子移种至水培盒中, 每3 d更换1次水培液。将水培盒放入恒温培养箱中, 设置培养温度25℃/18℃(光照16 h/黑暗8 h)。待所有品种的小麦幼苗长至2叶1心时, 将其分为两组:一组进行模拟干旱胁迫处理, 将小白麦和皖麦33幼苗的水培液替换为40%的PEG 6 000溶液, 其余条件不变;另一组进行高温胁迫处理, 将小白麦和矮抗58幼苗置于40℃条件下, 其余条件不变, 3次重复。2组处理分别在处理0、2、4、6、8、12 h后取整株苗液氮冷冻, 置于-80℃冰箱用于RNA的提取。
1.2 RNA的提取以及cDNA的合成
用Trizol法提取小麦不同组织及幼苗总RNA[14], 测定OD260/280值;然后使用1.5%琼脂糖凝胶电泳检测总RNA质量, 检测合格后保存于-80℃冰箱备用。用Vazyme的HIScriptⅢ1stStrand cDNA Synthesis Kit反转录合成cDNA, -20℃保存。
1.3 小麦TaHSP90-1基因的克隆
用Ensembl Plants(http://plants.ensembl.org/index.html)网 站 的BLAST(basic local alignment search tool)根据拟南芥热激蛋白基因AtHSP90-1(At5g52640)编码序列为探针搜索小麦同源基因, 得到TraesCS2A02G033700.1、TraesCS2D02G0332 00.1和TraesCS2B02G047400.1共3条 序 列, 用Primer Premier 5(www.bioprocessonline.com)设计引物, 引物序列详见表1。
以小白麦、皖麦33、矮抗58、宁冬10、川麦44、豫麦13、豫麦47、鲁麦15、京冬18、京411、BS366和BS1453[15]的DNA提取为模板进行扩增。PCR反应体系为20μL, 包括2×Taq Plus Master MixⅡ(南京诺唯赞生物科技股份有限公司)10μL, ddH2O 7.4μL, F/R引 物 各0.8μL, 模 板DNA 1μL(100 ng·L-1)。PCR程序:95℃3 min;95℃15 s, 62℃20 s, 72℃130 s, 30次循环;72℃5 min, 4℃保存。使用1.5%的琼脂糖凝胶电泳对PCR产物进行检测, 切胶后使用FastPure GelDNA Extraction Mini Kit试剂盒(南京诺唯赞生物科技股份有限公司)回收纯化分子量为2 000 bp左右的PCR产物。室温条件下使用TA/Blunt-Zero Cloning Kit试剂盒(南京诺唯赞生物科技股份有限公司)连接到测序载体上, 反应时间5 min;然后转化大肠杆菌感受态DH5α。将100μL菌液均匀涂抹到具有氨苄青霉素(100 ng·L-1)抗性的LB固体平板上, 倒置放入37℃恒温培养箱中过夜培养12 h, 然后挑取单克隆进行菌液PCR验证, 酶切鉴定后送北京擎科生物科技有限公司进行测序。
1.4 TaHSP90-1系统发育进化树构建
以TaHSP90-1蛋白序列为诱饵序列, 在Ensembl Plants(http://plants.ensembl.org/index.html)网站进行BioMart搜索, 获得乌拉尔图小麦(Triticum urartu)、大麦(Hordeum vulgare)、二粒小麦(Triticum dicoccoide)、拟 南 芥(Arabidopsis thaliana)、水 稻(Oryza sativa)、番 茄(Solanum lycopersicum)、马铃薯(Solanum tuberosum)的同源序列, 然后利用Pfam(http://pfam.xfam.org/)验证同源蛋白序列的保守结构域。运用ClustalW(http://www.ebi.ac.uk./clustalw/)以默认参数进行多序列比对分析, 使用DNAMAN输出比对结果, 采用MEGA X(www.mega.com)软 件 基 于neighborjoining法构建系统进化树, 用泊松校正模型, bootstrap值设置为1 000。
1.5 TaHSP90-1基因的表达分析
根据TaHSP90-1基因cDNA序列使用软件Primer Premier 5设计用于表达分析的引物(表1), 由北京擎科生物科技有限公司合成。荧光实时定量PCR(real-time PCR,RT-PCR)体系为20μL, 包 括2×ChamQ SYBR qPCR Master Mix 10μL、上下游引物(10μmol·L-1)各0.4μL、cDNA模板1μL(100 ng·μL-1)、ddH2O补齐。反应程序为:95℃30 s;95℃10 s, 60℃30 s, 40次循环;之后增加熔解曲线环节(95℃15 s, 60℃60 s, 95℃15 s)。每次反应3次生物学重复, 使用2-△△CT法[16]计算数据。
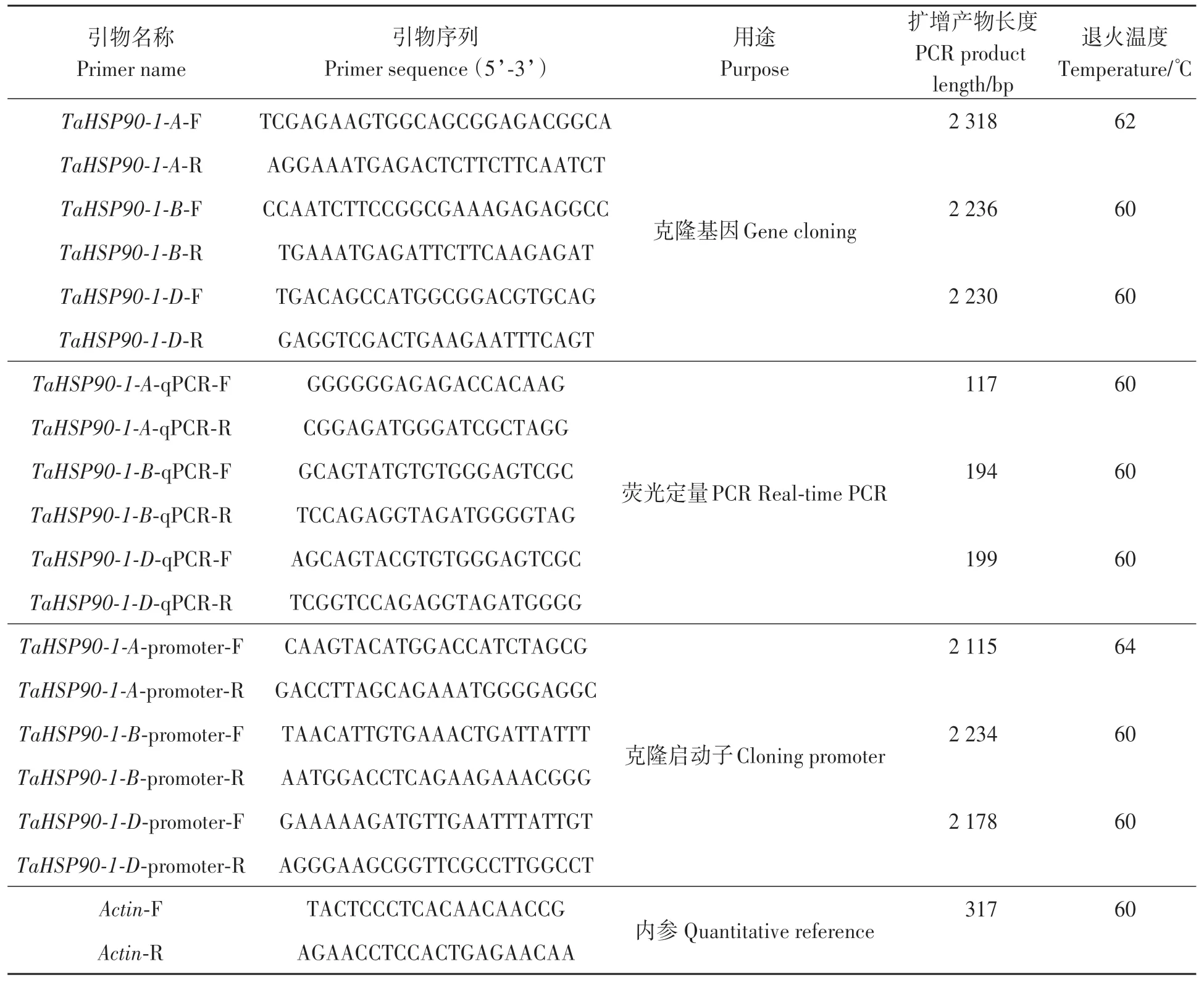
表1 引物名称及序列Table 1 Primer name and sequence
2 结果与分析
2.1 TaHSP90-1基因的克隆及其编码蛋白的结构
经Blast比对分析,TaHSP90-1基因与OsHSP1(LOC_Os04g01740.1)同源性较高,因此分别命名为TaHSP90-1-A、TaHSP90-1-B和TaHSP90-1-D。进一步分析3个基因编码的氨基酸序列(图1)显示, 3个基因均含有2个在ATP水解中起作用的HATPase_C结 构 域 和1个HSP90结 构 域, 证 明TaHSP90-1基因属于HSP90家族。

图1 TaHSP90-1同源蛋白多序列比对Fig.1 Multi sequence alignment of TaHSP90-1 homologous protein
以小白麦、皖麦33、矮抗58、宁冬10、川麦44、豫麦13、豫麦47、鲁麦15、京冬18、京411、BS366和BS1453的DNA为模板进行PCR扩增, 结果(图2A和B)表明, 12个小麦品种的扩增产物大小完全一致, 均为2 000 bp左右。将目的片段切胶回收送测序, 得到长度分别为2 318、2 236和2 230 bp的3个序列, 其开放阅读框分别为2 121、2 136和2 130 bp, 编码707、712和710个氨基酸。对不同小麦品种的TaHSP90-1以及启动子序列比对, 发现皖麦33在TaHSP90-1-B基因第2个内含子546 bp处的碱基为G(图2C), 矮抗58在TaHSP90-1-D启动子区域5’到3’方向第1 447 bp处碱基为T(图2D)。
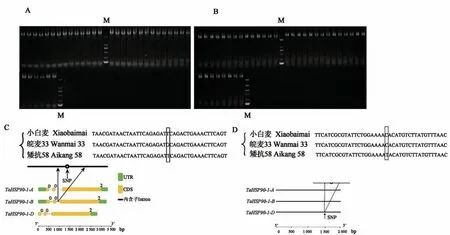
图2 小麦TaHSP90-1基因全长及启动子序列扩增结果与分析Fig.2 Amplification results and analysis of the full-length sequence and promoter of wheat TaHSP90-1 gene
2.2 TaHSP90-1同源蛋白序列的比对及进化分析
将TaHSP90-1蛋白序列提交至Gramene(http://www.gramene.org/)进 行blast比 对, 发 现TaHSP90-1与二粒小麦(Triticum dicoccoide)、乌拉尔 图 小 麦(Triticum urartu)、大 麦(Hordeum vulgare)、水稻(Oryza sativa)、拟南芥(Arabidopsis thaliana)、番茄(Solanum lycopersicum)、马铃薯(Solanum tuberosum)的同源蛋白序列相似性分别为95%、93%、91%、90%、89%、78%和67%。基于邻接法构建的系统进化树(图3)表明, TaHSP90-1与二粒小麦的亲缘关系最近, 而单子叶植物和双子叶植物间具有较大差异。

图3 小麦TaHSP90-1蛋白与其他植物的同源蛋白序列的系统进化分析Fig.3 Phylogenetic analysis of wheat TaHSP90-1 protein and other plant homologous protein sequences
2.3 TaHSP90-1基因的顺式作用元件分析
通过小麦数据库参考数据克隆获得TaHSP90-1-A、TaHSP90-1-B、TaHSP90-1-D起始密码子上 游2 000 bp序列, 提交Plant Care(http://bioinformatics.psb.ugent.be/)分析启动子区顺式作用元件, 结果(表2)发现,3个基因均具有热响应元件与干旱响应元件。在TaHSP90-1-A、TaHSP90-1-B、TaHSP90-1-D启动子序列中分别含有1、0、2个干旱响应元件(MBS element), 其中,TaHSP90-1-A启动子区域的MBS位于5’端210~215 bp处,序列为CAACTG;TaHSP90-1-D启 动 子 区 域 的5’端215~220和578~583 bp各存在1个MBS, 序列均为CAACTG。TaHSP90-1-A、TaHSP90-1-B、TaHSP90-1-D启动子区域分别含有5、3、6个热响应元件(HSE element), 序列为nGAAn/nTCCn, 但TaHSP90-1-A、TaHSP90-1-B、TaHSP90-1-D启动子区域HSE的位置和序列各不相同, 其中TaHSP90-1-A启动子区域的HSE位于5’端的273~283、619~629、650~660、1 074~1 083和1 929~1 942 bp处, 序 列 分 别 为ACATCCTCCG、AGATCCTCTAG、GAATCCTTGTG、TTTTTCCTTT、GGCATCCTGGG;TaHSP90-1-B启动子区域的HSE位于5’端的404~417、1 610~1 622和1 829~1 841 bp处, 序 列分别为AGATTGGAACTCCC、CTCACGAATCGCA、CTCACGAATCGCA;TaHSP90-1-D启动子区域的HSE位于5’端的156~168、206~218、853~866、1 046~1 057、1 446~1 458、1 948~1 962 bp处;序列分 别 为ACGAGAAAATGCA、ACAACTCCCCAGT、ACAAATCCATGAAC、TTTTGAACCGGT、ATGGTC CGTATGT、CAAGTAGAAGCTTCG。
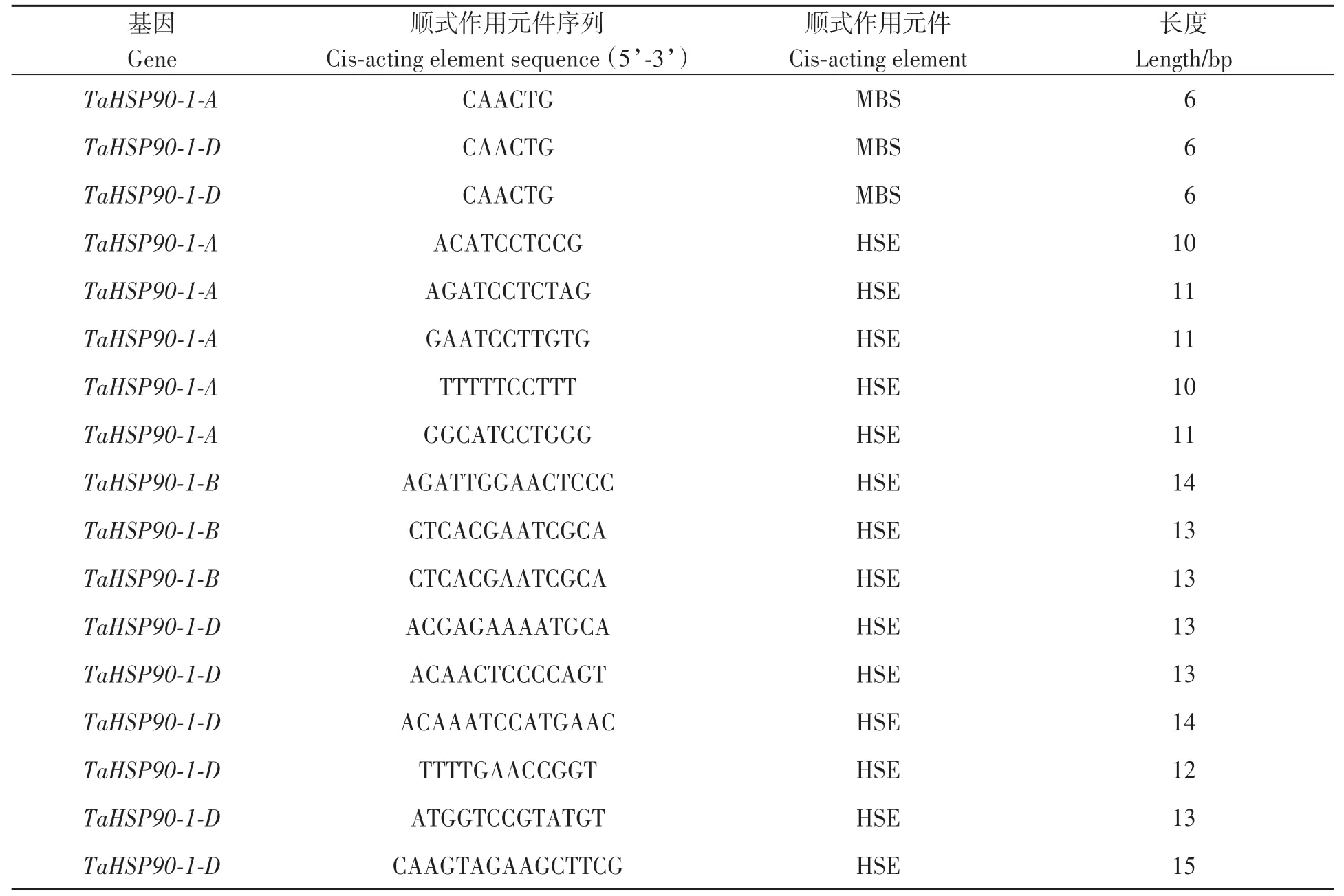
表2 TaHSP90-1顺式作用元件统计Table 2 Cis-acting element statistics of TaHSP90-1
2.4 TaHSP90-1基因的组织表达特异性分析
利用中国春小麦不同组织cDNA, 通过RTPCR技术分析苗期以及成熟期小麦不同组织中TaHSP90-1的表达量, 结果(图4)表明,TaHSP90-1-A、TaHSP90-1-D在各个组织中均有表达;TaHSP90-1-A、TaHSP90-1-B和TaHSP90-1-D均在叶中的表达量最高, 其次为茎和颖壳, 根、穗和种子中的表达量较低;TaHSP90-1-B在根和颖壳中不表达。
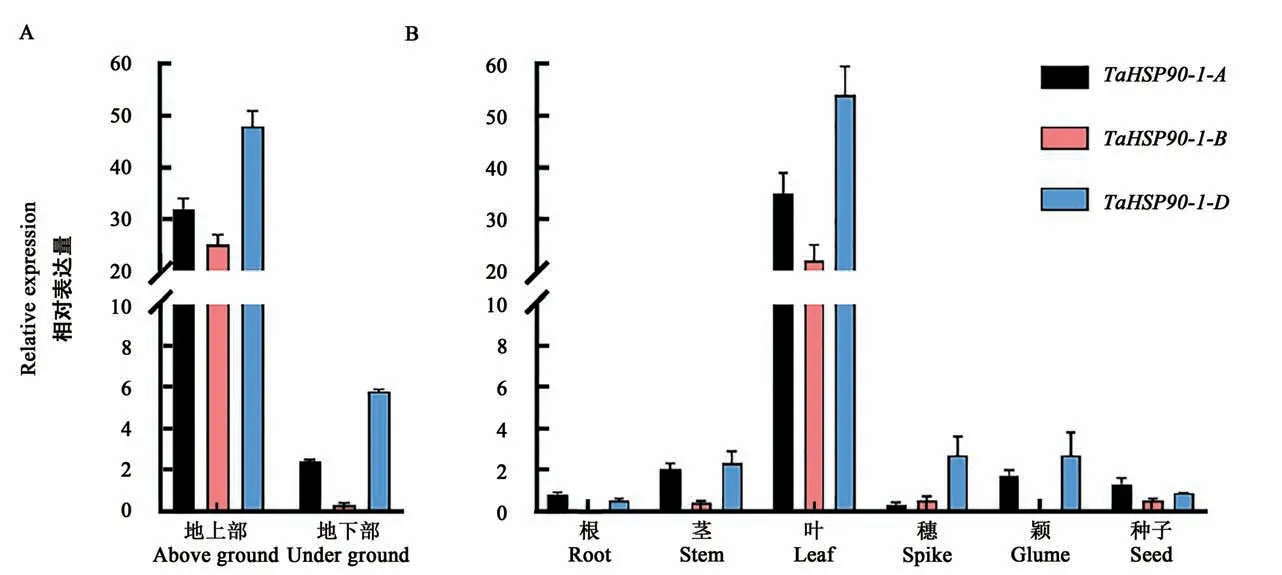
图4 小麦TaHSP90-1在不同组织中的相对表达量Fig.4 Relative expression of TaHSP90-1 in different tissues of wheat
2.5 干旱胁迫下TaHSP90-1基因的表达分析
对12个小麦品种的TaHSP90-1序列比较发现, 皖麦33TaHSP90-1-B第2个内含子区域含有SNP位点(图2C)。皖麦33为耐旱品种, 为进一步验证皖麦33的耐旱性, 以皖麦33和小白麦为试验材料, 培养至1叶1心时将水培液更换为40%PEG 6000进行模拟干旱胁迫。处理12 h后发现, 小白麦的萎蔫程度较皖麦33严重, 而皖麦33虽有一定程度萎蔫但大部分植株茎秆直立, 说明苗期皖麦33较小白麦具有更强的耐旱性。
RT-PCR结果(图5)显示, 皖麦33受干旱胁迫后TaHSP90-1的表达量上调,TaHSP90-1-A、TaHSP90-1-B和TaHSP90-1-D基因的表达量均在胁迫后4 h时达到最高, 随后表达量迅速下降;小白麦TaHSP90-1-A、TaHSP90-1-B和TaHSP90-1-D基因的表达量基本无变化。由此表明, 不同小麦品种苗期TaHSP90-1基因的表达量与其耐旱性关系密切。

图5 干旱胁迫下小麦TaHSP90-1在不同品种中的表达分析Fig.5 Expression analysis of wheat TaHSP90-1 in different varieties under drought stress
2.6 高温胁迫下TaHSP90-1基因的表达分析
对小麦品种的TaHSP90-1序列比较, 发现矮抗58TaHSP90-1-D启动子区域含有SNP位点(图2D)。矮抗58为耐热品种, 为进一步验证矮抗58的耐热性, 以矮抗58和小白麦为试验材料, 培养至1叶1心后置于40℃环境进行高温胁迫处理。处理12 h后, 发现部分小白麦地上部出现萎蔫、失水和茎秆倒伏, 而矮抗58虽出现萎蔫但较小白麦萎蔫程度更轻, 由此表明, 矮抗58具有比小白麦更强的耐热性。
RT-PCR结 果(图6)显 示, 矮 抗58中TaHSP90-1-A和TaHSP90-1-D基因的表达量上调, 且分别在胁迫2~4 h达到最高值, 随后表达量迅速下降, 但TaHSP90-1-B基因的表达量变化较小;小 白 麦 中TaHSP90-1-A、TaHSP90-1-B和TaHSP90-1-D基因的表达量也有所上调, 但增幅远 低 于 矮 抗58。由 此 表 明,TaHSP90-1-A、TaHSP90-1-B、TaHSP90-1-D基因受热胁迫诱导表达, 小麦苗期TaHSP90-1基因的表达变化可能与热胁迫相关。
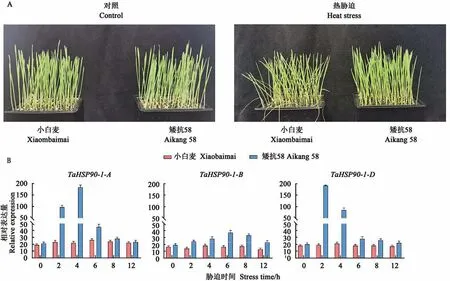
图6 热胁迫下小麦TaHSP90-1在不同品种中的表达分析Fig.6 Expression analysis of wheat TaHSP90-1 in different varieties under heat stress
3 讨论
HSP90蛋白广泛存在于生物体内, 目前, 在拟南芥[17]、水稻[18]、小麦[19]、番茄[20]和谷子[21]等植物中均有报道。水稻中过表达HSP90植株不仅表现出对高温胁迫的耐受性, 且其耐旱性也有一定程度的提升[22]。本研究从小麦中克隆得到TaHSP90-1的全长DNA序列, 生物信息学分析表明,TaHSP90-1基因编码的氨基酸序列与水稻、拟南芥等植物HSP90氨基酸序列存在高度同源性, 且都含有2个保守结构域HATPase_C和HSP90, N端的ATPase结构域能够结合并催化ATP, 此部位同时也是HSP90抑制剂的结合位点, ATPase结构域是保证HSP90蛋白发挥生物学活性的必须基团[23], 推测TaHSP90-1具有与拟南芥和水稻HSP90蛋白相似的功能。
HSP90可调节自身的转录和翻译水平, 研究表明, HSF和HSE的结合受HSP90的调节, 当细胞内HSP90浓度增高时, 以阻遏蛋白形式结合到HSF上, 阻止HSF与HSE的结合, 从而限制HSP90基因的转录;当HSP90浓度较低时, HSF与HSE正常结合, HSP90基因开始转录[24]。水稻OsHSP90同样具有分子伴侣功能, 过表达植株在受到高温胁迫时, OsHSP90蛋白量增加, 它们会向膜组分靠近, 并与膜蛋白互相作用, 延缓膜蛋白的变性及促进变性蛋白的复性或降解, 使植株表现出更强的抗逆性[22]。TaHSP90-1系统进化树分析显示, 单子叶植物和双子叶植物被划分为2大类, 推测该基因可能出现在单双子叶植物分化之前[25]。
HSP90在植物气孔的生长发育过程中也发挥着重要作用。据报道, HSP90调节转录因子基因SPCH和MUTE的表达, HSP90基因 缺 失将导致气孔分化率降低, 因此, 在正常和热应激条件下, HSP90通过调控这2种转录因子来调节气孔[26]。TaHSP90-1高表达可以提高小麦苗期的耐旱性及耐热性, 且TaHSP90-1主要在叶片中表达, 推测TaHSP90-1的表达会影响YODA通路上相关基因的表达, 调节气孔减少水分的散失以应对干旱以及热胁迫[27]。顺式作用元件分析发现, TaHSP90-1-A、TaHSP90-1-B和TaHSP90-1-D干旱响应元件均为MBS, 在启动子区域的数量分别为1、0、2个。比较12个小麦品种的TaHSP90-1基因序列发现, 仅皖麦33的第2个内含子区域出现1个SNP位点;对皖麦33进行模拟干旱胁迫处理表明, 皖麦33中TaHSP90-1-A、TaHSP90-1-B和TaHSP90-1-D的表达量明显高于旱敏感品种小白麦, 推测mRNA转录可能受内含子影响;尽管TaHSP90-1-B的干旱响应元件个数为0, 但其表达量也较高, 因此, 推测TaHSP90-1-A、TaHSP90-1-B和TaHSP90-1-D基因可能对小麦耐旱性起正向调控。
TaHSP90-1-A、TaHSP90-1-B和TaHSP90-1-D启动子区域的热响应元件(HSE)数量分别为5、3、6个, 且HSE的碱基序列各不相同。热响应元件的数量与受热胁迫时基因的表达量成正比, 在热敏感品种小白麦中, TaHSP90-1基因表达虽有上调趋势, 但表达量远低于耐热品种矮抗58, 且在耐热品种矮抗58受到热胁迫时, TaHSP90-1-D基因的表达量在胁迫后2 h达到峰值, TaHSP90-1-A和TaHSP90-1-B在胁迫后4 h达到峰值, 表明TaHSP90-1-D较TaHSP90-1-A和TaHSP90-1-B具有更快的响应速度。研究发现, HSF与HSE结合调控TaHSP90-1的表达, 且HSE数量越多TaHSP90-1基因转录越迅速、表达量越高[26]。矮抗58 TaHSP90-1-D启动子区域特有的SNP可能影响基因表达, 推测高温胁迫下TaHSP90-1-D的表达量与启动子结构紧密相关。

