低磷胁迫对小麦镉吸收的影响
贾睿琪, 郭子昂, 姚晨, 李璞, 腊贵晓, 陆夏梓, 郭虹妤, 李烜桢*
(1.河南农业大学林学院, 郑州 450002;2.河南省地质环境勘查院, 郑州 450051;3.河南省农业科学院经济作物研究所, 郑州 450002)
镉(Cd)是土壤中常见的重金属之一, 在全国土壤污染调查点位中超标率为7.0%[1-2]。土壤中镉易被作物吸收, 进而进入食物链并威胁人体健康[3-4]。研究表明, 植物对镉的吸收能力不仅与作物种类有关[5-8], 也与土壤条件有关, 如理化性质、养分等[9-10]。磷(P)是作物所需的大量元素[11]之一, 在石灰性土壤中, 无机磷(Pi)约占土壤总磷的75%~85%, 主要存在于磷酸钙矿物中[11-12]。植物根系只能吸收可溶态正磷酸盐(Pi、H2PO-4或HPO2-4), 而土壤中的可溶态Pi很容易吸附在酸性土壤中的铝和铁氧化物上, 或与石灰性土壤中的钙结合[13]。尤其在石灰性土壤中, 由于pH通常大于7.5, 因此磷的生物有效性较低[11,14]。为了应对低磷胁迫, 植物可以通过一系列策略来获取磷[15-18], 包括增加根系长度和根毛数量等。此外, 植物还可以提高质子、羧酸根和磷酸酶根际释放量, 以活化无机磷(Pi)和有机磷(Po)[19-21], 这些分泌物有助于溶解难溶态Pi, 或从Po化合物中释放Pi, 从而提高磷的生物有效性。
黄淮海平原是小麦(Triticum aestivum L.)的主产区之一, 一般认为黄淮海平原农田属于石灰性土壤, 镉生物有效性较低, 然而有调查发现该地区的小麦存在镉超标现象[22]。有研究表明, 土壤供磷水平可影响植物对镉的活化和吸收, 例如Ma等[23]发现低磷水平较高磷水平更易促进小麦对镉的吸收, 可能与低磷胁迫下小麦的根系分泌物有关, 但机制尚不明确。为进一步阐明供磷水平对小麦吸收镉的影响, 本研究通过砂培试验揭示低磷胁迫对小麦生物量以及对磷和镉吸收的影响, 并分析根系分泌物特征, 为通过调控磷素生物有效性来降低小麦中镉含量提供理论依据。
1 材料与方法
1.1 供试材料
供试小麦品种为郑麦1860, 种子购于河南秋乐种业科技股份有限公司;供试石英砂购于上海麦克林生化科技有限公司, 粒径0.55~1.00 mm, 主要成分为99.9%的SiO2, 分析纯(AR)。
所 用Hoagland营 养 液 成 分 为:5 mmol·L-1CaNO3·4H2O, 5 mmol·L-1KNO3, 1 mmol·L-1NH4NO3, 1 mmol·L-1KH2PO4, 2 mmol·L-1MgSO4·7H2O, 0.5 mg·L-1H3BO4, 4 mg·L-1FeSO4, 0.5 mg·L-1ZnSO4, 0.5 mg·L-1MnCl2, 0.02 mg·L-1CuSO4和0.01 mg·L-1(NH4)6Mo7O, 使用1 mol·L-1NaOH调节营养液pH至6.8。
1.2 试验设计
本研究采用砂培试验, 具体步骤为:在塑料量杯(高度14.5 cm, 直径11.0 cm)中填充600 g石英砂, 并加入180 mL Hoagland营养液。考虑到Ca3(PO4)2是土壤中磷的主要存在形式[24], 因此在低磷胁迫处理中, Hoagland营养液中的磷源采用等量的Ca3(PO4)2置换KH2PO4, 每个处理4个重复, 以采用正常Hoagland营养液的处理作为对照(CK)。为了分析不同供磷水平对Cd吸收的影响, 并考虑到石灰性土壤中镉主要以CdCO3形式存在[23], 因此对照和低磷处理中均混入12.3 mg·L-1的CdCO3。
培养试验在光照培养箱(HPG-320BX, 哈尔滨市东联电子技术开发有限公司)中进行。具体步骤为:挑选籽粒饱满的小麦种子, 在5%次氯酸钠溶液中浸泡15 min, 用去离子水冲洗干净后置于烧杯中浸泡8 h, 将泡好的种子均匀摆放在垫有3层湿滤纸的育苗盘中, 25℃黑暗中发芽72 h, 然后播种9粒发芽种子在塑料量杯中。小麦整个生长期光照时间为昼14 h/夜10 h, 温度为昼25℃/夜22℃。每天补充10 mL营养液(补充总量控制为120 mL, 保持处理间获取相同总量的磷), 并补充水分至石英砂的饱和含水量, 种植14 d后收获小麦进行分析。
1.3 样品采集和处理
将小麦植株完整取出, 用去离子水将根系冲洗干净, 滤纸吸干表面水分, 通过根系扫描仪对根系进行扫描, 用于分析根系形态指标;使用灭菌不锈钢剪刀分离地上、地下部, 取0.5 g根部鲜样置于灭菌研钵中, 冰浴研磨出汁液, 用于测定根中小分子有机酸含量[25];剩余样品置于烘箱中105℃杀青30 min后, 65℃烘干至恒重, 测定小麦地上部和地下部干重;然后将样品通过球磨机磨碎, 消解测定小麦样品中的磷和镉含量;通过抽滤装置收集种植小麦后砂培中剩余营养液, 用于测定培养基pH和有机酸含量。
1.4 指标测定
通 过 离 子 色 谱(IC5000, Thermo Fisher Scientific)测定培养基和小麦根中有机酸(草酸根、苹果酸根)含量;小麦样品通过HNO3-H2O2(7∶1, V/V)进行微波消解, 消化液采用钼锑抗比色法, 通过紫外可见分光光度计(UV2400, 上海舜宇恒平科学仪器有限公司)测定总磷含量;通过火焰原子吸收分光光度计(900T, PerkinElmer)测定总镉含量;培养基pH通过pH计测定。
1.5 数据处理与分析
采用Excel 2016和SPSS 25.0软件进行数据处理分析, 采用独立样本t检验分析不同处理间数据的差异显著性;采用WinRHIZO软件对根系扫描仪扫描图像进行分析;采用Origin 2019b进行绘图。
2 结果与分析
2.1 低磷胁迫对小麦生长的影响
通过分析不同处理小麦干重和根系形态指标发现(图1), 低磷处理的小麦地上部干重与对照无显著差异, 但地下部干重较对照显著降低, 降幅达27.3%(P<0.05), 且低磷处理根系的总根长、根表面积、根体积较对照也显著降低, 降幅分别达51.3%、42.1%和29.9%(P<0.05)。低磷处理根系的根平均直径较对照增加21.8%, 但未达到显著水平。总的来说, 低磷胁迫抑制了根系的生长。
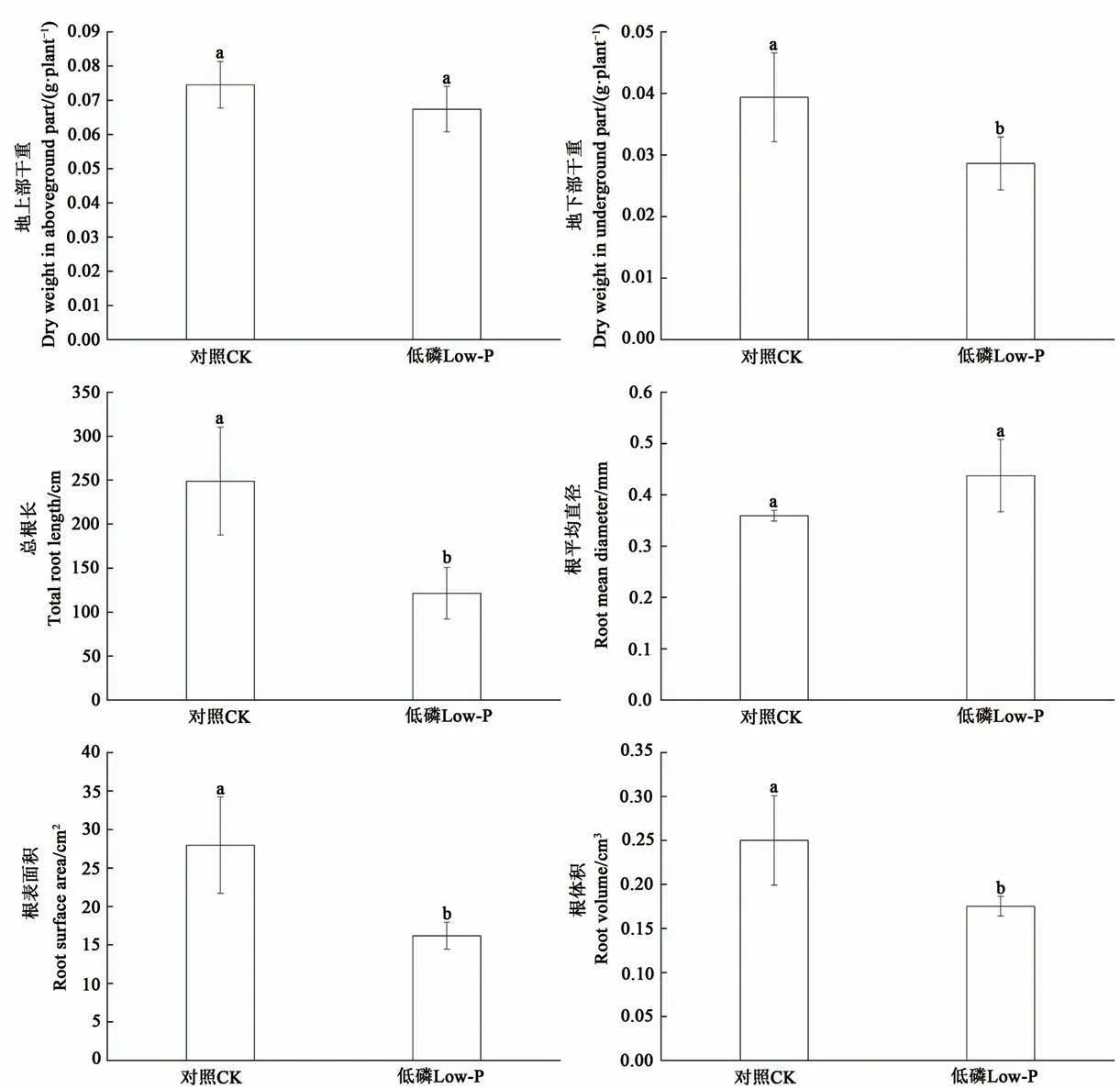
图1 低磷胁迫对小麦干重及根系形态指标的影响Fig.1 Effects of low phosphorus stress on wheat biomass and root morphological indicators
2.2 低磷胁迫对小麦富集磷和镉的影响
通过分析小麦磷和镉含量发现, 低磷处理中小麦地上部和地下部磷含量均显著低于对照, 分别下降35.4%和23.1%(P<0.05)(图2), 但培养14 d后低磷处理小麦对磷的总活化量较培养0 d(初始)显著增加, 增幅达1 515.0%(P<0.05)(图3), 表明低磷胁迫降低了小麦对磷的吸收, 但促进了小麦对磷的活化。在低磷胁迫下, 小麦地上部和地下部镉含量较对照分别显著增加172.1%和192.8%(P<0.05)(图2), 培养14 d后小麦对镉的总活化量较对照也显著增加, 增幅达71.6%(P<0.05)(图3), 表明低磷胁迫可促进小麦对镉的活化与吸收。总的来说, 低磷处理显著降低了小麦对磷的吸收, 但促进了对磷的活化, 同时促进了对镉的活化与吸收。

图2 低磷胁迫对小麦磷和镉含量的影响Fig.2 Effect of low phosphorus stress on phosphorus and cadmium contents in wheat

图3 低磷胁迫对小麦-培养基体系中磷和镉含量的影响Fig.3 Effect of low phosphorus stress on the distribution of phosphorus and cadmium in wheat-culture medium system
2.3 低磷胁迫对小麦根系酸化能力的影响
通过分析培养基pH(图4)发现, 低磷处理培养0 d(初始)培养基pH较对照高0.1, 但差异未达到显著水平;在培养14 d后, 低磷处理较对照降低了0.3, 但差异未达到显著水平。通过分析培养基和小麦根中2种有机酸含量(图4)发现, 不同处理培养基中草酸根和苹果酸根含量无显著差异, 但是低磷处理小麦根中草酸根和苹果酸根含量显著高于对照, 增幅达1 588.1%和37.7%(P<0.05)。总的来说, 低磷胁迫增加了小麦根中草酸根和苹果酸根含量, 同时一定程度上降低了培养基pH。

图4 低磷胁迫对培养基pH、有机酸含量及小麦根中有机酸含量的影响Fig.4 Effect of low phosphorus stress on medium pH, organic acid and organic acids in wheat roots
3 讨论
3.1 低磷胁迫促进小麦根系对磷的活化
植物根系可通过多种策略应对低磷胁迫, 包括形成根毛和丛生根、增加根系分泌物(如磷酸酶和羧酸根)、提高磷转运蛋白活性、提高菌根定殖率等[16,26-27]。本研究低磷胁迫显著降低了小麦地下部干重、总根长、根表面积和根体积, 即低磷胁迫抑制了根系生长。这与已有研究结果相似, 例如Manske等[28]发现, 在墨西哥中部高地的缺磷火山灰土中, 低磷对小麦根系生长有强烈的抑制作用, 另外的一些盆栽和田间试验也发现了类似的现象[29-30]。磷是植物必需的大量元素, 约占植物干重的0.05%~0.50%, 在植物生长发育过程中具有重要的生理功能, 是DNA、RNA、ATP以及生物膜磷脂的重要成分, 与光合作用、能量代谢等多种生化反应相关[31]。缺磷易导致植株矮小、根系发育迟缓等现象, 因此本研究所观察到的低磷胁迫造成的植物根系指标降低的现象可能与磷营养供应不足有关。
本研究发现, 低磷处理小麦地上部和地下部磷含量均显著低于对照, 表明以Ca3(PO4)2为磷源来表征低磷胁迫是可行的。同时还发现, 低磷胁迫显著提高了小麦对磷的活化量, 表明小麦对磷具有有效的活化机制。有研究表明, 根系分泌物(质子或羧酸根)是植物改善磷获取的有效策略[32-36]。为了进一步阐明低磷胁迫小麦对磷的活化机制, 本研究分析了培养基中pH和有机酸含量, 结果表明低磷胁迫一定程度上促进了小麦根系对质子的分泌, 造成培养基pH的下降;同时还发现低磷胁迫下培养液中羧酸根含量虽未显著提高, 但根中的草酸根和苹果酸根含量显著提高。质子可以导致难溶态磷Ca3(PO4)2的溶解, 而羧酸根可以与Ca3(PO4)2中的Ca发生螯合, 从而释放磷酸根, 这2个过程都可以提高磷的有效性, 最终增加植物对磷的吸收[37-38]。此外, 本研究发现尽管小麦根中的草酸根和苹果酸根含量显著提高, 但低磷胁迫下培养液中羧酸根含量并未显著提高, 这可能是羧酸根分泌到根外后, 与低磷处理中Ca3(PO4)2发生反应并形成了羧酸-Ca沉淀[39]。
3.2 低磷胁迫提高小麦对镉的活化和吸收
本研究还发现, 低磷胁迫提高了小麦植株镉含量, 还促进了镉的活化。这种现象很有可能是低磷胁迫导致小麦根系分泌物改变造成的。有研究发现了相似的现象, 例如Yang等[40]发现, 在砂培条件下低磷处理(以磷酸铁和磷酸铝作为磷源)中菜心(Brassica campestris L.ssp.chinensis var.utilis Tsen et Lee)可通过分泌有机酸促进Cd溶解进而增加植物吸收。Edayilam等[41]发现在砂培条件下低磷处理可促进弗吉尼亚须芒草(A.virginicus)对硅钙石中铀的溶解, 而这种溶解度的提高是通过增加羧酸根实现的。根系分泌的质子可导致根际环境酸化并直接溶解沉淀态的镉[40], 而羧酸根可与镉螯合, 提高其生物有效性, 增加植物对镉的吸收[14]。由此可见, 低磷胁迫促进了小麦根系对质子的分泌可能是造成镉活化的原因之一。此外, 羧酸根的存在能够促进碳酸盐的溶解[42], 羧酸根与CdCO3中的Cd发生螯合作用活化镉, 增大了镉的溶出量[43-45], 导致在低磷处理检测到了更高的镉活化量, 这也有可能是促进镉活化的原因之一。总的来说, 低磷胁迫可能导致根系质子和羧酸根分泌增加促进镉的活化。
综上所述, 低磷胁迫降低了小麦地下部干重, 并降低了总根长、根表面积、根体积等指标, 在这种情况下, 小麦可通过分泌质子和羧酸根(草酸根和苹果酸根)来溶解难溶态磷, 并促进小麦对磷的吸收。同时, 低磷胁迫提高了小麦植株镉含量, 这是由于低磷胁迫刺激了小麦根系质子和羧酸根分泌, 在活化了磷的同时也活化了镉, 最终导致了小麦镉吸收增加。

