艾活性成分生物合成调控相关的WRKY转录因子筛选及表达分析*
易小哲,王梦月,邬 兰,刘 霞,刘佳伟,农熠瑛,陈士林,师玉华**
(1. 中国中医科学院中药研究所青蒿素研究中心/中药鉴定与安全性评估北京市重点实验室 北京 100700;2. 武汉理工大学化学化工与生命科学学院 武汉 430070;3. 湖北艾艾贴健康科技有限公司 黄冈 435300)
艾叶来源于菊科蒿属植物艾(Artemisia argyi)的干燥叶,是我国的传统中药材。艾叶作为药材正式记载始于《名医别录》[1],具有悠久的药用历史,《中国药典》记载其有温经止血,散寒止痛的效用[2]。此外,艾叶也是艾灸产品主要原料,具有重要的经济价值。艾的有效活性成分以挥发性的萜类化合物为主,具有抗菌抗炎、止咳平喘的药理作用[3]。随着艾叶和艾灸在医药和保健产品工业中的大量应用,艾的品质研究也受到了广泛的关注。萜类活性成分作为艾叶中的次生代谢产物,是一类重要的天然产物,依赖于植物提取。因此,增加艾叶中萜类活性成分的含量对艾叶品质的提升有着关键作用。因此,筛选和鉴定艾中萜类生物合成途径相关的调控因子研究将有助于解析其生物合成和积累分子机制,为艾中活性成分含量提升提供了分子生物学依据。
转录因子(transcription factors, TFs)是可以与DNA 序列以特定的方式结合调节转录的蛋白质[4]。在高等植物中,TFs 是信号转导通路的重要组成部分,参与调节植物生长发育、次生代谢和胁迫反应等重要生理过程[5-6]。WRKY 家族是植物中最大的转录因子家族之一,主要在植物生长发育和响应逆境胁迫中发挥重要作用[7]。WRKY家族转录因子含有约60个氨基酸残基序列组成的高度保守结构域,称为WRKY 结构域,其N 端是WRKYGQK 保守序列,被称为WRKY 七肽结构;C 端则是具有一个典型的锌指结构,由CX4-5-C-X22-23-H-X1-H 或C-X7-C-X23-H-X1-C 组 成[8]。WRKY 结构域是WRKY 蛋白与DNA 分子结合的主要位点,主要通过与目标基因启动子区的W-box 结合来调控目的基因的转录[9]。WRKY 家族根据含WRKY 结构域的数量和锌指结构的类型划分为I、II、III三类,具有两个WRKY 结构域的蛋白为组I;具有一个WRKY结构域且具有C2H2 结构(C-X4-5-C-X22-23-H-X1-H)为组II,具有一个WRKY 结构域且具有C2HC 结构(C-X7-C-X23-H-X1-C)的为组III。其中组II中又根据保守氨基酸的差异细分为IIa、IIb、IIc、IIf、IIe 五类[10]。WRKY 家族转录因子参与了多种激素的信号通路,例如茉莉酸(Jasmonic acid,JA)、水杨酸(Salicylic acid,SA)和脱落酸(Abscisic acid,ABA)等激素信号,从而影响植物生长发育和次生代谢等[11]。例如,拟南芥的AtWRKY70 是SA 与JA 介导抗病信号转导途径中的调控因子,是SA 诱导基因的激活剂和JA 响应基因的阻遏物[12];丹参SmWRKY14被鉴定为受JA、ABA、赤霉素(Gibberellin,GA)等植物激素及机械损伤强烈诱导的WRKY基因,并且与丹参酮合成关键酶基因DXS、GGPPS、CPS的表达模式相似,可能参与到了丹参的萜类次生代谢产物的生物合成中[13];小麦TaWRKY40-D可能参与JA 和ABA 途径来正调节小麦的叶片衰老过程的WRKY 蛋白[14]。其中,JA 是高等植物内发现的一种内源性植物激素,通过调控与植物抗逆有关基因的表达,缓解植物在生长发育过程中受到的生物与非生物胁迫,是一种重要的生长调节剂[15]。研究表明JA 在调节植物抗逆的过程中,会增加次生代谢产物的积累[16],而药用植物中的次生代谢产物通常是其有效成分[17]。很多WRKY 家族转录因子在JA 信号诱导的药用植物次级代谢产物的生物合成和积累过程中发挥着重要作用[18]。例如,Suttipanta 等[19]通过在长春花中过表达一个受JA 诱导的WRKY 蛋白CrWRKY1,发现其能上调长春花中萜类抗癌活性成分吲哚生物碱(terpene indole alkaloids ,TIA)合成基因的表达,增加TIA 的含量;Li 等[20]发现在红豆杉悬浮细胞中,由外源茉莉酸甲酯(Methyl Jasmonate,MeJA)特异性诱导的TcWRKY1 蛋白的过表达能够增强紫杉醇生物合成中的关键酶DBAT 的表达;Chen 等[21]发现青蒿素腺毛中特异表达的WRKY1基因(AaGSW1)是JA/ABA 响应的转录因子,且能够正向调节CYP71AV1和AaORA的表达,从而提高青蒿素含量。因此,WRKY 家族转录因子在JA响应和药用活性成分累积中具有重要作用。
目前,艾的分子生物学研究开展尚浅,WRKY 家族转录因子的鉴定及其功能还没有报道。本研究拟以艾的外源MeJA 处理转录组文库为基础,系统鉴定艾的WRKY 家族转录因子,并通过其蛋白理化性质、进化关系、保守基序等特征分析和JA胁迫下的基因表达模式分析,筛选在外源MeJA 处理下差异表达的WRKY基因,为艾叶WRKY 家族转录因子鉴定和参与MeJA 诱导的艾叶中萜类等活性成分的累积机理研究提供分子生物学基础。
1 材料与方法
1.1 植物材料及处理
本研究所用艾(A. argyi)采自湖北蕲春县张榜镇蕲艾种植基地,将新鲜的根状茎移栽至中国中医科学院中药研究所温室中培育。选择来自一株植物的根茎繁殖的、长势一致的90天龄幼苗作为试验材料。分别用100 μmol·L-1的MeJA 溶液(98% MeJA,Sigma,W341002-SAMPLE-K,以含0.098%无水乙醇的去离子水为溶剂)和空白溶液(含0.098%无水乙醇的去离子水)喷施叶片,取喷洒后12 h的叶片,每3株一组,取三组重复。样品在液氮中速冻,-80℃下保存备用。
1.2 RNA提取和cDNA合成
称取叶片样本100 mg,充分研磨后利用EasyPure® Plant RNA Kit(ER301-01,TransGen Biotech)试剂盒提取总RNA;采用微量紫外分光光度计NanoDrop 2000 检测RNA 样品的浓度、OD260/OD280 以及OD260/OD230 值;取检测合格的RNA 样本进行cDNA 第一链合成,按照TransScript® One-Step gDNA Removal and cDNA Synthesis SuperMix(AT311-02,TransGen Biotech)试剂盒的操作方法进行;cDNA放置-20℃保存备用。
1.3 AarWRKY序列的筛选和鉴定
本研究基于课题组已有的艾转录组数据中的unigene 序列,采用ITAK[22]数据库(http://itak.feilab.net/)进行候选WRKY基因的预测。利用ORFfinder(https://www.ncbi.nlm.nih.gov/orffinder/)预测候选基因的包含起始密码子和终止密码子的完整的开放阅读框(Open Reading Frame,ORF),选取其中最长的ORF并使用标准密码子翻译表翻译成全长蛋白序列。然后,使用PFAM[23](http://pfam.xfam.org/)和WRKY 域(WRKY:PF03106)的隐马尔可夫模型(Hidden Markov Model,HMM)验证保守结构域并去除假阳性序列。
AarWRKY 蛋白的理化性质采用ExPASy ProtParam[24](http://cn. expasy. org/tools)进行分析。AarWRKY蛋白的亚细胞定位使用WoLF PSORT[25](http://www.genscript.com/psort/wolf_psort.html)预测。
1.4 AarWRKY 的分类、系统发育关系和保守结构域分析
基于艾中WRKY 蛋白的WRKY 保守结构域对AarWRKY进行分类。AarWRKY 的WRKY 结构 域 在Jalview 软件中进行可视化分析[26]。使用MEGA7[27]中的MUSCLE 和Neighbor-Joining 方法(参数设置:进化模 型 为Poisson model;Bootstrap 重 复=1000)构 建AarWRKY蛋白序列的系统发育树。利用在线保守基序预测网站MEME[28](https://meme-suite.org/meme/tools/meme)(motif参数设置为10)验证AarWRKY 蛋白的保守基序。利用TBtools[29]可视化分析AarWRKY 蛋白的系统发育树和保守基序。
1.5 表达模式分析与差异基因筛选
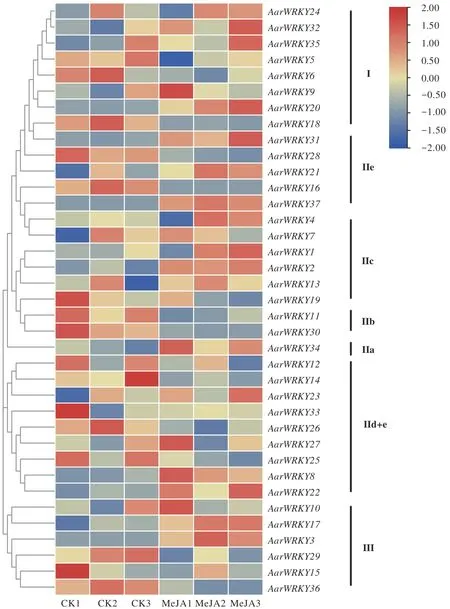
提取6个外源MeJA处理组(MeJA)和对照组(CK)下的叶片RNA-seq 数据中AarWRKY基因的表达量(Fragments Per Kilobase Million,FPKM)数据,经row scale 进行均一化处理,并运用TBtools 软件绘制热图,以系统发育关系进行聚类和差异表达分析。以MeJA组和CK 组的AarWRKY基因的表达量(FPKM)数据的差异倍数(fold change)≥2.0 为阈值筛选差异表达的AarWRKY基因。
1.6 实时荧光定量PCR
以Actin为内参基因[30],通过Primer Premier 5.0 软件分别设计差异表达基因AarWRKY3、16、18、20、30、37的实时荧光定量PCR(Quantitative Real-time PCR,qRT-PCR)引物(表1),并利用Primer-BLAST(http://ncbi.nlm.nih.gov./tools/primer-BLAST)进行引物序列特异性分析。引物由北京擎科新业生物技术有限公司合成。qRT-PCR 实验采用TransStart® Green qPCR SuperMix UDG(AQ111-01,TransGen Biotech)试剂盒,具体操作按说明书进行。qRT-PCR 体系为20 μl:2×TransStart TipTop Green qPCR SuperMix10.0 μl,正向引物(10 μM)0.30 μL,反向引物(10 μM)0.30 μL,cDNA 1.0 μL,ddH2O 8.4 μL,配制过程在冰上完成。PCR 扩增程序为:94℃预变性10 min;95℃、10 s,60℃、15 s,72℃、20 s,40 个循环;熔解曲线分析程序:95℃、15 s,60℃、1 min,95℃、15 s。每个样品设置3 个技术重复,并设阴性对照。
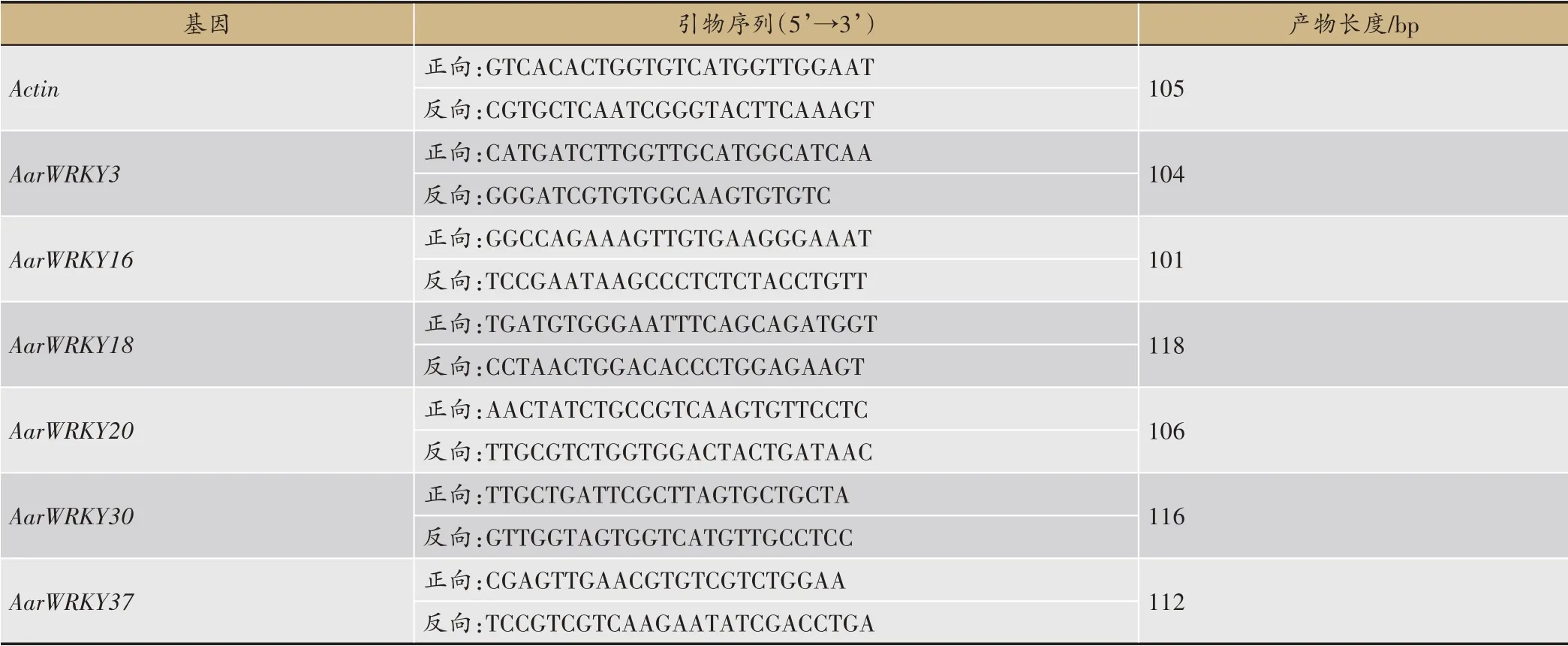
表1 qRT-PCR引物序列
1.7 基因蛋白功能和互作网络分析
基于拟南芥同源蛋白,我们使用STRING.4[31](https://string-db.org/)预测外源MeJA 处理下的差异表达AarWRKY 的同源蛋白和其相互作用网络。使用BLASTP 鉴定和确定AarWRKY 蛋白在Arabidopsis thaliana中的同源蛋白,选取比对的蛋白中e-value 值最小的蛋白作为AarWRKY 蛋白在Arabidopsis thaliana中的同源蛋白来构建蛋白相互作用网络。
2 结果与分析
2.1 艾AarWRKY转录因子鉴定和蛋白理化性质分析
本研究通过ITAK 数据库从艾叶的RNA-seq 数据中共预测获得69 个WRKY候选基因,选定候选基因的最长的完整的ORF,翻译出全长蛋白序列,通过HMM去除冗余和错误序列后,共鉴定出37 个WRKY 蛋白,将其重命名为AarWRKY1-AarWRKY37。AarWRKY蛋白的理化性质结果表明(表2),AarWRKY 基因编码的氨基酸长度为119-547 aa;蛋白分子量为13426.3-59781 Da;理论等电点(isoelectric point,PI)大小为4.86-10.03。在37 个AarWRKY 蛋白中,有6 个蛋白(AarWRKY2,AarWRKY3,AarWRKY10,AarWRKY16,AarWRKY32,AarWRKY37)为稳定蛋白(不稳定指数,Instability index <40),其余蛋白都是不稳定蛋白。所有AarWRKY 蛋白都是亲水性蛋白(平均亲水性,GRAVY <0)。脂肪族指数(Fatty coefficient)为43.5-74.8。蛋白质序列亚细胞定位预测结果表明,大多数的AarWRKY蛋白都可能定位于细胞核,仅有3个蛋白序列可能定位在细胞质或叶绿体中。

表2 艾叶AarWRKY蛋白的理化信息及特征
2.2 艾AarWRKY家族的WRKY保守结构分析与分类
本研究对已鉴定的艾中37个AarWRKY 蛋白的保守WRKY 结构域进行氨基酸序列比对分析(图1),结果发现大部分AarWRKY 蛋白中WRKY 的七肽序列和锌指序列非常保守,但也存在一些氨基酸残基的变异,如组IIc 中的AarWRKY19 的WRKY 七肽结构中的氨基酸残基被替换为“WRKYGKK”;组IId 中的AarWRKY12 和AarWRKY14 的WRKY 七肽结构中的氨基酸残基被替换为“WKKYGEK”。参照拟南芥的WRKY 家族分类原则,按照WRKY 保守结构域特征对AarWRKY 蛋白进行分类。34 个AarWRKY 蛋白分为Ⅰ,Ⅱ,Ⅲ三组,其中Ⅰ组有8 个成员,Ⅱ组有22 个成员,Ⅲ组有4个成员。Ⅱ组又进一步细分为Ⅱa(1个),Ⅱb(2 个),Ⅱc(6 个),Ⅱd(6 个)和Ⅱe(7 个)。但是AarWRKY3、AarWRKY17 和AarWRKY37 三个蛋白未能归类,氨基酸比对结果分类发现AarWRKY3 和AarWRKY17 属于组II,但无a、b、c、d、e 组的特征氨基酸残基;而AarWRKY37 只含有保守的“WRKYGQK”的七肽结构,锌指结构域缺失。

图1 AarWRKY蛋白保守结构域分析和家族分类
2.3 艾AarWRKY蛋白系统发育分析和保守基序分析
本研究进一步利用37个AarWRKY 的全长蛋白构建系统发育树,并通过MEME 分析蛋白的保守基序分布情况。根据AarWRKY 的全长蛋白系统发育树(图2A),同一亚家族的AarWRKY 蛋白序列基本被聚类到了一个分支或相近的分支上。如组I、组IIa、组IIc 和组III。但是,也有不同的亚家族成员聚类到同一分支上的现象,如IIc 的部分蛋白(AarWRKY4、AarWRKY7、AarWRKY37)和IIe 组的部分蛋白(AarWRKY16、AarWRKY21、AarWRKY28、AarWRKY31)与组I 聚集在一类中;剩余的IIc 蛋白(AarWRKY1、AarWRKY2、AarWRKY13、AarWRKY19)与IIa 和IIb 聚集在一起;IId 组则和剩余的IIe 组蛋白(AarWRKY23、AarWRKY27、AarWRKY33)聚在一个分支上。而未被分类的AarWRKY3 和AarWRKY17 与组III 具有C2HC 结构的WRKY 蛋白的亲缘关系更近,被分类到了组III 中;AarWRKY37 与组IIc 的成员聚到了一个分支上,它们的亲缘关系更近。
蛋白保守基序分析结果发现(图2B),保守基序表现出组间或者亚组间的特异性。其中motif1是WRKY七肽保守域到锌指结构的第一个半胱氨酸(Cysteine,C),motif2 是锌指结构的C-H-H(C)部分,motif1+motif2 的组合均存在于除AarWRKY37 之外的其他蛋白中,由于AarWRKY37 的WRKY 保守结构域仅包含保守的“WRKYGQK”的七肽结构,因此在MEME 的预测中,AarWRKY37 的蛋白序列没有发现motif1 和motif2。保守基序的特异性表现在:组I 中的AarWRKY 蛋白序列在N 段还含有保守的motif3 +motif10组合,这是组I的AarWRKY 蛋白特有的另一组WRKY 保守结构域;IIb 亚家族含有特有的motif9 基序;motif6 仅在IId 亚家族中被发现;motif5则主要分布在组III的蛋白序列中。

图2 艾AarWRKY蛋白的系统发育树和保守基序分布
2.4 外源MeJA 胁迫下AarWRKY 基因的表达模式分析和差异表达基因筛选
本研究基于外源MeJA 处理(MeJA)组和对照(CK)组 的RNA-seq 数据,分析外源MeJA 处理下AarWRKY家族基因的表达模式(图3)。基因表达热图的结果发现,在MeJA 的影响下,IIc 亚家族的WRKY基因几乎都上调;而IIb 亚家族的两个基因AarWRKY11和AarWRKY30的表达均下调。而其它亚家族的基因并没有体现上调或下调的整体性差异。我们以差异倍数(fold change)>2.0 为阈值筛选在MeJA 处理下上调和下调的差异表达基因,结果发现MeJA 处理下AarWRKY3(CK 表达量0)、AarWRKY20(MeJA 上调3.76倍)、AarWRKY37(CK 表达量0)三个基因为上调差异基因;AarWRKY16(MeJA 表达量0)、AarWRKY18(MeJA下调2.30 倍)、AarWRKY 30(MeJA 下调2.15 倍)三个基因为下调差异基因。进一步利用qRT-PCR 测定这6个差异表达基因的表达情况,结果表明(图4),6 个差异表达基因在MeJA 组和CK 组的趋势均与转录组数据一致,验证了转录组数据的准确性。因此,这6 个AarWRKY家族基因可能参与艾对外源MeJA 处理的应答。
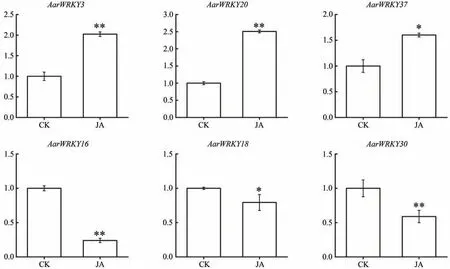
图4 外源MeJA处理后艾中AarWRKY差异表达基因的qRT-PCR分析
2.5 差异表达的AarWRKY蛋白的功能预测
为了进一步探究AarWRKY 差异基因在MeJA 处理下的调控作用,我们使用STRING 预测了这6 个AarWRKYs 在拟南芥中的同源蛋白(表3),并分析它们和MeJA 处理相关蛋白的相互作用网络(图5)。蛋白相互作用网络关系分析结果预测了2 个上调蛋白AarWRKY3(与拟南芥WRKY70 同源)和AarWRKY20(与拟南芥WRKY33同源)与JA 信号的受体蛋白JAZ1直接作用,也与JA信号调控网络中的重要调控转录因子MYC2 和酶COI1 有相互作用关系,且在JA 信号的胁迫下存在共表达关系。 此外,上调蛋白AarWRKY37(与拟南芥WRKY75 同源)和3 个下调蛋白 AarWRKY16( 与 拟 南 芥 WRKY3 同 源)、AarWRKY18(与拟南芥WRKY32 同源)、AarWRKY30(与拟南芥WRKY42 同源)虽然并没有被预测与JA 信号网络中的重要蛋白具有相互关系,但都可能与JA信号调控的其它蛋白存在相互作用关系。如丝裂原活化蛋白激酶3(MPK3)与JA 信号蛋白、AarWRKY3、AarWRKY20 和AarWRKY16 可能共同参与在植物激素刺激下的防御网络,但在该过程中AarWRKY3 的表达下调的,且与MPK3 的具体作用关系研究较少。AarWRKY30 和AarWRKY37 与磷酸盐调控网络和JA调控网络中的节点蛋白ZAT6 存在相互作用。此外AarWRKY37 还可能与乙烯反应蛋白EIN3 有相互关系。而以上的蛋白相互作用网络中,AarWRKY3 和AarWRKY20 都参与到了其中。AarWRKY18 可能参与光敏色素和开花时间调节蛋白(PFT1)相关的调控。

图5 外源MeJA处理后艾中差异表达AarWRKY蛋白的互作网络分析
注:CK:空白溶剂对照组;MeJA:外源MeJA处理组。

表3 MeJA处理下差异表达AarWRKY蛋白的拟南芥同源蛋白及其功能
3 讨论
艾是重要的药用植物和经济作物。目前国内艾的产品主要以艾叶、艾绒以及艾精油三种主要原材料为主,艾叶主要作为药材使用,艾绒被制备成各种艾灸产品[32],艾精油则在医疗保健、日化产品、农业等方面广泛运用[1]。目前,国内艾的整体产业规模已达到了上百亿[33]。因此,研究艾叶中活性成分的合成调控机制对提升其药用价值和经济价值有重要影响[34]。WRKY 家族是植物中最大的转录因子家族之一,主要在植物生长发育和响应逆境胁迫等重要生理过程中发挥作用。研究发现,玉米ZmWRKY40在拟南芥中过表达可增强其抗旱性[35];菊花DgWRKY4过表达能够增强其耐盐性[36]。这些研究都证实了WRKY 家族在植物应对胁迫方面发挥着重要的作用。除此之外,WRKY 家族的一些转录因子也被证实能够参与到长春花、黄花蒿、红豆杉、丹参和人参等药用植物的重要次生代谢产物的生物合成中[37]。因此,WRKY 家族基因可能在艾的抗逆及次生代谢产物累积中也发挥重要作用。
本研究基于艾的转录组数据,鉴定出37 个AarWRKY基因。然而艾的基因组尚未发表,本研究仅利用了艾的转录组数据对WRKY家族进行鉴定,可能有一部分AarWRKY基因未被发现,许多物种在基因组水平上鉴定出了更多的WRKY基因,例如:De Paolis等[38]在黄花蒿(Artemisia annua)的基因组数据中鉴定了122 个WRKY基因;马培杰等[39]在百脉根(Lotus corniculatus)的基因组数据中鉴定了79个WRKY基因。
根据WRKY 家族结构特点和系统进化分析,34个AarWRKY 蛋白被归类在I、II、Ⅲ组被证实的亚家族中。其中I组蛋白有8个,数量最多;II-a中蛋白仅有1个,数量最少。这与拟南芥[10]、葡萄[40]、菠萝[41]等植物中WRKY 亚家族的蛋白数量排序一致。此外,3 个AarWRKY 蛋 白 (AarWRKY3、 AarWRKY17、AarWRKY37) 未 能 分 类 ,其 中 AarWRKY3、AarWRKY17 具有完整的WRKY 保守结构域的的特征,未能分类的原因是其WRKY 保守结构域的的特征均不符合现有研究中亚家族的分类的特征;AarWRKY37 的蛋白序列仅有WRKY 的七肽序列,后续锌指结构和保守氨基酸的特征未知,因此未能分类。保守基序分析表明,AarWRKY 的WRKY 七肽结构和C2H2或C2HC的锌指结构中氨基酸相当保守,37个AarWRKY 蛋白中仅有AarWRKY12、AarWRKY14和AarWRKY19 三个蛋白的七肽结构发生了1 至2 个氨基酸的突变。此外,同一亚家族的也有相似的保守基序种类和数目,可能在功能上也更为相似。WRKY家族全长蛋白系统发育树分析发现同一亚家族的大部分成员被聚到一支上,但也有部分成员和别的亚家族蛋白聚到一个分支,表现出更近的进化关系。这可能是因为WRKY 家族的分类是基于保守结构域的数量和特点来划分的,而系统发育树的进化分析则是基于全长蛋白的序列比对完成的。据报道,在胡萝卜(Daucus carota)[42]、浮萍(Spirodela polyrhiza)[43]和甘草(Glycyrrhiza glabra)[44]等物种中也存在不同亚家族混合聚在同一进化分支的现象。越来越多的研究已经证明了WRKY 的亚家族具有多重起源,Zhu 等人[45]对小麦的研究表明IIc 亚家族起源于I 组的N 端WRKY域;Zhang和Wang[8]提出将WRKY基因家族分为四个进化枝,包括I+IIc组、IIa+b组、IId组和IIe组。本研究艾的WRKY 转录因子中也存在不同亚家族混合聚在同一进化分支的现象,因此为WRKY 的亚家族具有多重起源的假说也提供了新的依据。
茉莉酸是一类重要的植物激素,是植物对外界胁迫防御反应和次生代谢物积累的重要调节剂。Schluttenhofer 等[46]在拟南芥和长春花的WRKY转录因子研究中发现,在长春花中至少有25%的CrWRKY对JA有反应,其中75%的CrWRKY基因是已知的受JA调节的AtWRKY直系同源基因。本研究通过分析MeJA处理下AarWRKY的表达模式,寻找艾的WRKY家族中响应JA 的转录因子。在转录组数据热图分析结果中(图3),部分AarWRKY基因的重复性在三个重复差异较大,这可能是由以下两点造成的:①尽管我们已经尝试选择生长均匀的幼苗,但样本重复之间的个体差异仍然存在;②RNA-seq 文库构建过程中的技术错误导致。因此,我们使用FPKM 值的平均值来分析基因表达差异并利用qRT-PCR 对筛选出的差异基因的表达进行验证。基因的差异表达结果表明,外源MeJA诱导了艾的WRKY家族中一些基因的表达变化,其中有 3 个AarWRKY(AarWRKY3、AarWRKY20、AarWRKY37)的表达量上调了2 倍以上,而3 个AarWRKY(AarWRKY16、AarWRKY18、AarWRKY30)的表达量下调了2倍以上,共有6个基因(16%)在此阈值范围内对MeJA 有响应。qRT-PCR 结果也验证了转录组表达数据的准确性。这些结果表明这六个基因可能参与到JA的信号转导途径中。进一步,本研究利用拟南芥蛋白互作数据库分析这6个差异表达的AarWRKY基因的蛋白可能参与的调控网络,结果显示2 个上调基因AarWRKY3和AarWRKY20的蛋白可能直接与JA信号网络中的几个重要蛋白(如JAZ1、MYC2)存在相互作用关系,这两个蛋白的拟南芥同源蛋白也是目前研究较为深入的植物激素防御蛋白。其中,AtWRKY70 是SA 和JA 介导的植物对细菌病原体反应过程中信号的聚合节点[12,46];AtWRKY33 在灰葡萄孢(Botrytis cinerea)感染时同时靶向多个信号通路,直接与JA信号传导受体JAZ1和JAZ5的启动子结合[48]。此外 ,AarWRKY16、AarWRKY18、AarWRKY30 和AarWRKY37 等蛋白还可能通过与EIN3(ethyleneinsensitive3) 、 PFT1 (PHYTOCHROME AND FLOWERING TIME 1) 、 ZAT6 (Zinc-Finger Transcription Factor)等蛋白直接或者间接的相互作用参与到JA、乙烯、光、抗逆等过程的信号转导途径中[49-52]。JA 信号通路中的MYC2 蛋白是萜类次生代谢生物合成中重要的调控因子,它将JA信号整合到倍半萜合成酶基因的转录调控中并促进倍半萜的产生[53]。Alfieri等[54]在南欧丹参(Salvia sclarea)的毛状根中过表达拟南芥中的异源基因AtWRKY18、AtWRKY40和AtMYC2,发现了它们以协同作用的方式共激活萜类骨架合成中MEP 途径的合成酶基因,从而促进南欧丹参中松香烷二萜的积累。在本研究中,我们预测了在MeJA 处理下差异表达的AarWRKY 转录因子与MYC2蛋白可能有相互作用关系,说明在艾中,AarWRKY 蛋白也可能通过与MYC2 等JA 信号调控蛋白进行协同作用,参与到萜类的活性成分生物合成调控中。因此,我们能通过预测JA 等信号蛋白和WRKY 蛋白的相互作用,进一步探究AarWRKY 蛋白参与调控萜类生物合成的机制。因此,通过蛋白调控网络预测,我们发现这些差异表达的AarWRKY 蛋白可能通过与JA等信号蛋白相互作用参与萜类生物合成的调控,后续还需要对这些候选AarWRKY基因进行克隆和进一步体内外功能验证。
4 结语
综上所述,本研究从转录组水平首次系统对艾叶的WRKY基因进行鉴定,并对理化性质、保守结构域特点,家族分类等进行了系统分析。进一步,通过基因差异表达分析和qRT-PCR 验证筛选到6 个JA 信号响应的AarWRKY基因,并预测了这些基因与JA 信号调控蛋白协同作用参与萜类化合物的生物合成可能的调控网络,为后续研究中AarWRKY 蛋白的功能验证提供依据和方向。该研究为艾中WRKY家族基因的功能鉴定及其在响应外源MeJA 处理中的作用研究提供了一定的基础,也为阐明WRKY 转录因子在艾的挥发性萜类等有效成分的生物合成中的调控机制提供数据支撑。