乌拉尔甘草TIFY基因家族鉴定及调控分析*
秦振芬,孟祥霄,温 东,朱雪雯,王 艳,Botir Khaitov,Atia tul Wahab,孙 伟**
(1. 中国中医科学院中药研究所/中药鉴定与安全性评估北京市重点实验室 北京 100700;2. 中国医学科学院北京协和医学院药用植物研究所 北京 100193;3. 卡拉奇大学国际化学与生命科学研究院化学研究所卡拉奇 75270;4. 国际生物盐农业中心 塔什干 100084;5. 卡拉奇大学国际化学与生命科学研究院分子医学与药物研究所 卡拉奇 75270)
中药材甘草是指甘草属(Glycyrrhiza)多年生草本植物乌拉尔甘草(G. uralensisFisch.)、光果甘草(G.glabraL.)和胀果甘草(G. inflataBatalin.)的干燥根及根茎,性平味甘,归脾、胃、心、肺经,为临床常用药,具有补中益气、润肺止咳、清热解毒、缓急止痛、调和诸药之功。因其能调和百药、解百毒,故有“国老”之称[1]。我国是对甘草认识、研究最早的国家,甘草最早出现于《神农本草经》中,并被列为上品[2]。乌拉尔甘草主要活性成分包括甘草皂苷类、甘草黄酮类以及甘草多糖,常用于治疗多方面疾病如心脑血管疾病、炎症等[3]。其中甘草酸的含量是《中国药典》中衡量甘草药材品质优劣的主要指标。甘草酸具有抗癌、抗病毒、免疫调节等药理作用,还具有促肾上腺皮质激素样的作用,同时在临床上可作为消炎药使用[4]。因此深入研究甘草酸的转录调控机制,对于培育高质量植株,促进甘草酸生物合成及开发甘草酸类药物等具有重要意义。
三萜皂苷的生物合成首先通过氧化角鲨烯环化酶(OSCs)将共同前体2,3-氧化角鲨烯环化成各种各样的三萜骨架模式。这些三萜骨架在细胞色素P450单加氧酶(P450)的催化下进行位点特异性氧化,形成不同的三萜苷元或非糖基化形式。甘草酸苷是齐墩烷型三萜皂苷,来源于β-香树脂醇,近年来,随着对甘草酸代谢途径研究的不断深入,其生物合成酶包括P450酶、UGT 合成酶和细胞合成酶介导的葡萄糖醛酸基转移酶大多已被鉴定[5],同时,研究人员已在酵母中成功合成了甘草酸的前体物质甘草次酸[6](图1)。相较乌拉尔甘草药效成分的合成途径解析,转录调控研究相对较少,如bHLH 类转录因子GubHLH3 可以调控乌拉尔甘草中大豆皂苷的合成[7],因此需要我们更深入研究乌拉尔甘草药效成分的转录调控机制。
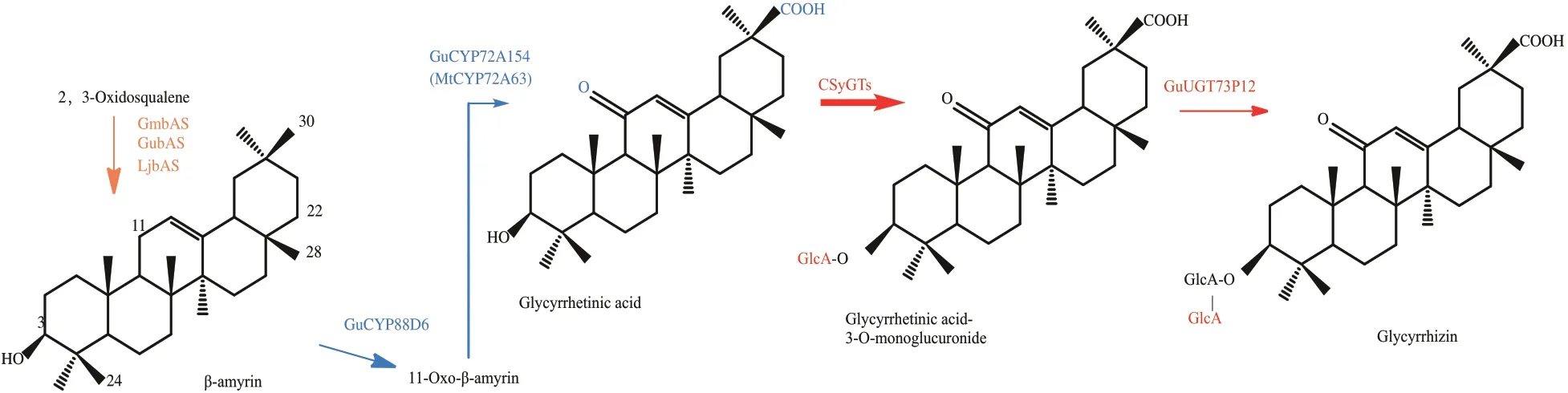
图1 甘草酸的代谢途径
TIFY 家族基因是近年发现的能增强植物抗逆性的新基因。TIFY 蛋白是植物中一类特异性转录因子,最初在拟南芥中鉴定出来,属于植物特异的GATA 转录因子家族,TIFY 家族的特征是一个高度保守的基序(TIF[F/Y]XG),所以被命名为TIFY 基因家族[8]。通过系统发育和结构分析,该家族的基因可分为:TIFY、JAZ、ZML 和PPD[9]。其中,最典型的成员是JAZ 基因,是植物特异性基因家族的成员,在JA通路中发挥着关键作用[10]。茉莉酸类化合物广泛存在于植物体内,是一种植物内源激素,在植物各个生长阶段以及抵抗逆境过程中均起到重要作用[11]。Nishii 等从拟南芥中鉴定出首个TIFY 基因,随后TIFY 基因家族陆续在水稻、大麻、人参、铁皮石斛、杜仲等中被鉴定出来[12-16]。近期研究表明,TIFY 基因家族参与众多生物学过程,例如拟南芥中过表达AtTIFY1(ZIM)基因导致叶柄和下胚轴加长[17]、AtTIFY4a(PPD1)和AtTIFY4b(PPD2)基因有助于拟南芥叶片同步生长[18];Wang Y[19]在木本模式植物毛果杨中发现,TIFY 基因可积极响应干旱、盐分、极端温度等非生物胁迫;Chini A[20]在番茄中发现,TIFY 基因对盐胁迫,渗透胁迫和ABA 处理都有反应;在药用活性成分长春花碱的代谢调控研究中显示,缺少茉莉酸甲酯刺激下JAZ 蛋白可以有效地抑制CrMYC2和BIS1表达从而控制长春花碱的合成[21];在药用植物丹参中JAZ3 蛋白可以和SmWD40-170 转录因子蛋白形成复合体,从而阻碍其正向调控丹参酮合成的作用[22]。
由此可见,TIFY 蛋白在植物生长发育、代谢物质调控上具有重要作用,因此本研究在已有的乌拉尔甘草全基因组的基础上,采用生物信息学方法对乌拉尔甘草TIFY 基因家族的序列特征、分类、系统发育和基因的组织差异表达进行可视化分析,为研究TIFY基因家族成员参与甘草酸代谢调控提供数据支持,为甘草的优良品种选育等工作提供参考。
1 材料
乌拉尔甘草的全基因组数据和相关注释在http://ngs-data-archive.psc.riken.jp/Gur-genome/download.pl网站获取,其品种为308-19 品系乌拉尔甘草[23]。拟南芥TIFY 基因家族蛋白数据下载自TAIR 网站(http://www.arabidopsis.org/browse/genefamily/index.jsp)。
2 方法
2.1 乌拉尔甘草GurTIFY基因家族鉴定
乌拉尔甘草全部蛋白序列通过TBtools 软件进行分析提取,与拟南芥TIFY基因家族蛋白序列进行blast比对,获得候选乌拉尔甘草TIFY 基因序列,用TBtools去除重复,然后包含TIFY 结构域(PF06200)的蛋白通过HMMERsearch 获得,其他数据删除,确定乌拉尔甘草中的TIFY 基因家族成员。利用ExPASy 网站(http://web.expasy.org/protparam/)对乌拉尔甘草TIFY等电点、蛋白分子量等理化性质进行分析。亚细胞定位通过WoLFPSORT 网站(http://www.genscript.com/wolfpsort.html)进行分析。
2.2 乌拉尔甘草GurTIFY基因家族系统进化分析
使用MEGA7软件对拟南芥和乌拉尔甘草的TIFY蛋白进行多序列比对,使用邻接法(Neighbor-Joining,NJ)构建系统发育树(bootstrap 重复次数为1000),并用iTOL(http://itol.embl.de/)网站对进化树进行美化,根据系统发育树对乌拉尔甘草GurTIFY基因亚家族分类。
2.3 乌拉尔甘草GurTIFY 基因保守基序及基因结构分析
通 过MEME(https://meme-suite. org/meme/)对GurTIFY的蛋白保守基序进行预测(motif 参数设为10),使用CDD 数据库(https://www.ncbi.nlm.nih.gov/cdd)对GurTIFY的蛋白结构域进行预测。将蛋白保守基序、保守结构域和其系统进化树使用TBtools软件整合及可视化作图。
2.4 乌拉尔甘草GurTIFY基因顺式作用元件预测
通过基因组序列和结构注释文件分别提取18 个GurTIFY基因上游各2Kb 序列作为启动子区域。然后对启动子区的顺式作用元件的预测通过PlantCare(https://www.plantcare.co.uk/)进行,通过TBtools 软件进行可视化作图。
2.5 乌拉尔甘草GurTIFY基因差异表达分析
采用两年生乌拉尔甘草根和叶的转录组数据,使用STAR(version 2.7.3)软件进行转录组数据比对,使用RSEM(version 1.33)软件计算各样品的表达量FPKM 值。使用DEseq2(version 1.22.2)软 件 计 算GurTIFY在不同组织中差异表达情况。最终使用乌拉尔甘草GurTIFY在不同组织的FPKM 值,绘制TIFY 基因表达水平的柱形图。转录组原始数据为已上传至国家基因组科学数据中心(https://ngdc.cncb.ac.cn/),GSA编号:CRA005924。
筛选表达量较高,且不同组织间具有显著差异的基因进行实时荧光定量PCR(qRT-PCR)分析,使用华越洋试剂盒(0416-50)提取样品RNA,全式金试剂盒(AT311-02)反转录合成cDNA,采用启衡星试剂盒(FS-Q1002)进 行qRT-PCR 反应,内参基因为βtubulin,使用NCBI 设计引物(表1),qRT-PCR 反应体系:cDNA 模板1 μL,上下游引物各0.4 μL、SYBR qPCR Ready Mix 荧光染料10 μL,ddH2O 8.2 μL。反应程序:95℃预变性3 min;95℃变性30 s,56℃退火20 s,72℃延伸20 s,40 次循环。每个样品设3 次生物学重复,采用2-ΔΔCT法分析基因表达量。
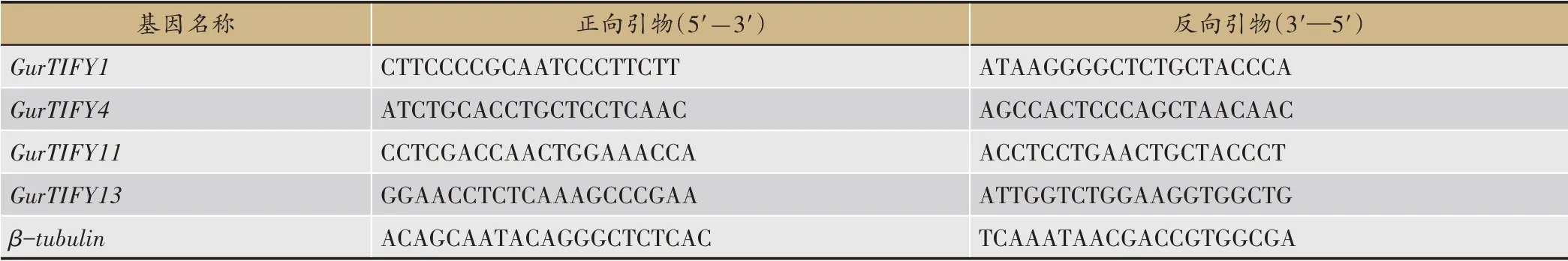
表1 乌拉尔甘草GurTIFY基因qRT-PCR引物序列
3 结果与分析
3.1 乌拉尔甘草GurTIFY基因家族成员的鉴定
通过AtTIFY的blastn 同源比对,在乌拉尔甘草中共得到37 条候选序列,去除重复并确认结构域(PF06200)后 得 到GurTIFY成 员18 个,命 名 为GurTIFY1-GurTIFY18,核苷酸长度在444-1266 bp 之间,氨基酸长度在147-421 aa 之间,蛋白分子量大小在16741.11-44426.5 Da 之间,等电点介于4.57-9.68之间,与此前已发表的拟南芥,大麻等的TIFY 基因家族相近(表2)。

表2 乌拉尔甘草TIFY基因家族基本信息
3.2 乌拉尔甘草GurTIFY 基因的蛋白多重序列分析和系统进化分析
为了解乌拉尔甘草和拟南芥TIFY 基因家族的进化关系,乌拉尔甘草和拟南芥TIFY 基因共37 个,根据拟南芥TIFY 家族分类方法[24]被分为4 个亚类(图2)。乌拉尔甘草18 个TIFY 基因中,JAZ 亚家族基因10 个,将JAZ亚家族分为3个亚组,Ⅰ组有GurTIFY8,Ⅱ组由GurTIFY4、GurTIFY17、GurTIFY18组 成,Ⅲ组 由GurTIFY1、 GurTIFY2、 GurTIFY10、 GurTIFY11、GurTIFY13、GurTIFY15组成;ZML亚家族基因5个分别为GurTIFY12、GurTIFY6、GurTIFY16、GurTIFY9、GurTIFY7;TIFY 亚家族基因2 个分别为GurTIFY5和GurTIFY3以及PPD 亚家族基因1 个为GurTIFY14,每个亚家族的结构域特点与拟南芥一致。

图2 乌拉尔甘草(红色字体)和拟南芥(黑色字体)TIFY转录因子系统发育树
3.3 乌拉尔甘草GurTIFY 基因保守基序及基因结构分析
将乌拉尔甘草TIFY蛋白保守基序、保守结构域和其系统进化树使用TBtools 软件进行结合并做可视化作图分析。结果显示,乌拉尔甘草的18 个TIFY 基因中含有10 个保守基序和4 个保守结构域,18 个GurTIFY中 均 含 有 TIFY 结 构 域,GurTIFY9、GurTIFY16、GurTIFY7、GurTIFY6、GurTIFY12含有CCT和GATA 结构域,除GurTIFY9、GurTIFY16、GurTIFY7、GurTIFY6、GurTIFY12、GurTIFY3、GurTIFY5外均含有Jas结构域(图3)。

图3 乌拉尔甘草TIFY家族功能结构域
为进一步分析甘草GurTIFY基因之间的进化关系,利用TBtools 软件构建了乌拉尔甘草GurTIFY的基因结构图。结果显示,乌拉尔甘草的18 个GurTIFY中内含子的数量为2-9 个(图4),其中GurTIFY9和GurTIFY16所含内含子数量最多为9 个,GurTIFY14含有2 个内含子,数目最少,其余成员中GurTIFY1、GurTIFY2、GurTIFY11、GurTIFY13、GurTIFY15含内含子4 个,GurTIFY4、GurTIFY6、GurTIFY12、GurTIFY17、GurTIFY18含内含子6 个,GurTIFY3和GurTIFY5含内含子5 个,GurTIFY10、GurTIFY7和GurTIFY8内含子数量分别为3、7、8个。

图4 乌拉尔甘草GurTIFY基因的基因结构
3.4 乌拉尔甘草GurTIFY基因顺式作用元件预测
顺式元件对基因表达具有重要的调控作用,乌拉尔甘草TIFY 基因家族成员的顺式作用元件预测和可视化分析结果表明(图5),GurTIFY中每个成员的启动子区都含有众多顺式元件,如光响应元件,脱落酸响应元件,干旱诱导元件等。光响应元件数量最多为274 个,分布在每个成员中,其次为脱落酸响应元件数量为68个。另外,乌拉尔甘草抗逆性和抗干旱的茉莉酸甲酯和干旱响应元件也在大多数乌拉尔甘草TIFY基因的启动子上存在。表明乌拉尔甘草TIFY 不同成员能够广泛且差异性的参与乌拉尔甘草生长发育及非生物胁迫等多种生物过程的响应。

图5 乌拉尔甘草GurTIFY基因的启动子区顺式作用元件
3.5 乌拉尔甘草GurTIFY基因差异表达分析
为了探究GurTIFY在乌拉尔甘草不同组织中的表达模式,对两年生乌拉尔甘草根和叶的转录组数据进行分析,结果表明(图6),GurTIFY15、GurTIFY4、GurTIFY1、 GurTIFY11、 GurTIFY5、 GurTIFY13、GurTIFY8、GurTIFY16、GurTIFY14在乌拉尔甘草叶和根中的表达水平具有显著差异性。GurTIFY15、GurTIFY4在各个组织表达量都相对较高,而GurTIFY16、GurTIFY3和GurTIFY14在各个组织几乎不表达。且GurTIFY15、GurTIFY4、GurTIFY1、GurTIFY11、GurTIFY13在叶中的表达远远高于在根中的表达。在所有成员中GurTIFY15在叶表达量最高,GurTIFY2 在根表达量最高。以上在根和叶中表达量较高的基因大多为JAZ 亚家族的成员,表明乌拉尔甘草的GurTIFY基因家族成员中的JAZ 亚家族可能参与了不同组织器官的调控。筛选表达量较高,且组织间具有显著差异的GurTIFY1、GurTIFY4、GurTIFY11、GurTIFY13四个基因进行qRT-PCR 验证,结果显示(图7),在相同组织中四个基因的qRT-PCR 相对表达趋势与转录组结果相似,相同基因在不同组织间的qRT-PCR表达差异与转录组分析结果相一致。

图6 乌拉尔甘草不同组织中GurTIFY基因的差异表达分析

图7 qRT-PCR验证乌拉尔甘草GurTIFY基因表达
4 讨论
乌拉尔甘草是重要的中药材,有着丰富的药用功能,但跟其他中药材一样,乌拉尔甘草种植区域仍有许多制约因素,如盐害、干旱和碱性土壤等,严重影响乌拉尔甘草的产量和质量,此外,由于全球变暖和适宜种植的土地面积减少,迫切需要进行甘草抗逆品种选育,并改善甘草育种的重要性状和品质[25],因此,有必要对甘草的发育及其对环境因素的响应进行深入研究。TIFY 家族基因是近年发现的能增强植物抗逆性的新基因。TIFY 基因参与调控多种次生代谢产物的生物合成,但在中药植物中报道较少。
本研究在全基因组的水平上共鉴定出18 个乌拉尔甘草TIFY 基因,全部分布于细胞核中。基于CCT、Jas、GATA、TIFY4 种保守结构域,将乌拉尔甘草的TIFY 基因家族划分为TIFY、JAZ、PPD、ZML 四个亚家族。其中JAZ 亚家族基因占比最多。近年来,人们对JAZ 蛋白进行了深入研究,主要是因为它们在植物发育和针对生物和非生物胁迫的防御反应等许多方面起到了作用。茉莉酸作为重要的植物激素,在植物生长、繁殖和抗逆等诸多方面起重要的作用。茉莉酸途径的抑制因子JAZ(Jasmonate ZIM-domain, JAZ)蛋白(JAZs)是调节茉莉酸(JA)激素应答的关键因子,在茉莉酸(JA)信号传导中,JAZ 蛋白通过与转录因子MYC2 结合来调节JA 下游基因的表达,其在广阔的激素调节网络中起中心枢纽的作用[26-27]。Li[22]在实验中发现丹参TIFY家族中属于JAZ亚家族的SmJAZ3蛋白在JA信号通路中与SmWD40-170相互作用,并在次级代谢产物的积累中发挥重要作用。因此,推测JAZ 基因在乌拉尔甘草生长发育的调控过程发挥了重要的作用,是增强乌拉尔甘草抗逆性的主要基因之一。
顺式作用元件分析表明,在乌拉尔甘草的TIFY基因启动区中光响应元件和激素诱导类元件数量较多,表明该基因与乌拉尔甘草的生长发育密切相关,环境和激素可影响其表达。此外,在乌拉尔甘草TIFY基因启动子中均预测到大量不同功能的顺式作用元件,表明TIFY 基因可能参与了乌拉尔甘草的生长和发育的许多过程。根据差异表达分析,乌拉尔甘草TIFY基因对乌拉尔甘草根和叶器官的生长发育发挥一定的作用,其中GurTIFY15、GurTIFY4、GurTIFY1、GurTIFY11、GurTIFY5、 GurTIFY13、 GurTIFY8、 GurTIFY16、GurTIFY14在乌拉尔甘草叶和根中的表达水平具有显著差异性,属于JAZ 亚家族的GurTIFY15、GurTIFY4、GurTIFY1、GurTIFY2和GurTIFY11中叶的表达量较高,而有研究表明拟南芥TIFY 的JAZ 亚家族一些成员基因参与叶片的生长调控[9]。拟南芥PPD 亚家族成员对叶片形态具有调节作用[18],AtTIFY1(ZIM)可以促进叶柄和下胚轴的延伸[17],与赤霉素和油菜素类固醇无关[28]。丹参TIFY 基因家族在不同组织差异表达分析结果得知TIFY 家族整体在叶中的表达较高且其大部分属于JAZ亚家族[22]。因此,推测GurTIFY在叶的生长发育调控中起到了重要的作用,起调控作用的可能就是JAZ亚家族。
TIFY 基因家族是一个植物特有的基因家族,现已在大部分陆生植物中检测到了TIFY 基因家族[29-30],目前在一些中药中也已经有所研究报道,然而该家族在乌拉尔甘草中的表达和功能分析却很少。对GurTIFY的研究可以为抗逆性遗传改良提供理论基础,扩大乌拉尔甘草种植范围,提高其产量。本研究为进一步探究乌拉尔甘草TIFY 基因家族功能和乌拉尔甘草转录调控研究以及利用该基因家族改良乌拉尔甘草抗逆性奠定了基础。