刺桐叶多糖的酶解提取工艺及生物活性研究
刘保山,梁思琪,肖 强
(1.生物资源保护与利用湖北省重点实验室,湖北 恩施 445000;2.湖北民族大学 林学园艺学院,湖北 恩施 445000)
刺桐(ErythrinavariegataL.)是豆科(Leguminosae)刺桐属(Erythrina)植物,常为灌木或小乔木,原产自印度至大洋洲海岸林中,目前在中国台湾、福建等地都有所分布[1],其树皮或根皮可以入药,称为海桐皮,具有镇静[2]、平喘[3]等功效.多糖是一种广泛存在的大分子化合物,具有抗炎[4]、抗肿瘤[5]、抗氧化[6]等功效.目前对刺桐中化学成分研究主要见于黄酮类化合物的分离和药理作用以及生物碱的提取和活性研究[7],但对刺桐叶片多糖的提取、结构分析和活性研究鲜有报道.
本研究采用纤维素酶酶解法对刺桐叶片多糖进行提取,在单因素实验的基础上采用响应面分析法对其提取工艺进行优化;进一步通过红外光谱分析其结构,使用柱前衍生高效液相色谱法测定其单糖组成;最后测定其体外抗氧化活性以及对癌细胞的增殖抑制活性;以期为刺桐多糖潜在利用价值的开发提供理论指导.
1 材料与方法
1.1 材料与试剂
刺桐采摘于湖北民族大学植物园,经湖北民族大学林学园艺学院易咏梅教授鉴定;健康、无病虫害的刺桐叶片用清水冲洗干净,50 ℃热泵式烘箱中烘干、粉碎后过40目筛,干燥器储藏备用.
纤维素酶(≥400 U/mg,福州飞净生物科技有限公司);单糖标准品(上海源叶生物科技有限公司);乙酸铵(色谱级,阿拉丁);苯酚(分析纯,阿拉丁);无水乙醇(分析纯,武汉市中天化工有限公司);胎牛血清(HB25FA0001,生工生物);DMEM培养基(AG29714106,Cytiva);青霉素-链霉素溶液(源叶生物);CCK-8试剂盒(MA0218-500T,大连美仑生物技术有限公司);PBS(Cytiva,AF29561133);水为纯净水.
1.2 仪器与设备
低速台式离心机(H2050R,湖南湘仪实验室仪器开发有限公司);紫外-可见光光度计(TU-1901,北京普析通用仪器有限责任公司);冷冻干燥机(ALPHA1-2LD,德国CHhrist公司);超净工作台(JJ-CJ-1FD,苏州市金净净化设备科技有限公司);BX50荧光倒置显微镜(Olympus公司);U3000高效液相色谱仪(美国赛默飞世尔科技公司);iS50傅里叶红外光谱仪;二氧化碳细胞培养箱(Thermo公司).
1.3 实验方法
1.3.1 刺桐叶片多糖提取工艺 称取刺桐叶片粉末0.5 g,放置于试管中,按照料液比1∶20的比例加入纯净水10 mL,加入不同用量的酶后,再加入不同酶解pH的PBS缓冲溶液,于不同温度下酶解不同时间,转移至90 ℃水浴锅中灭活5 min后迅速抽滤,滤液加入4倍体积的无水乙醇,放置于4 ℃冰箱中进行醇沉过夜.将溶液转移至离心管中,于8 000 r/min、4 ℃下离心10 min,去上清液,沉淀加入热纯水复溶,采用硫酸苯酚法进行多糖含量的测定[8],根据式(1)计算刺桐多糖提取率.将复溶的多糖溶液进行冷冻干燥,复溶为1 mg/mL的多糖溶液,利用Sevage试剂进行除蛋白操作,除至无明显蛋白沉淀后冷冻干燥得粗多糖粉末,后续实验均使用本方法所制多糖进行.Y1=(mi/mj)×100%.
(1)
式(1)中:Y1代表多糖提取率,单位为%;mi、mj分别代表复溶后多糖质量、原料质量.
1.3.2 单因素实验 ① 酶解pH:酶解pH分别为4、5、6、7、8,酶用量为1.5%,酶解温度为40 ℃,酶解时间为60 min,按照1.3.1方法计算刺桐多糖的提取率,探究酶解pH对刺桐多糖提取率的影响.② 酶用量:酶用量分别为3.0%、3.5%、4.0%、4.5%、5.0%,酶解pH为7,酶解温度为40 ℃,酶解时间为60 min,按照1.3.1方法计算刺桐多糖的提取率,探究酶用量对刺桐多糖提取率的影响.③ 酶解时间:酶解时间分别为30、60、90、120、150 min,酶解pH为7,酶解温度为40 ℃,酶用量为4.5%,按照1.3.1方法计算刺桐多糖的提取率,探究酶解时间对刺桐多糖提取率的影响.④ 酶解温度:酶解温度分别为30、40、50、60、70 ℃,酶解pH为7,酶解时间为90 min,酶用量为4.5%,按照1.3.1方法计算刺桐多糖的提取率,探究酶解温度对刺桐多糖提取率的影响.
1.3.3 响应面实验 结合单因素实验的结果,以酶用量(A)、酶解pH(B)、酶解温度(C)及酶解时间(D)4个因素为自变量,以刺桐多糖提取率为响应值,采用Box-Behnken实验原理设计4因素3水平响应面优化实验.
1.3.4 刺桐叶片多糖的红外光谱分析 称取多糖样品1~2 mg至玛瑙研钵中,加入干燥的KBr粉末150 mg充分研磨后压制成透明薄片进行红外光谱仪扫描;光谱扫描范围4 000~400 cm-1,扫描时扣除H2O和CO2的背景,分辨率设置为4 cm-1,共进行64次扫描,红外光谱根据文献[9]进行分析.
1.3.5 刺桐叶片多糖的单糖组成分析 ① HPLC色谱条件.Diamonsil plus C18色谱柱(250 mm×4.6 mm,5 μm);流动相为乙腈(A)-50 mmol/L乙酸铵溶液(B);梯度洗脱:0~60min 15%~25%A,85%~75%B;体积流量1.0 mL/min;柱温30 ℃;检测波长250 nm;进样量10 μL.② 样品酸水解溶液的制备.多糖的水解与衍生[10]:精密称取多糖粉末20 mg,置于5 mL安培瓶中,加入1 mol/L盐酸1.5 mL,封口后置110 ℃条件下水解4 h,冷却至室温,用3 mol/L NaOH调节至中性.取100 μL酸解样品于试管中,加入100 μL 0.6 mol/L NaOH和200 μL 0.5 mol/L 1-苯基-3-甲基-5-吡唑啉酮 (1-phenyl-3-methyl-5-pyrazolone,PMP)-甲醇溶液,70 ℃水浴条件下反应30 min,放冷后加入100 μL 0.6 mol/L盐酸中和后定容至2 mL;加入等体积三氯甲烷混匀10 min后离心5 min(10 000 r/min),去掉三氯甲烷层,重复上述操作3次,过0.22 μm微孔膜进行高效液相色谱(high performance liquid chromatography,HPLC)分析.③ 标准品溶液的制备.取半乳糖、阿拉伯糖、葡萄糖、半乳糖醛酸、岩藻糖、葡萄糖醛酸、鼠李糖、甘露糖、D-果糖储备液各0.5 mL,定容至10 mL后,按照前述样品方法制备衍生标准品.
1.3.6 体外抗氧化活性的测定 ① DPPH自由基清除能力测定.配制不同质量浓度(1、2、3、4、5 mg/mL)的多糖溶液,取上述溶液2 mL,分别加入0.4 mmol/L 1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)-乙醇溶液2 mL,混匀后静置30 min,在517 nm处测吸光度值,以蒸馏水作空白组,Vc作阳性对照,按照式(2)计算DPPH自由基的清除率.Y2=[1-(Ai-Aj)/Ak]×100%.
(2)
式(2)中:Y2表示DPPH自由基清除率;Ai、Aj和Ak分别表示加入多糖、空白和对照实验下的吸光度值.② 羟自由基清除能力的测定.配制不同质量浓度(1、2、3、4、5 mg/mL)的多糖溶液,取上述溶液2 mL,分别加入6 mmol/L硫酸亚铁、6 mmol/L水杨酸-乙醇溶液各1 mL,加入1 mL 1%过氧化氢后于37 ℃下反应30 min,于510 nm处测定吸光度值,用蒸馏水代替过氧化氢,空白对照用蒸馏水代替样品溶液,按照式(3)计算羟自由基的清除率.Y3=[1-(Ai-Aj)/Ak]×100%.
(3)
式(3)中:Y3表示羟自由基清除率.
1.3.7 刺桐叶片多糖抗肿瘤活性测定 ① 细胞培养.HSC-3和HCCLM-3细胞株系由风湿性疾病发生与干预湖北省重点实验室提供,培养于10%胎牛血清、1%青霉素-链霉素双抗的DMEM培养液中,培养瓶为T25塑料培养瓶,待细胞长至80%~90%时进行传代、铺板、冻存等操作.② 细胞增殖抑制率的测定.取对数生长期的细胞进行铺板,利用细胞计数板进行计数,每个96孔板内细胞数量为1×105个左右,24 h后采用对半稀释法进行药物浓度控制,24 h后按照CCK-8试剂盒操作说明进行增殖抑制率测定,按照式(4)计算增殖抑制率.Y4=[(Ac-As)/(Ac-Ab)]×100%.
(4)
式(4)中:Y4表示增殖抑制率;As、Ac和Ab分别代表实验孔(含有细胞的培养基、CCK-8和待测药物)的吸光度、对照孔(含有细胞的培养基、CCK-8、没有待测药物)的吸光度和空白孔(不含细胞和待测药物的培养基、CCK-8)的吸光度.
2 结果与分析
2.1 单因素实验结果
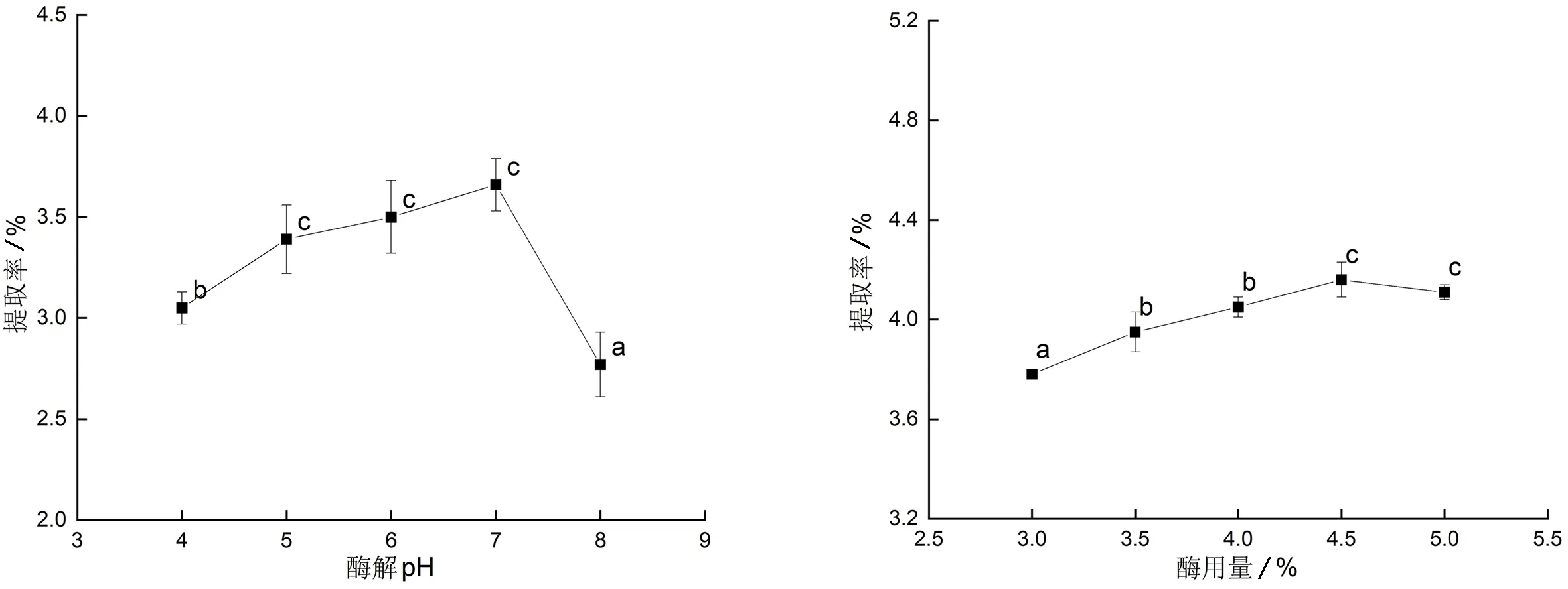
2.1.1 酶解pH对刺桐叶片多糖提取率的影响 酶解pH对刺桐叶片多糖提取率的影响如图1所示.由图1可知,提取率随酶解pH的增加而提高,但在pH为5、6、7之间并无显著性差异,在pH为7时达到最高,而pH为7和8之间存在着显著性差异.因此,将之后因素的酶解pH均固定为7,同时将其设定为响应面实验中pH的中间水平值.
2.1.2 酶用量对刺桐叶片多糖提取率的影响 酶用量对刺桐叶片多糖提取率的影响如图2所示.由图2可知,刺桐多糖提取率随酶用量的增加而提高,在酶用量为4.5%时达到最大值.因此,将之后因素的酶用量固定为4.5%,同时将其设定为响应面实验中酶用量的中间水平值.
2.1.3 酶解时间对刺桐叶片多糖提取率的影响 酶解时间对刺桐叶片多糖提取率的影响如图3所示.由图3可知,提取率随酶解时间的延长而提高,在酶解时间为90 min时达到最高,酶解时间为90~120 min存在着显著性差异.因此,将之后因素的酶解时间固定为90 min,同时将其设定为响应面实验中酶解时间的中间水平值.
2.1.4 酶解温度对刺桐叶片多糖提取率的影响 酶解温度对刺桐叶片多糖提取率的影响如图4所示.由图4可知,刺桐多糖提取率随酶解温度的增加而提高,在酶解温度为50 ℃时达到最大值,因此,将之后因素的酶解温度固定为50 ℃,同时将其设定为响应面实验中酶解温度的中间水平值.

图3 酶解时间对刺桐叶片多糖提取率的影响 图4 酶解温度对刺桐叶片多糖提取率的影响
2.2 响应面优化刺桐叶片多糖提取工艺
2.2.1 响应面分析与结果 根据单因素实验的结果进行响应面条件的确定,以酶解pH、酶用量(%)、酶解时间(min)和酶解温度(℃)4个因素为自变量(分别以A、B、C、D表示),以刺桐叶片多糖提取率(%)为响应面值设计了响应面实验,实验结果如表1所示.
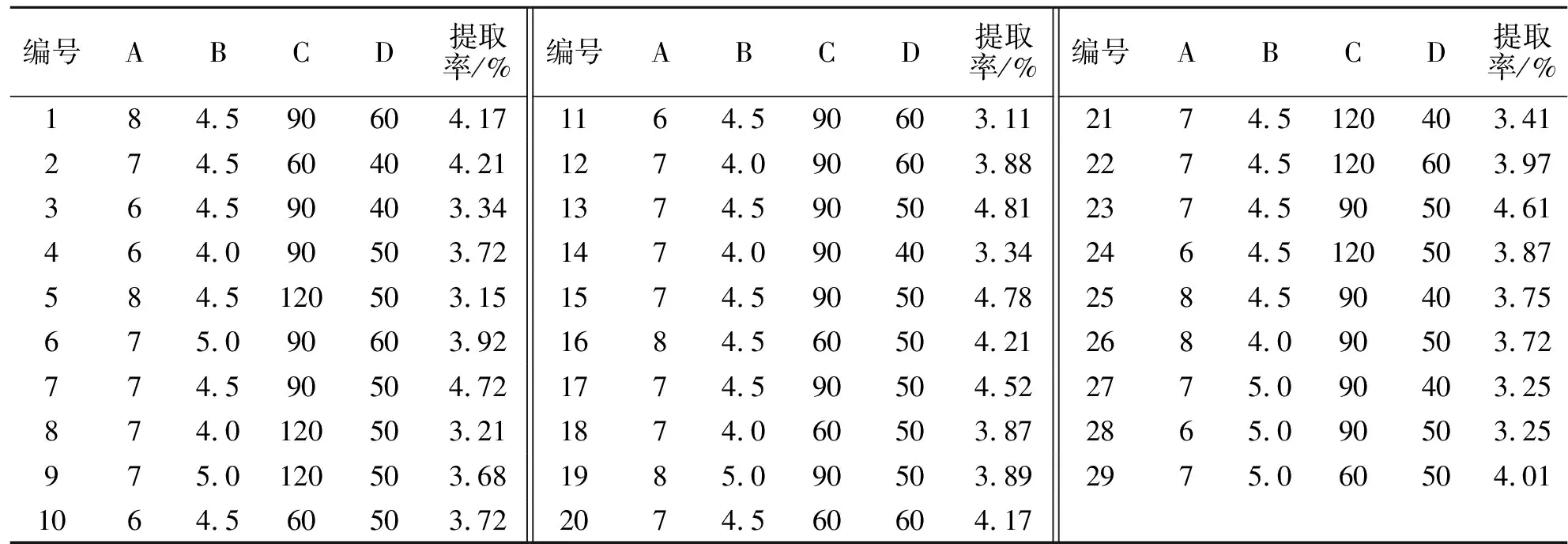
表1 响应面分析实验方案及实验结果Tab.1 Design and testing results of RSM
通过软件Design-Expert 12对响应面结果进行分析,其二次回归方程以及回归方程各项的方差分析结果如表2所示.
从方差分析表可以看出回归方程的F值为8.14,P<0.01,极显著,且失拟项为0.070 8,不显著,说明利用响应面法拟合得到的实验模型极显著,该模型可以用来评估刺桐叶片多糖提取的结果.4个因素对提取得率的影响大小顺序为酶解时间>酶解温度>酶解pH>酶用量.通过对条件和结果进行拟合,得到二次拟合方程如下:
Y=4.69+0.156 7A+0.021 7B-0.241 7C+0.16D+0.16AB-0.302 5AC+0.162 5AD+
0.082 5BC+0.032 5BD+0.15CD-0.557 3A2-0.577 3B2-0.359 8C2-0.479 8D2.
通过软件确定了响应面法预测的回归模型,在预测栏可以得出软件预测结果,预测最佳提取工艺为:酶解pH 7.2,酶用量4.5%,酶解时间77.4 min,酶解温度51.5 ℃,预测提取得率为4.77%.
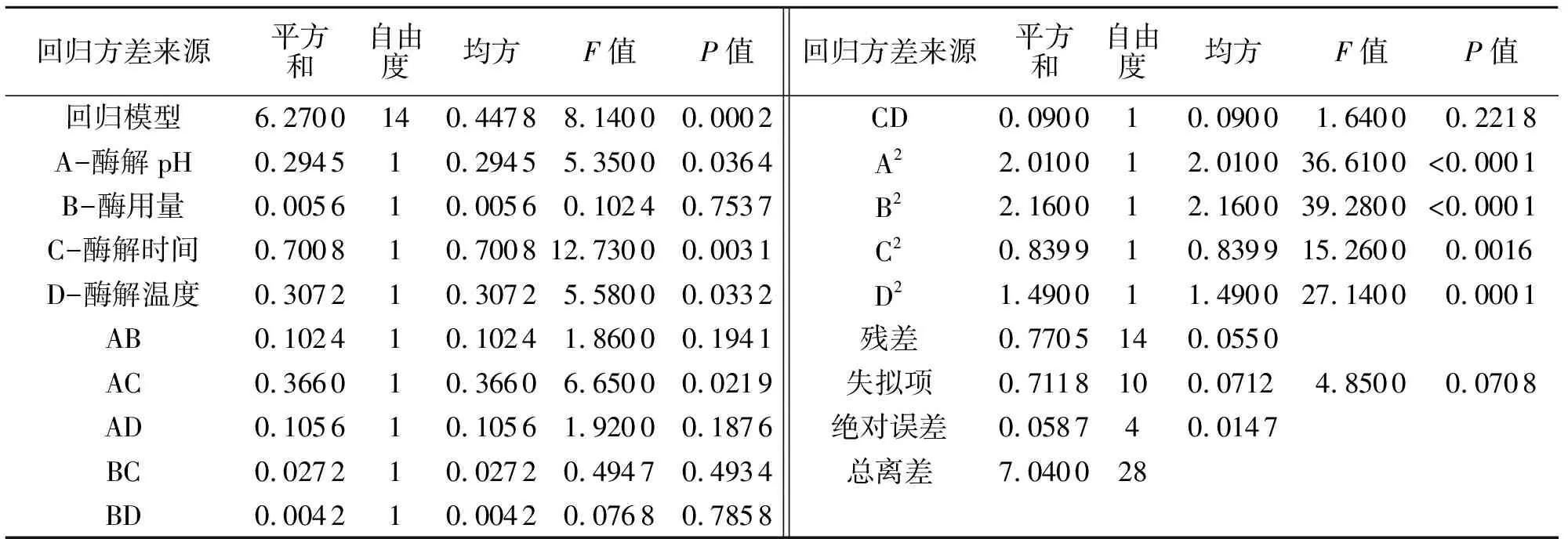
表2 方差分析表Tab.2 Analysis of variance
2.2.2 模型验证 基于预测的结果并结合实际情况,将提取条件进行微调,工艺条件如下:酶解pH为7,酶用量为4.5%,酶解时间为75 min,酶解温度为51 ℃,在此条件下进行3次平行实验,提取得率为4.81(±0.01)%,与预测结果4.77%基本吻合,说明此工艺条件合理准确.
2.3 结构分析
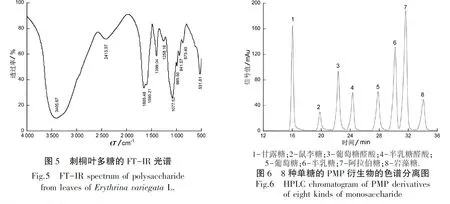
2.3.1 刺桐多糖的FT-IR光谱分析 刺桐多糖压片并进行红外扫描后,得到光谱图如图5所示.从图5中可以看出,刺桐多糖具有典型的多糖特征吸收峰:在3 405.67 cm-1附近有较强的-OH的收缩振动峰;在1 603.48 cm-1附近存在羰基的C=O伸缩振动形成的吸收峰[11];在1 399.04 cm-1附近有C-H的变角振动峰[12];1 400~1 200 cm-1为C-H的变角振动[13];在1 077.52 cm-1处为C-O振动吸收峰;941.57 cm-1处为端基C-H弯曲振动峰;531.81 cm-1处为葡萄糖残基[14].
2.3.2 刺桐叶片多糖的单糖组成分析 混合标准单糖PMP衍生物的HPLC图谱如图6所示.由图6可知,在预定条件下,8种单糖的分离效果很好.刺桐叶多糖的HPLC图谱如图7所示,可见分离效果好.通过将刺桐叶片多糖色谱图与标准色谱图的保留时间进行对比,可以确定出刺桐叶多糖由甘露糖、葡萄糖醛酸、半乳糖、葡萄糖、半乳糖和阿拉伯糖6种单糖组成;通过计算混合标准曲线中每摩尔各单糖的峰面积,再计算出刺桐叶多糖色谱图中各单糖的摩尔含量,可以算出刺桐叶片多糖中6种单糖的摩尔浓度比为48.67∶1.34∶4.49∶34.94∶8.64∶1.93,主要单糖为甘露糖和葡萄糖,占总单糖含量的83.6%.
2.4 刺桐叶多糖体外抗氧化活性
2.4.1 清除DPPH自由基的能力 刺桐叶多糖对DPPH自由基的清除活性如图8所示.由图8可知,Vc在1~5 mg/mL范围内对DPPH自由基的清除能力均在95%左右;刺桐叶多糖在1~5 mg/mL范围内对DPPH自由基的清除能力呈现明显的量效关系,在5 mg/mL时清除率达到32.55%,仍未达到50%的清除率,说明刺桐叶多糖对DPPH自由基的清除率较低.
2.4.2 清除羟自由基的能力 刺桐多糖对羟自由基的清除活性如图9所示.由图9可知,Vc在2.5~12.5 mg/mL范围内对羟自由基的清除能力均在90%以上;刺桐多糖在2.5~12.5 mg/mL的范围内对羟自由基的清除能力呈现明显的量效关系,在12.5 mg/mL时清除率达到98.8%,经过回归方程分析,其IC50为5.56 mg/mL.
2.5 刺桐叶多糖体外抗肿瘤活性
2.5.1 对HCCLM-3细胞增殖的抑制效应 不同质量浓度刺桐多糖对HCCLM-3细胞增殖的抑制率如图10所示.从图10可见,在刺桐叶片多糖浓度为5 mg/mL以下时,其对HCCLM-3细胞的增殖抑制效应并不明显,在浓度达到20 mg/mL时,增殖抑制率达到了96.6%.
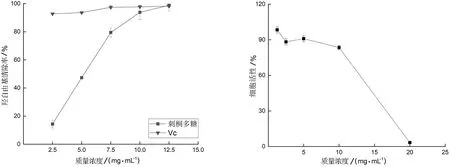
图9 刺桐叶多糖对羟自由基的清除活性 图10 刺桐叶多糖对HCCLM-3细胞增殖的抑制率
2.5.2 对HSC-3细胞增殖的抑制效应 不同浓度刺桐叶多糖对HSC-3细胞增殖的抑制率如图11所示.从图11可见,在浓度小于5 mg/mL时,刺桐叶多糖不仅对HSC-3细胞的增殖没有明显抑制效果,反而对其增殖作用有所促进.当浓度加大至10 mg/mL和20 mg/mL时,其增殖抑制率分别达到了34.6%和70.1%,表明刺桐叶多糖在高浓度时表现出了明显的增殖抑制效应.
3 讨论与结论
植物多糖是植物体内重要的大分子物质,常见的提取方法有水提醇沉法、酶提法、超声辅助法等,其中酶提法较为高效、安全.酶提法受到酶用量、酶解pH、酶解时间等因素的影响.隋志方等[15]利用复合酶对黑木耳中多糖进行提取,在条件为酶解时间50 min、纤维素酶∶木瓜蛋白酶=1∶1、酶用量3%、酶解温度50 ℃、酶解pH 6.5时,提取率为9.26%;本研究表明刺桐叶多糖的最佳提取工艺:酶解pH为7,酶用量为4.5%,酶解时间为75 min,酶解温度为51 ℃,在此条件下进行3次平行实验,提取得率为(4.81±0.01)%.相比之下,两者的提取条件上差异性不大,但在提取率上仍存在着巨大的差异,推测是由于材料不同所导致的.
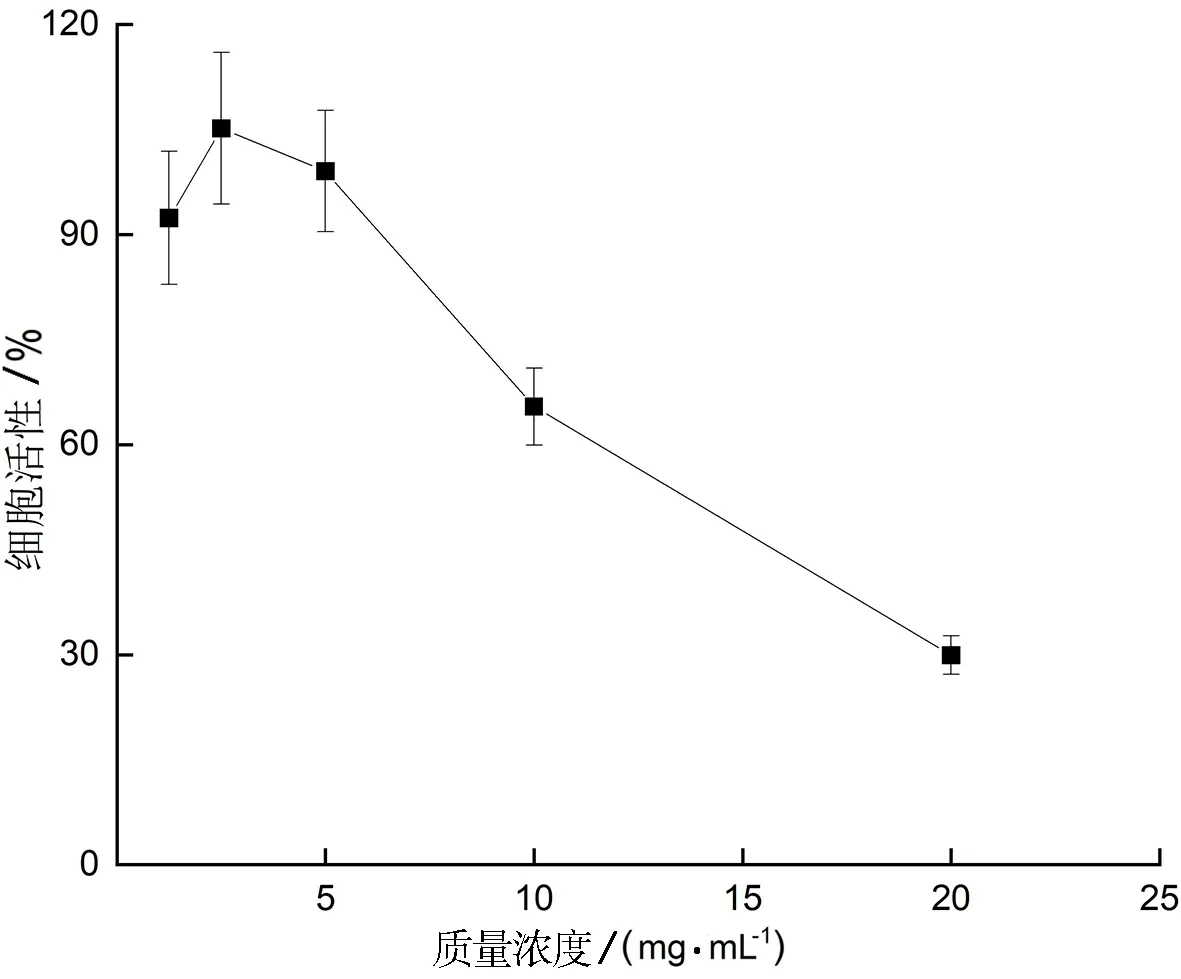
图11 刺桐叶多糖对HSC-3细胞增殖的抑制率Fig.11 Inhibition of polysaccharide from leaves of Erythrina variegata L. on proliferation of HSC-3 cell line
多糖的生物活性受到了诸多因素的影响,其中化学结构的影响较大,化学结构包括外观结构[16-18]、单糖组成[19-20]、官能团[21-22]等.近些年来的研究表明,不同种类的多糖在外观结构上差异较大;单糖的组成情况在总体上差异较小,但在不同单糖的比例方面存在着较大的差异;官能团的情况是通过扫描红外光谱来确定的,不同种类多糖的红外光谱均呈现出多糖的典型特征吸收峰,如-OH键、糖苷键、C-H键等.单糖组成分析显示,主要含有的单糖类型有甘露糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖以及阿拉伯糖,摩尔浓度比为48.67∶1.34∶4.49∶34.94∶8.64∶1.93.
近年来,科研人员对多糖的生物活性测定开展了大量的研究,主要测定其抗氧化、抗肿瘤、降血糖等活性.抗氧化活性的高低可以通过测定其对DPPH自由基、羟自由基等的清除能力并计算多糖对各种自由基清除一半时浓度来判断[23-25].本研究中,刺桐叶多糖对羟自由基清除能力的IC50为5.56 mg/mL,在浓度达到12.5 mg/mL时,对羟自由基清除率能够达到90%以上.多糖可以通过多种方式表达其抗肿瘤活性,如灵芝多糖[26]可以增强免疫系统,抑制癌细胞中IL-6、IL-8、MMP2和MMP9的释放,并显著降低癌细胞的细胞活性,从而达到抗肿瘤的效果;程婷婷等[27]观察了地参多糖的体外抗肿瘤活性并探究了其作用机制,结果表明地参多糖可以抑制A549细胞的增殖,使其周期阻滞在G0/G1期,同时通过线粒体凋亡途径和死亡受体途径诱导细胞凋亡.本研究中通过体外抗肿瘤实验,分别测定了刺桐叶多糖对HSC-3和HCCLM-3 2种癌细胞增殖的抑制情况,发现刺桐叶多糖具有一定的抗肿瘤活性,然而刺桐叶多糖具体是通过哪些机制和通路来表达其抗肿瘤活性还待进一步研究.

