YTHDF1异常表达对结直肠癌细胞增殖、迁移及CD4+T、CD8+T和Treg细胞浸润的影响
张亚楠,刘杭丰,郑锦秀,3,郗彦凤,杨 涛,3
N6-甲基腺苷(N6-methyladenosine, m6A)修饰是真核生物最普遍的RNA修饰方式。YTH N6-甲基腺苷RNA结合蛋白1(YTH N6-methyladenosine RNA-binding protein 1, YTHDF1)是m6A结合蛋白,在识别和结合m6A修饰转录本方面发挥作用[1]。近年来,文献报道YTHDF1在肝癌[2]、卵巢癌[3]和子宫颈癌[4]等多种癌症中广泛上调,并在胃癌[5]中具有促进细胞增殖和侵袭的作用。然而,YTHDF1在结直肠癌中的表达以及对结直肠癌细胞生物学功能的影响目前尚不明确。
此外,YTHDF1还与肿瘤微环境(tumor microenvironment, TME)中免疫细胞浸润水平有关[6]。在肺腺癌中,YTHDF1表达与CD4+T细胞、CD8+T细胞、巨噬细胞和中性粒细胞的浸润水平具有相关性[7-8];YTHDF1高表达与肝细胞癌中低CD8+T细胞浸润有关[9];YTHDF1拷贝数增加导致胰腺癌中CD4+T细胞和CD8+T细胞浸润水平降低[10]。Yan等[11]通过生物信息学数据分析发现,YTHDF1与结直肠癌组织中免疫细胞浸润具有相关性,但尚未在临床样本中验证。本研究首次采用免疫组化法检测YTHDF1的表达及其与结直肠癌中CD4+T细胞、CD8+T细胞和Treg细胞浸润水平的相关性,旨在为结直肠癌免疫治疗提供实验依据。
1 材料与方法
1.1 材料与试剂人结直肠癌细胞株SW620、HCT116等均购自中国科学院典型培养物保藏委员会细胞库。收集2015年3月~2015年6月山西省肿瘤医院手术后制备的结直肠癌及癌旁石蜡包埋组织53对,并制备组织芯片。McCoy′s 5A培养基购自美国Hyclone公司;胎牛血清(FBS)购自Moregate Biotech公司;CCK-8试剂盒购自Boster公司;Transwell小室购自康宁公司;转染试剂LipofectamineTM2000购自Invitrogen公司;质粒提取试剂盒购自Omega公司;YTHDF1(ab220162)购自Abcam公司;YTHDF1抗体(17479-1-AP)购自Proteintech公司;CD4(ab133616)和Foxp3(ab215206)均购自Abcam公司;CD8(70306s)购自Cell Signaling Technology公司;通用型试剂盒(小鼠/兔聚合物法检测系统)、DAB显色试剂均购自北京中杉金桥公司。
1.2 方法
1.2.1生物信息学分析 从TCGA数据库(https://portal.gdc.cancer.gov/)下载结直肠癌患者mRNA表达谱数据及相关临床信息。经处理后,共筛选568例结直肠癌及44例正常结直肠样本,其中473例包含临床信息。
单样本基因集富集分析(single sample gene set enrichment analysis, ssGSEA)用于分析结直肠癌样本中23种免疫细胞浸润情况。
1.2.2免疫组化 制作带有阵列孔的受体蜡块,根据HE染色制备成组织芯片蜡块。将切片脱蜡至水,枸橼酸钠高压修复,阻断剂消除内源性过氧化物酶活性,5%BSA封闭,加一抗YTHDF1(1∶100)、CD4(1∶500)、CD8(1∶200)、Foxp3(1∶250)4 ℃过夜,PBS水洗后加二抗37 ℃孵育30 min,DAB显色,苏木精复染,1%盐酸乙醇分化,脱水透明,中性树胶封固[12]。YTHDF1、CD4、CD8结果判读:(1)按阳性细胞百分数评分,阳性细胞数≤5%为0分,6%~25%为1分,26%~75%为2分,>75%为3分;(2)按细胞着色强度评分,无着色为0分,淡黄色或淡黑色为1分,棕黄色或棕黑色为2分,棕褐色或黑色为3分。将两项评分乘积作为总评分:>4.5分为高表达组,≤4.5分为低表达组[13]。Foxp3结果判读:随机选择3个40倍视野,计数阳性细胞数求平均值[14]。所有免疫组化染色结果均由两名病理医师经双盲法独立评分。
1.2.3质粒构建 设计YTHDF1 shRNA引物,shRNA-1上游引物:GATCCCGAAAGAGTTTGAGTG GAACTCGAGTTCCACTCAAACTCTTTCGTTTTTG,下游引物:AATTCAAAAACGAAAGAGTTTGAGTGGAA CTCGAGTTCCACTCAAACTCTTTCGG;shRNA-2上游引物:GATCCGATACAGTTCATGACAATGACTCGAG TCATTGTCATGAACTGTATCTTTTTG,下游引物:AATTCAAAAAGATACAGTTCATGACAATGACTCGA GTCATTGTCATGAACTGTATCG;shRNA-3上游引物:GATCCGAAACGTCCAGCCTAATTCTCTCGAGAG AATTAGGCTGGACGTTTCTTTTTG,下游引物:AATT CAAAAAGAAACGTCCAGCCTAATTCTCTCGAGAGAA TTAGGCTGGACGTTTCG。引物退火形成双链,用BamHⅠ、EcoRⅠ对载体37 ℃双酶切,T4 DNA连接酶16 ℃连接过夜,转化。挑单克隆,37 ℃摇菌12~14 h后送测序。
1.2.4Western blot 提取细胞总蛋白,BCA法蛋白定量,SDS-PAGE分离蛋白质,并转移至PVDF膜上,室温封闭1 h,一抗4 ℃孵育过夜,次日二抗室温孵育1 h,加入ECL发光液,凝胶成像仪显影。
1.2.5CCK-8和平板克隆实验检测细胞增殖 按5×103个/孔细胞接种至96孔板中,分别培养24 h、48 h后,每孔加入10 μL CCK-8,1~2 h后检测450 nm处的吸光度值。
按2×103个/孔细胞接种至6孔板中,培养14天,甲醇固定30 min,0.1%结晶紫染色15 min,计算克隆形成数量。
1.2.6划痕愈合实验和Transwell实验检测细胞迁移 细胞接种于6孔板中,调整细胞密度至1×106/mL,待细胞完全汇合后用200 μL枪头在孔板内行“井”字划痕,分别于0、24、48 h时在相同位置拍照,并用Image J软件分析。
消化细胞,无血清培养基重悬,调整细胞密度至2.5×105/mL,取200 μL细胞悬液加入Transwell上室;下室加入750 μL含20%胎牛血清的培养基。孵育箱中培养48 h后,甲醇固定30 min,0.1%结晶紫染色15 min,随机选取3个视野,光镜下计数。
1.3 统计学方法所有图表用GraphPad Prism、Image J软件进行统计学分析。Wilcoxon秩和检验用于评估箱线图的统计学意义,两组间比较采用独立样本t检验,YTHDF1与免疫细胞之间的相关性采用Pearson相关性分析,计数资料分析采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 YTHDF1在结直肠癌及癌旁正常组织中的表达TCGA数据库结果显示,结直肠癌组织中YTHDF1 mRNA的表达水平高于正常组织(P<0.01,图1A)。免疫组化结果显示,53例结直肠癌组织中YTHDF1蛋白的免疫评分(7.0±2.1)高于癌旁组织(5.0±1.5)(P<0.01,图1B、C)。

图1 A.TCGA数据库分析结直肠癌与正常组织YTHDF1 mRNA的表达;B.53对结直肠癌及癌旁组织中YTHDF1蛋白免疫评分统计图;C.结直肠癌及癌旁组织中YTHDF1蛋白表达,SP法;**P<0.01
2.2 验证YTHDF1-shRNA的敲减效率应用Western blot法检测6株结直肠癌细胞中YTHDF1蛋白表达水平,选取YTHDF1蛋白水平较高的HCT116构建敲减细胞株。Western blot结果显示:与对照组相比,敲减组细胞中YTHDF1表达显著降低,且在shRNA-3组细胞中表达量最低,因此选取shRNA-3组用于后续试验(图2)。

图2 A.Western blot检测6株结直肠癌细胞中YTHDF1的表达;B.Western blot检测敲减效率
2.3 敲减YTHDF1对结直肠癌细胞增殖的影响CCK-8和平板克隆实验结果显示:与对照组相比,shRNA-3组细胞的生长速度减慢(P<0.05,图3)。

图3 CCK-8(A)和平板克隆实验(B)检测敲减YTHDF1对HCT116细胞增殖的影响:*P<0.05,**P<0.01
2.4 敲减YTHDF1对结直肠癌细胞迁移的影响划痕愈合(图4)和Transwell实验(图5)结果显示:与对照组相比,shRNA-3组细胞的迁移能力明显减弱(P<0.05)。

图4 划痕愈合实验检测敲减YTHDF1对HCT116细胞迁移的影响:*P<0.05

图5 Transwell实验检测敲减YTHDF1对HCT116细胞迁移的影响:*P<0.05
2.5 结直肠癌组织中YTHDF1表达与CD4+T、CD8+T及Treg细胞浸润水平的相关性下载TCGA-COAD-READ的基因表达谱数据,按照YTHDF1 mRNA中位值分为高表达组和低表达组,ssGSEA评估TCGA数据库中结直肠癌样本的免疫细胞浸润情况,与YTHDF1低表达组相比,YTHDF1高表达组中CD4+T、CD8+T、Treg细胞的浸润减少(P<0.01,图6)。免疫组化结果显示:YTHDF1表达与CD4+T、CD8+T细胞浸润水平呈负相关,与Foxp3+Treg细胞浸润水平呈正相关(P<0.01,图7)。
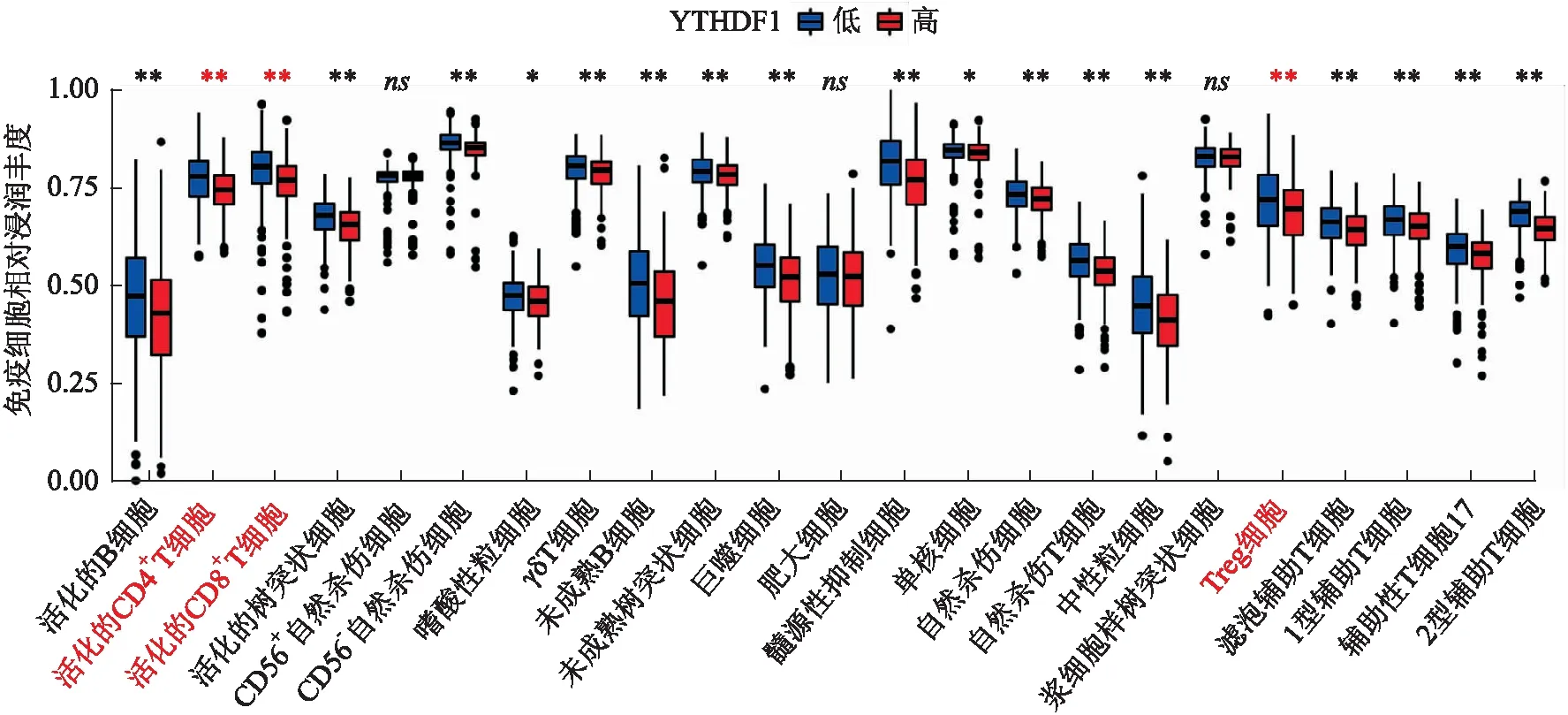
图6 ssGSEA评估YTHDF1 mRNA表达与结直肠癌免疫微环境23种免疫细胞浸润水平的关系:*P<0.05,**P<0.01

图7 A.结直肠癌组织中YTHDF1、CD4、CD8、Foxp3的表达,SP法;B.YTHDF1表达与CD4+、CD8+、Foxp3+免疫细胞浸润水平的相关性
2.6 YTHDF1表达与结直肠癌临床病理特征的关系TCGA数据库结果显示,YTHDF1表达与患者年龄(P=0.033)、临床分期(P=0.013)和淋巴结转移(P=0.016)显著相关(P<0.05,表1)。

表1 YTHDF1表达与结直肠癌临床病理特征的关系
3 讨论
YTHDF1是m6A结合蛋白,在多种恶性肿瘤中高表达,并与肿瘤的发生、发展及预后密切相关[15]。有研究表明YTHDF1在结直肠癌中过度表达,沉默YTHDF1可显著抑制结直肠癌细胞中Wnt/β-catenin通路活性,进而影响体外结直肠癌细胞的致瘤性和体内异种移植瘤的生长[16]。本实验通过分析TCGA数据库及53对结直肠癌与正常组织中YTHDF1的表达,发现YTHDF1在结直肠癌组织中的表达高于正常组织,与文献报道一致。在乳腺癌中,YTHDF1可以通过调控FOXM1促进细胞的增殖和迁移[17];YTHDF1还通过调节CCR4-NOT转录复合物亚基7(CNOT7)的m6A水平来调节骨肉瘤细胞的增殖、迁移和侵袭[18]。上述结果表明YTHDF1可能与多种肿瘤的恶性进展相关。本实验发现敲减YTHDF1可以抑制结直肠癌细胞的增殖和迁移,这表明YTHDF1可能有促进结直肠癌发生发展的作用。
YTHDF1与癌症相关的主要功能富集在抗原提呈和CD8+T细胞抗肿瘤反应等免疫调节方面[8,19],提示肿瘤组织中YTHDF1表达可能通过调节TME中免疫细胞的浸润而影响肿瘤的发生发展。在TME中,CD4+T细胞主要通过增强抗原提呈能力发挥抗肿瘤作用[20],而CD8+T细胞主要通过分泌穿孔素、颗粒酶B等杀伤肿瘤细胞[21]。本实验结合生信及免疫组化分析发现:YTHDF1表达与CD4+T细胞、CD8+T细胞浸润水平呈负相关。Treg细胞通过细胞间直接接触或释放细胞因子来抑制CD8+T细胞活性[22]。Foxp3+T细胞通常被直接认定为Treg细胞。本实验免疫组化结果显示,YTHDF1表达与Treg浸润水平呈正相关;而生信分析结果中,YTHDF1表达与Treg浸润呈负相关趋势。这种差异可能是因为Treg细胞存在不同亚群,即eTreg和non-Treg,两者难以通过免疫组化标记区分[23]。总之,YTHDF1异常表达可能通过某种特定的机制改变结直肠癌中免疫细胞的浸润水平,从而影响肿瘤进展和免疫治疗的疗效。
本文对YTHDF1表达与TCGA数据库473例结直肠癌的临床病理特征进行分析,发现YTHDF1表达与患者年龄、临床分期及淋巴结转移有关。而分析本文收集的53例结直肠癌临床病理数据未发现有统计学意义,可能是由于样本量偏少,本课题组将收集更多结直肠癌临床样本进一步分析。
综上,YTHDF1可促进结直肠癌细胞增殖和迁移,还与CD4+T细胞、CD8+T细胞浸润水平呈负相关,表明YTHDF1可能通过调控结直肠癌TME中免疫细胞浸润丰度参与肿瘤恶性进展。本研究仅揭示了YTHDF1表达与结直肠癌细胞功能、免疫浸润的关系,但其具体机制仍未阐明。因此,本课题组将进一步研究YTHDF1调控免疫细胞浸润的具体机制,为结直肠癌的免疫治疗提供实验依据。

