无患子RT-qPCR内参基因的筛选与验证
徐圆圆 赵国春 郝颖颖 翁学煌 陈仲,5 贾黎明
(1.北京林业大学林学院省部共建森林培育与保护教育部重点实验室,北京 100083;2.北京林业大学国家能源非粮生物质原料研发中心,北京 100083;3.北京林业大学无患子产业国家创新联盟,北京 100083;4.福建源华林业生物科技有限公司,三明 354500;5.北京林业大学林木分子设计育种高精尖创新中心,北京 100083)
实时荧光定量PCR(RT-qPCR)是一种研究植物生长发育和代谢物生物合成过程中关键基因功能的重要技术,由于其准确性高、特异性强、操作简便的特点,常被应用于基因的表达分析[1-2]。样品的RNA完整性、cDNA质量、引物特异性及扩增效率等因素都会影响RT-qPCR实验结果[1,3],引入1个或多个表达稳定的内参基因对目的基因进行校正和标准化可以提高RT-qPCR结果的准确性[4]。常用的内参基因大多是维持细胞正常生命代谢的管家基因,如与细胞结构相关的肌动蛋白基因(actin)、微管蛋白基因(tublin),与蛋白质降解相关的泛素基因(ubiquitin),与糖代谢相关的甘油醛-3-磷酸-脱氢酶基因(GAPDH)以及编码核糖体RNA的基因18S rRNA、28S rRNA等[5-6]。理想的内参基因应该是在所有生理状态下的样品、组织类型中均能较稳定表达的基因[7]。然而,研究表明植物中并不存在绝对稳定表达的基因,不同物种、组织、发育阶段或试验条件下,内参基因的表达稳定性存在差异,例如,千里光(Senecio scandens)的内参基因ACT1在不同组织和不同胁迫处理下表达稳定[8],而老鸦瓣(Amana edulis)的ACT在不同器官和不同发育时期的花芽中的表达稳定性却较差[9];红花(Carthamus tinctorius)的UBCE2是最适合用于种子发育阶段基因表达研究的内参基因,而在脱落酸处理下,研究不同红花品种对脱落酸信号响应的最佳内参基因是UBCE2和EF1β组合[10]。因此,根据物种、试验条件和试验目的选择合适的内参基因是获得准确、可靠的 RT-qPCR 实验结果的关键[7,11]。
无患子Sapindus mukorossi Gaertn.为无患子科(Sapindaceae)无患子属(Sapindus Linn.)植物,是我国传统的洗护用植物和药用植物,集日用化工、生物医药、生物质能源、绿化美化和生态修复于一体,具有较高的综合利用价值[12]。我们前期研究表明无患子根、茎、叶、花和果皮中均含有三萜皂苷[13],三萜皂苷起泡性能和去污能力强,可以用于制作手工皂、洗发水等洗护用品[14]。此外,无患子三萜皂苷及其皂苷元还具有抑菌、抗肿瘤、降血糖、降血脂、保肝和杀虫等多种生物活性,可用于医药、食品保健和农业等领域[15]。目前,对无患子的研究主要集中在种质资源收集和评价[14,16]、开花结实习性[17],原料林高效培育[18]及化学成分的提取、分离、鉴定与应用[19-20]等方面,极少涉及分子生物学和功能基因组学方面的研究,无患子内参基因筛选方面的研究也未见报道。课题组已完成了无患子根、茎、叶、芽、花和不同发育时期果皮的转录组测序工作,并从中挖掘了一系列无患子三萜皂苷生物合成候选基因。本研究从转录组测序数据中初步筛选了8个常见的候选内参基因,通过RT-qPCR技术,结合GeNorm、NormFinder、BestKeeper三个分析软件和RefFinder在线分析工具,对它们在无患子不同器官和不同发育时期果皮中的表达稳定性进行评估,以期筛选适用于无患子三萜皂苷生物合成相关基因表达研究的内参基因,同时对无患子三萜皂苷生物合成过程中的6个编码关键酶的基因(乙酰辅酶A酰基转移酶基因,SmAACT;1-脱氧-木酮糖-5-磷酸合酶基因,SmDXS;法呢基焦磷酸合成酶基因,SmFPS;β-香树素合成酶基因,SmbAS1;细胞色素P450酶基因,SmCYP716A-5;糖基转移酶基因,SmUGT73C-14)和2个编码转录因子的基因(SmbHLH8和SmERF25)的表达模式进行分析,可为后续深入开展无患子三萜皂苷生物合成机理研究奠定基础,也可为无患子及近缘植物的其他生物学过程中的基因表达研究提供参考。
1 材料与方法
1.1 材料
试验材料采自福建省三明市建宁县无患子原料林(116°52′E,26°49′N)。于 2018 年 3-11 月进行试验材料的采集。在果园中选取3株树体相近、生长健康、结果量稳定的优树进行果实样品采集,以单株为小区,3次重复。于3月4日采集芽(bud,B),4月 25日采集根(root,R)、茎(stem,ST)、叶(leaf,L),5月25日采集雄花(male flower,MF)和雌花(female flower,MF);6月10日-11月10日采集完整果实发育周期的果皮样品,涵盖果实发育全程的8个关键时期[17,21],分别为:子房发育早期(花后15 d,S1);果实最大体积的30%(花后45 d,S2);果实最大体积的70%(花后75 d,S3);果实最大体积的80%(花后90 d,S4);果实最大体积的90%(花后105 d,S5);果实开始成熟(花后120 d,S6);果皮发生较大变化(花后135 d,S7);果实充分发育和成熟(花后150 d,S8)(图1)。每个时期于晴天上午10点进行采样,每株树在相同位置上随机采摘果实,果实采摘后立即取下果皮,用液氮速冻后,置于-80℃保存备用。

图1 无患子采样材料Fig.1 Sample materials of S.mukorossi
FinePure Plant RNA提取试剂盒购自北京济凡生物科技有限公司;Goldenstar RT6 cDNA Synthesis Kit Ver 2、2× T5 Fast qPCR Mix等购自北京擎科生物科技有限公司。
1.2 方法
1.2.1 候选内参基因的选取 基于无患子根、茎、叶、芽、花和果皮的转录组数据,以基因表达量FPKM(fragments per kilobase of transcript per million mapped reads)值大于10和不同器官或果皮发育时期间FPKM的差异倍数小于2为筛选标准,选取8个常用的内参基因作为候选基因进行稳定性分析,包括18S核糖体RNA甲基转移酶基因(18S rRNA(guanine1575-N7)-methyltransferase,Sm18S)、 肌动蛋白基因(actin-related protein 8,SmACT)、转录延伸因子基因(elongation factor 1-alpha,SmEF-1α)、大亚基核糖体蛋白基因(large subunit ribosomal protein L1,SmRPL1)、小亚基核糖体蛋白基因(small subunit ribosomal protein S26e,SmRPS26)、微管蛋白特异性伴侣蛋白基因(tubulin-specific chaperone C,SmTBCC)、泛素缀合酶基因(ubiquitin-conjugating enzyme E2 M,SmUBC12)、E3泛素蛋白连接酶基因(E3 ubiquitin-protein ligase BAH,SmUBP)。根据候选内参基因的核苷酸序列,使用Primer Premier 5.0软件设计引物(表1),引物由北京擎科生物科技有限公司合成。
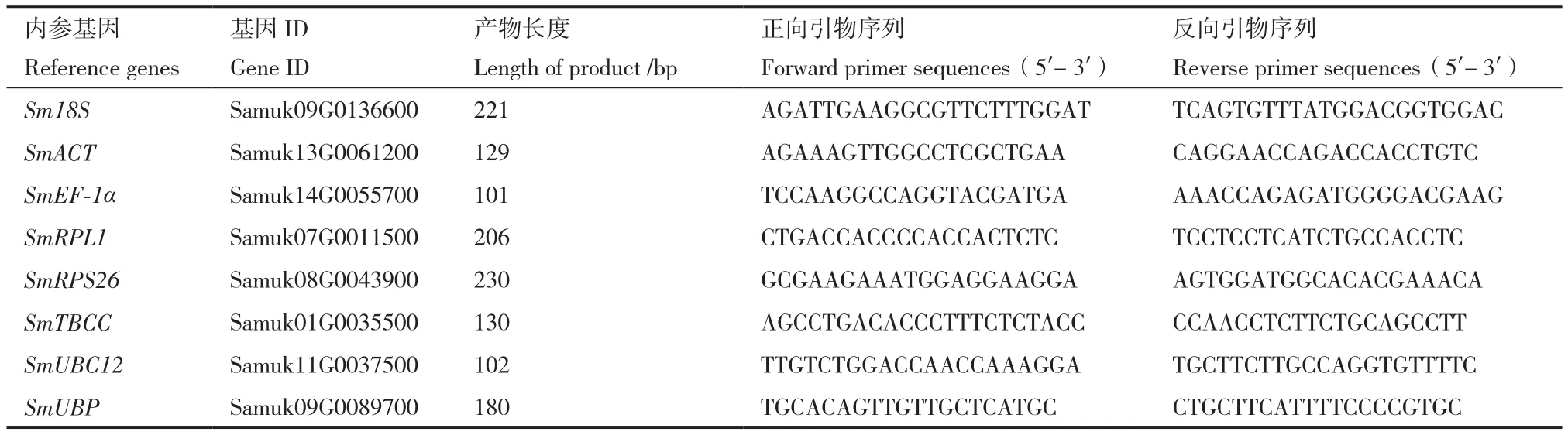
表1 候选内参基因的引物Table 1 Primers of candidate reference genes
1.2.2 候选内参基因的RT-qPCR分析 根据FinePure Plant RNA提取试剂盒说明书提取无患子样品的总RNA,并采用1%琼脂糖凝胶电泳检测每个样品的RNA质量,然后使用NanoDrop 2000分光光度计检测RNA的浓度及纯度,要求A260/A280值在1.8-2.1之间。使用反转录试剂盒Goldenstar RT6 cDNA Synthesis Kit Ver 2合成cDNA。使用LineGene 9600 Plus荧光定量聚合酶反应(PCR)检测系统(杭州博日,中国)进行荧光定量检测。扩增体系和反应程序如下:反应体系为20 μL,其中T5 Fast qPCR Mix(SYBR Green I)(2×)10 μL,正反向引物各0.8 μL,cDNA 模板 1 μL,ddH2O 7.4 μL。PCR 程序 :95℃预变性 1 min;95℃变性 15 s,60℃退火 34 s,72℃延伸30 s,40个循环;反应结束后通过熔解曲线检测产物特异性:从60℃缓慢升温(0.11℃/s)至95℃,每升温1℃连续采集5次荧光信号。每个样本设置3次技术重复。最后基于扩增结果制作内参基因的标准曲线,并计算相关系数。
1.2.3 候选内参基因的稳定性分析 使用Microsoft Excel 2016软件对实时荧光定量PCR产生的原始Ct值进行整理,计算每个样本的平均Ct值。使用 geNorm[22]、NormFinder[23]和 BestKeeper[24]软件对8个候选内参基因的稳定性进行分析。其中,geNorm和NormFinder软件以2-△Ct进行分析,△Ct=Ct样本-Ctmin;geNorm软件通过计算候选内参基因的平均表达稳定值(M)对其稳定性进行评估,该值与内参基因的稳定性呈负相关关系,一般认为M值小于1.5,内参基因表达稳定[22]。另外,geNorm软件还可以通过候选内参基因标准化因子的配对差异分析(Vn/Vn+1)得出最佳内参基因的配对组合。软件默认的Vn/Vn+1值为0.15,当Vn/Vn+1<0.15时,说明n个内参基因已满足稳定归一化;当Vn/Vn+1>0.15时,则需要n+1个内参基因才能满足稳定归一化。NormFinder软件则以表达稳定值(Stability value,SV)对候选内参基因的表达稳定性进行评价,该值越小,说明基因表达越稳定[23]。Bestkeeper软件以样本的原始Ct值进行分析,通过Ct值的标准偏差(SD)、变异系数(CV)和相关系数(r)来评价候选内参基因的表达稳定性,SD和CV越小,r越大,候选内参基因的稳定性越好[24]。然后,根据Delta Ct方法计算各内参基因表达量的平均标准偏差(STDEV)。基于geNorm、Normfinder、BestKeeper和Delta Ct四种分析结果,通过RefFinder在线分析工具(https://www.heartcure.com.au/reffinder/)计算其几何平均数以获得候选内参基因稳定性的综合指数排名[25],综合指数越小,说明基因的表达稳定性越高。
1.2.4 内参基因的验证 以筛选出来的内参基因作为内参,使用RT-qPCR对无患子三萜皂苷生物合成相关的6个编码关键酶的基因(SmAACT、SmDXS、SmFPS、SmbAS1、SmCYP716A-5 和 SmUGT73C-14)和2个编码转录因子的基因(SmbHLH8和Sm-ERF25)的相对表达量进行测定,以验证筛选出来的内参基因的可靠性。采用Ct(2-ΔΔCt)法计算相对表达量,再计算各样本相对于果皮S1时期的表达量。各目的基因的引物见表2。使用Microsoft Excel 2016软件对数据进行处理,使用Origin 2017 SR2绘制图表。

表2 目的基因的引物Table 2 Primers of objective genes
2 结果
2.1 RT-qPCR分析结果
RT-qPCR结果显示8个候选内参基因的扩增效率在93.727%-100.206%之间,相关系数在0.997-0.999之间(表3),符合荧光定量PCR实验要求。如图2所示,在无患子根、茎、叶、芽、花和果皮等器官中,8个内参基因的平均Ct值在21.37(SmEF-1α)-28.04(SmTBCC) 之 间,SmEF-1α的变幅较大。
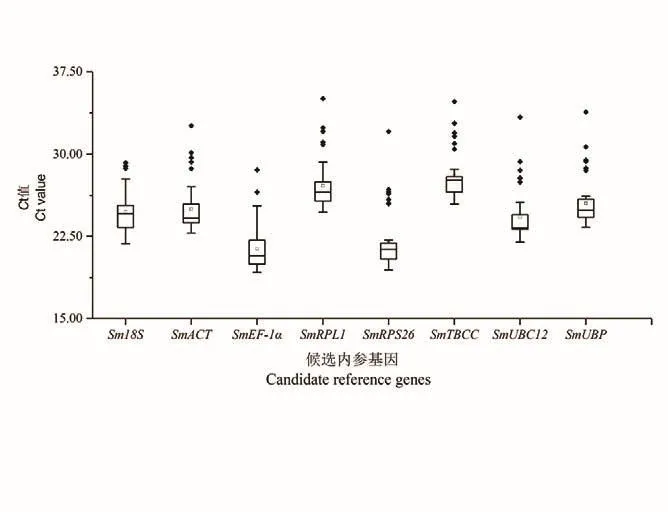
图2 候选内参基因的Ct值Fig.2 Ct values of candidate reference genes
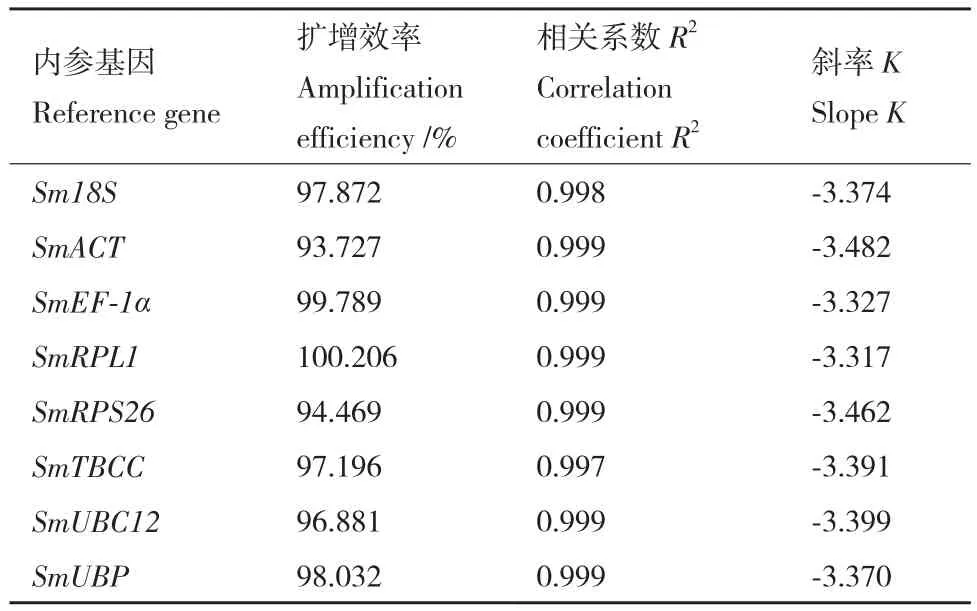
表3 候选内参基因扩增效率和标准曲线参数Table 3 Amplification efficiency and standard curve parameters of candidate reference genes
2.2 候选内参基因的稳定性分析
geNorm软件分析结果表明,在无患子不同器官和不同发育时期果皮中,8个候选内参基因的平均表达稳定值(M)均小于1.5(表4)。其中,SmACT和SmRPL1的M值最小,为0.373;其次为SmUBC12,M值为0.508。候选内参基因标准化因子的配对差异分析结果显示V2/V3(0.182)大于0.15,V3/V4(0.126)小于 0.15( 图3)。NormFinder软件结果显示8个候选内参基因的稳定性排序为SmACT>SmUBP>SmRPL1>SmUBC12>SmTBCC>SmRPS26> Sm18S> SmEF-1α(表4)。BestKeeper软件分析结果表明,SD值和CV值最小的基因分别为 Sm18S和 SmTBCC,SmACT、SmRPL1和 SmUBP的 r值最大(r=0.985)(表4)。采用 Delta Ct法对候选内参基因的表达稳定性进行分析,结果表明SmACT(0.67) 的 STDEV 最 小,SmEF-1α(1.07)的STDEV最大(表4)。RefFinder综合分析结果显示,8个候选内参基因在无患子不同器官和不同发育时期果皮中的表达稳定性大小顺序为SmACT、SmRPL1、SmUBP、SmUBC12、Sm18S、SmTBCC、SmRPS26、SmEF-1α,其中SmACT是最理想的内参基因,其次为SmRPL1和SmUBP(表4)。
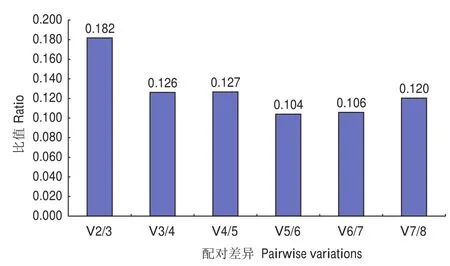
图3 geNorm软件分析内参基因最适数目Fig.3 Analysis of optimal number of reference genes for normalization by geNorm

表4 GeNorm,NormFinder和BestKeeper分析结果和排名Table 4 GeNorm,NormFinder and BestKeeper analysis results and rankings
2.3 内参基因稳定性的验证
分别以筛选出来的3个稳定性较好的内参基因(SmACT、SmRPL1和SmUBP)和一个稳定性较差的内参基因(SmEF-1α)作为内参,对8个皂苷合成相关基因在不同器官和不同发育时期果皮中的表达情况进行研究。结果如图4所示,SmAACT4在果皮S6-S8时期和雄花中有较高相对表达量;SmDXS4在果皮S5-S7时期和根中高表达;SmFPS和SmCYP716A-5在果皮S1-S4时期和雌花中有较高相对表达量;SmbAS1和SmUGT73C-14的相对表达量随着果皮生长先升高后下降,且均在S3时期达到最高;SmbHLH8和SmERF25在果皮S1时期和根、茎、叶、芽和雌花等器官中高表达。以SmACT、SmACT+SmRPL1组合和SmACT+SmRPL1+SmUBP组合进行数据标准化,目的基因的相对表达量基本上保持一致;同时,8个目的基因在不同器官和不同发育时期果皮中的表达规律与转录组测序结果相一致,进一步验证了转录组测序结果的可靠性;以稳定性较差的候选内参基因SmEF-1α为内参,会高估目的基因的相对表达水平。
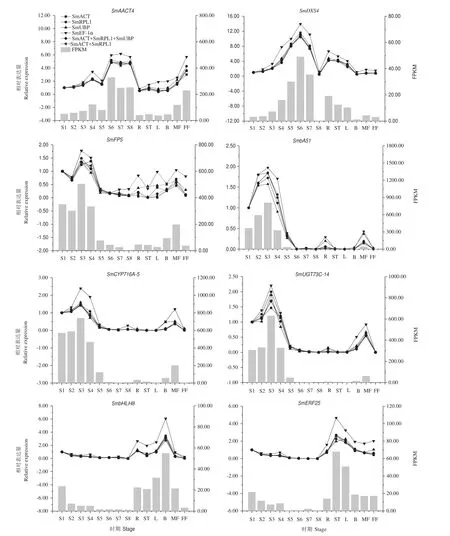
图4 无患子三萜皂苷生物合成途径中相关基因的RT-qPCR结果Fig.4 RT-qPCR expression pattern of genes related to the triterpenoid saponin biosynthesis of S.mukorossi
本研究对无患子的8个候选内参基因在不同器官和不同果皮发育时期的表达量进行RT-qPCR分析,结果显示各基因的Ct值均有所变化,结合3种软件对其稳定性进行评价,结果表明不同软件得出的稳定性排序存在一定差异,geNorm、NormFinder软件和Delta Ct法结果均显示SmACT的稳定性最好;而BestKeeper软件分析表明SD值最小的基因为Sm18S,CV值最小的基因为SmTBCC,r值最大的基因为SmACT、SmRPL1和SmUBP。可见,GeNorm和NormFinder软件的分析结果较为接近,而与BestKeeper软件分析结果略有不同,这与蒋婷婷等[26]、Dudziak 等[27]、曹映辉等[28]、章颖佳等[29]的研究结果相似,造成这种差异的原因可能是各软件所使用的算法不同[30]。ACT是一类球状微丝结构蛋白,在细胞中占总蛋白质含量的5%以上,氨基酸序列高度保守[31]。ACT在植物组织中表达量大且基本稳定,常被用于植物三萜皂苷生物合成途径中相关基因的表达分析研究,如刺五加(Eleutherococcus senticosus)[32]、刺楸(Kalopanax septemlobus)[33]和细风轮菜(Clinopodium gracile)[34]等。本研究结果也表明SmACT在无患子根、茎、叶、芽、花和果皮中表达最稳定,是最适合作为三萜皂苷生物合成相关基因表达分析的内参基因。另外,根据geNorm软件得到的V2/V3>0.15、V3/V4<0.15的结果,说明3
3 讨论
个稳定基因的组合能增加定量结果的可靠性,所以SmACT、SmRPL1、SmUBP是理想的内参基因组合。
本研究结果显示以SmACT、SmACT+SmRPL1组合和SmACT+SmRPL1+SmUBP组合进行数据标准化,无患子皂苷合成途径中的6个关键酶编码基 因(SmAACT4、SmDXS4、SmFPS、SmbAS1、SmCYP716A-5和SmUGT73C-14)和2个转录因子编码基因(SmbHLH8和SmERF25)的相对表达量基本上保持一致,说明了这些内参基因及内参基因组合的可靠性。Xiao等[35]在羊踯躅(Rhododendron molle)不同发育阶段和不同组织下内参基因筛选的研究中也得到了类似的结论,即采用单个或两个内参的组合对目的基因进行表达验证时,其表达趋势一致。所以,在无患子果皮RT-qPCR实 验 中, 使 用SmACT、SmACT+SmRPL1组 合、SmACT+SmRPL1+SmUBP组合作为内参基因对目的基因进行校准均可得到准确和可靠的定量结果。
乙酰辅酶A酰基转移酶(acetyl-CoA C-acetyltransferase,AACT)、1-脱氧D-木酮糖-5-磷酸合成酶(1-deoxy-D-xylulose-5-phosphat synthetase,DXS)、法呢基焦磷酸合酶(farnesyl pyrophosphate synthetase,FPS)、β-香树素合成酶(β-amyrin synthase,β-AS)、细胞色素P450依赖性单加氧酶(Cytochrome P450-dependent monooxygenases,CYP450s)和 糖基转移酶(uridine diphosphate(UDP)-glucosyltransferases,UGTs)是三萜皂苷生物合成途径中的关键酶类,编码这些酶的基因在无患子三萜皂苷生物合成过程中均起着重要作用[36-38]。课题组前期研究表明无患子果皮中的三萜皂苷含量最高(13.26%),其次为花(5.68%-6.21%)和叶(3.30%-5.35%)[13];此外,在果皮发育过程中,总皂苷含量总体上呈先增加后降低、然后保持在较高水平的趋势,在S3和S4时期有较高的总三萜皂苷含量[39]。本研究 发 现 SmAACT4、SmDXS4、SmFPS、SmbAS1、SmCYP716A-5、SmUGT73C-14、SmbHLH8 和SmERF25等编码基因在根、茎、叶、花等部分器官或果皮的部分发育时期中高表达,说明其在无患子三萜皂苷生物合成中可能发挥着重要作用。另外,SmFPS、SmbAS1、SmCYP716A-5、SmUGT73C-14 的相对表达量在果皮发育前期(S1-S4时期)较高,SmbHLH8和SmERF25在果皮S1时期也有较高的相对表达量,说明这些关键基因或转录因子在调控无患子皂苷合成与积累的过程中可能存在着协同作用,具体机制有待进一步研究。研究表明亲缘关系相近的物种中同一类同源基因的保守性一般会更高,所以本研究筛选出的内参基因SmACT、SmRPL1和SmUBP不仅可用作无患子三萜皂苷合成相关基因表达量分析的内参基因,也可以应用于无患子及近缘植物的其他生物学过程中的基因表达研究。然而,本研究仅对无患子根、茎、叶、芽、花和不同发育时期果皮进行了研究,筛选出的内参基因在各类胁迫处理的无患子植株中的稳定性有待进一步验证。
4 结论
从无患子8个候选内参基因中,筛选得到SmACT、SmRPL1和SmUBP等3个表达稳定性较好的内参基因,以这些基因为内参对三萜皂苷生物合成途径中的8个候选基因进行校准所得的表达量基本上保持一致,且相对表达量结果与转录组结果基本保持一致,表明SmACT、SmACT+SmRPL组合和SmACT+SmRPL+SmUBP组合可作为无患子三萜皂苷生物合成途径中相关基因表达研究的内参基因。

