岩藻多糖对酒精暴露小鼠肝损伤的保护作用及机制
杨 佳,党 凯,薛美兰, *,梁 惠 *,张 楠,王 青,裴忠仟,秦益民
(1.青岛大学基础医学院,山东 青岛 266071;2.青岛大学公共卫生学院,山东 青岛 266071;3.青岛大学附属医院眼科,山东 青岛 266021;4.青岛明月海藻集团有限公司,海藻生物活性物质国家重点实验室,山东 青岛 266555)
随着人们生活水平的不断提高,越来越多的居民饮酒,据世界卫生组织统计,全世界每年约有330万人死于过量饮酒[1]。研究表明长期过度饮酒是危害肝脏造成严重肝病的主要原因之一,其中酒精性肝病(alcoholic liver disease,ALD)在临床上最为常见。ALD是一种逐渐加重的肝脏疾病,包括从早期的脂肪变性到肝炎、肝纤维化和肝硬化的一系列进行性病理变化。脂肪变性和炎症损伤是ALD发生发展的主要早期驱动因素,研究表明,自噬在维持基础代谢、抑制炎症损伤和调节免疫方面具有重要作用,通过调节自噬在病变早期对ALD进行积极有效的干预,对阻断ALD病程进展显得至关重要。研究发现,激活自噬可减轻炎症损伤和改善脂质代谢紊乱[2-3]。同时,有文献报道酒精可靶向激活自噬负调控通路磷酸肌醇3激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路,下调转录因子EB(transcription factor EB,TFEB)的表达,通过减少自噬加重酒精诱导的肝损伤[4]。ALD的发病机制复杂,临床上主要通过改善症状及预防并发症对其进行治疗,尽管已尝试多种干预措施改善后,但目前ALD的治疗仍然是基于戒酒和短期接触皮质类固醇[5]。研究表明仍然有近40%的ALD患者没有受益于此治疗,因此,加快研究其主要的发病机制并研发相应药物进行治疗显得尤为重要。
研究报道上调Parkin诱导的线粒体自噬可能是治疗乙酰氨基酚(acetaminophen,APAP)或酒精介导的肝病的潜在新疗法,其通过清除受损线粒体减轻酒精或APAP引发的肝损伤[6]。盖芒槭提取物可以上调自噬相关基因的水平,诱导肝细胞自噬,保护肝脏免受酒精诱导的损伤[7]。另外,甘氨酸香豆素(glycine coumarin,GCM)通过上调p62基因表达激活核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)通路,并诱导小鼠肝细胞自噬,从而减少暴露于慢性或急性乙醇的小鼠的肝毒性损伤[8]。上述研究均表明,通过相应干预物诱导自噬可以减轻酒精暴露引发的肝毒性损伤。
岩藻多糖是褐藻类植物(如昆布、海带)中所特有的硫酸化多糖分子,又称为褐藻多糖硫酸酯。研究表明,岩藻多糖因富含丰富的硫酸基以及独特的多糖结构使其具有多样的生物活性,如抗氧化、降脂、抗病毒、抗肿瘤、调节免疫等,加之我国褐藻资源非常丰富,因而成为研究热点[9]。在动物实验和HepG2细胞实验中,研究发现岩藻多糖减少促炎环氧化酶2和一氧化氮的产生,改善酒精引起的肝脏炎症损伤[10]。此外研究显示岩藻多糖具有调节自噬的活性,Zhang Jie等[11]发现岩藻多糖通过增强自噬改善多柔比星诱导的急性心脏损伤。前期研究也证实,岩藻多糖通过下调mTOR/核糖体蛋白70S6激酶(ribosomal protein 70S6 kinase,p70S6K)/TFEB通路诱导乳腺癌细胞自噬从而抑制肿瘤的发展[11]。
以上结果表明,酒精通过靶向mTOR蛋白通路抑制自噬,而激活自噬可减轻ALD早期的炎症损伤和脂质代谢紊乱,岩藻多糖是否可通过调节mTOR/p70S6K通路诱导自噬来抑制ALD小鼠的早期进展还有待进一步研究探讨。本实验通过建立ALD小鼠模型,用岩藻多糖进行干预,通过相应指标测定来探究其对ALD早期进展的抑制作用及相应机制。
1 材料与方法
1.1 动物、材料与试剂
C57BL/6小鼠,雄性,8 周龄,体质量(22±2)g,无特定病原体,购于北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2016-0006,饲养于青岛大学公共卫生学院动物饲养中心的光控房间中(12 h明暗循环),控制温度(21±2)℃、相对湿度50%~60%。实验期间小鼠自由获得食物和自来水。
岩藻多糖购买于美国Sigma公司,其来源于墨角藻,分子式为C18H27O21S3,分子质量为675.6 kDa。岩藻多糖是水溶性多糖,故采用水提或酸提取法从藻类中分离,为硫酸化L-岩藻糖聚合物(纯度95%)。
无水乙醇 天津科密欧化学试剂有限公司;戊巴比妥钠、锇酸醋酸双氧铀、柠檬酸铅 北京索莱宝生物科技有限公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒 上海宝曼生物科技有限公司;电泳缓冲液、快速电转缓冲液、配胶试剂盒上海雅酶生物技术有限公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素(interleukin,IL)-1β、IL-4、IL-6 美国Biolegend公司;谷丙转氨酶(alanine aminotransferase,ALT)检测试剂盒、谷草转氨酶(aspartate aminotransferase,AST)检测试剂盒、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、总胆固醇(total cholesterol,TC)、甘油三酯(triglycerides,TG)、总胆汁酸(total bile acid,TBA)酶联免疫吸附试验(enzymelinked immunosorbent assay,ELISA)检测试剂盒 南京建成生物工程研究所;抗LC-3B II兔一抗、抗磷酸化哺乳动物雷帕霉素靶蛋白复合体1(phosphorylated-mammalian target of rapamycin complex 1,p-mTORC1)兔一抗 美国Proteintech公司;异硫氰酸荧光素(fluorescein isothiocyanate,FITC)荧光二抗、抗TFEB兔一抗、抗β-actin兔一抗、辣根过氧化物酶(horseradish peroxidase,HRP)标记二抗 美国ABclonal公司;抗p62兔一抗、抗p-p70S6K兔一抗美国Cell Signaling Technology公司;增强化学发光液(enhanced chemiluminescence,ECL)试剂盒 北京中杉金桥生物技术有限公司。
1.2 仪器与设备
HK400超纯水机、YD-1508R轮转切片机、TEC-2800型包埋机 日本Olympus公司;-80 ℃低温冰箱美国Sigma公司;JA2003A精密电子天平、FacsCanto II流式细胞仪、MT-360多功能快速振荡器、ELx808通用酶标仪 美国BioTek公司;DCM-120KE制冰机 英国Hoshizaki公司;Micro 17低温离心机、OMS100自动温控烘箱 美国Thermo公司;VCX130超声波细胞粉碎仪美国Bio-Rad公司;CX40型光学显微镜 日本Hitachi公司;Nikon Eclipse80i荧光显微镜 日本Nikon公司;JEM1200EX型透射电子显微镜 美国Sonics公司;Countess II全自动生化分析仪 美国Invitrogen公司。
1.3 方法
1.3.1 动物分组和干预
将30 只8 周龄SPF级雄性C57BL/6小鼠按体质量随机分成3 组,每组10 只,分别为对照组(生理盐水)、酒精模型组和岩藻多糖干预组。对酒精模型组和岩藻多糖干预组的小鼠,每天用体积分数50%乙醇溶液先以8 mL/kgmb灌胃2 周,再以12 mL/kgmb继续灌胃6 周,建立ALD小鼠模型。同时,在乙醇灌胃2 h后给予岩藻多糖干预组小鼠灌胃300 mg/kgmb岩藻多糖(溶解于生理盐水),1 次/d;对照组小鼠给予等量的生理盐水;灌胃8 周。
1.3.2 样品采集
实验干预8 周后,小鼠腹腔注射40 mg/kg戊巴比妥钠麻醉。摘除眼球取血,然后分离并固定肝组织。将切下的肝组织一部分固定在质量分数4%多聚甲醛溶液中进行组织病理学分析,另一部分固定在2.5%戊二醛溶液中进行超微结构分析,其余部分在液氮中快速冷冻。
1.3.3 肝脏组织病理学检查
肝脏标本用质量分数4%多聚甲醛4 ℃固定24 h后石蜡包埋。将肝脏组织切成4 μm厚的薄片并用苏木精-伊红(hematoxylin-eosin,HE)染色,在光学显微镜下进行组织病理学观察。
1.3.4 透射电子显微镜观察肝脏超微结构
肝组织样本依次用3%戊二醛溶液和1%锇酸溶液固定。再用0.1 mol/L磷酸盐缓冲液洗涤,并用不同体积分数丙酮溶液(30%、50%、70%、80%、90%、100%)脱水。将样品嵌入环氧树脂浸透中并在自动温控烘箱中固化。再用超薄切片机将固化后的样品切成40~60 nm的超薄切片。再用醋酸双氧铀和柠檬酸铅对切片进行双染染色。最后,通过透射电子显微镜对切片进行观察和分析。
1.3.5 血脂指标检测
血清样本于3 000 r/min离心15 min,再通过ELISA试剂盒测定TG、TC、LDL-C、HDL-C和TBA水平,实验操作严格按照试剂盒说明书进行。
1.3.6 血清转氨酶和肝脏炎症因子的检测
将分离出的动物血清样品放入全自动生化分析仪中。按照设定程序自动检测ALT和AST活力。用ELISA试剂盒检测肝脏中的IL-1β、IL-4、IL-6和TNF-α水平。
1.3.7 炎性细胞比例检测
将来源于肝脏的单核细胞与纯化的特定一抗在4 ℃下孵育10 min,然后再用相应的二抗孵育30 min。在流式细胞仪上进行检测,检测干扰素-γ(interferon-γ,IFN-γ)、IL-4、IL-17和表面抗原分化簇4(the people surface antigen cluster of differentiation 4 protein,CD4)的含量,并用Flowjo软件分析数据,计算炎性细胞辅助性T细胞(helper T cell,Th)1、Th2和Th17的比例。
1.3.8 微管相关蛋白1轻链3β荧光抗体检测
冷冻的肝组织用体积分数10%甲醛溶液固定12 h。再依次用体积分数75%乙醇溶液对其进行脱水,二甲苯透明,石蜡包埋。再用3%小牛血清封闭切片,一抗微管相关蛋白1轻链3β(microtubule-associated protein 1 light chain 3 beta,LC3B)于4 ℃孵育过夜,再用Tris缓冲盐溶液(Tris buffered saline,TBS)洗涤3 次,滴加4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole,DAPI)染液,避光孵育5 min,用抗荧光衰减封片剂封片,再用荧光标记的二抗对样品进行孵育1 h,最后,在暗室中用荧光显微镜进行免疫荧光检查和成像观察。
1.3.9 蛋白免疫印迹分析
用裂解缓冲液提取肝组织总蛋白,然后用BCA蛋白浓度定量法计算蛋白浓度。蛋白质通过12.5%十二烷基硫酸钠-聚丙烯酰胺凝胶进行分离,用电转仪将其转移至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜上。膜在室温下依次用5%脱脂牛奶封闭1 h,并进一步与特定的一抗和二抗一起孵育。特异性一抗如下:LC3B II(V(抗体)∶V(抗体稀释液)=1∶1 000,下同)、p62(1∶1 000)、p-MTORC1(1∶1 000)、p-p70S6K(1∶1 000)、TFEB(1∶1 000)、HRP二抗(1∶1 000)。最后,用ECL对膜进行可视化,并使用Image J软件分析蛋白灰度值。
1.4 数据处理与统计
采用SPSS13.0软件对采集到的数据进行分析,通过平均值±标准差评估定量数据。数据通过单因素方差分析进行显著性分析,P<0.05为差异有统计学意义。
2 结果与分析
2.1 岩藻多糖对酒精暴露小鼠肝组织形态学的影响
HE染色结果显示,对照组肝小叶结构清晰,肝细胞索呈放射状排列于小叶中央静脉周围,肝细胞内无明显脂肪变性。酒精模型组肝细胞肿胀,有Mallory小体,伴有脂肪变性,中央静脉和小叶中央区域可见炎性细胞浸润。岩藻多糖干预后,肝细胞细胞质中的Mallory小体和脂肪滴较少,肝索排列整齐,组织结构趋于正常(图1A)。电子显微镜观察到,对照组细胞器丰富,大量线粒体形态正常,内嵴结构清晰,可见较多自噬体(箭头所示)。酒精模型组线粒体嵴模糊,自噬体减少。岩藻多糖干预后,线粒体嵴清晰,自噬体增多(箭头所示,图1B)。Liu Xiao等[12]研究报道,酒精引起小鼠肝索肿胀、肝细胞坏死和炎性细胞浸润。将受精后4 d的斑马鱼幼虫暴露于350 mmol/L乙醇溶液32 h,HE染色结果显示肝脏肿大明显、肝实质空泡化和行为异常,并伴有肝脂肪变性和脂质过氧化损伤,证实酒精暴露会造成肝组织不良病理损伤[13]。

图1 岩藻多糖对ALD小鼠肝组织形态的影响Fig.1 Effect of fucoidan on liver histomorphology in ALD mice
2.2 岩藻多糖对酒精暴露小鼠血清转氨酶的影响
AST和ALT水平是肝损伤的常规指标,一般通过评估AST和ALT水平来检测肝损伤。基于对ALD患者的诊断,结果显示ALT和AST水平出现非特异性轻中度增高[14]。此外,研究证实,慢性酒精刺激会引起小鼠体内ALT和AST水平的明显升高,加重肝损伤[15]。如图2所示,酒精模型组的ALT和AST水平显著高于对照组,分别增加约1.8 倍和68%(P<0.05或P<0.01)。岩藻多糖干预后,与酒精模型组相比,ALT和AST水平分别降低55%(P<0.05)和14%。

图2 岩藻多糖对ALD小鼠血清ALT和AST活力的影响Fig.2 Effect of fucoidan on serum ALT and AST activities in ALD mice
2.3 岩藻多糖对酒精暴露小鼠血脂水平的影响
饮酒与血脂水平密切相关[16-18]。适度的饮酒会提高HDL-C和TG的水平,同时降低LDL-C的水平,而大量饮酒对血脂有不利影响。研究发现,在ALD小鼠体内,酒精可明显升高血清TC、TG和LDL-C的水平,降低血清HDL-C的水平,造成肝脏中的脂质积累[18]。如图3所示,酒精模型组TG、TC、LDL-C和TBA水平较对照组显著升高(P<0.05、P<0.01或P<0.001),分别升高60%、76%、51%和约12 倍。同时,酒精干预也降低了HDL-C水平(P>0.05)。岩藻多糖干预后,血清TG、TC、LDL-C和TBA水平低于酒精模型组(分别下降22%、25%、39%和37%),其中TC、LDL-C和TBA水平差异显著(P<0.05),而HDL-C水平与模型组相比升高(P>0.05)。

图3 岩藻多糖对ALD小鼠血脂水平的影响Fig.3 Effect of fucoidan on blood lipid levels in ALD mice
2.4 岩藻多糖对酒精暴露小鼠炎症因子水平的影响
Szabo等[19]发现酒精诱导的脂多糖激活Toll样受体4受体复合物,然后导致活化B细胞的核因子-κB(nuclear factor κB,NF-κB)途径的下游激活,从而诱导促炎细胞因子和趋化因子的产生,包括TNF-α、IL-1β和IL-6。如图4所示,酒精模型组IL-1β、TNF-α和IL-6水平较对照组显著升高(P<0.05或P<0.01),分别升高46%、55%和约1 倍,但IL-4水平明显降低(P>0.05)。与酒精模型组相比,岩藻多糖干预后IL-1β、TNF-α和IL-6水平显著下降(P<0.05),分别下降23%、49%和36%,此外,IL-4水平明显增加,但没有统计学意义(P>0.05)。

图4 岩藻多糖对ALD小鼠炎性因子的影响Fig.4 Effect of fucoidan on liver inflammatory factors in ALD mice
2.5 岩藻多糖对酒精暴露小鼠Th1、Th2和Th17细胞比例的影响
慢性乙型肝炎的发病机制与Th1/Th2失衡有关。Th1/Th2失衡会促进Th1/Th2细胞分泌炎症因子,降低机体对病毒和细菌的免疫能力,进而加重疾病[20-21]。据报道Th1和Th17细胞与炎症性肠病、多发性硬化和类风湿性关节炎的发病机制有关[22]。Th1和Th17细胞的定量在某些疾病的免疫紊乱研究中起着重要作用[23-24]。IFN-γ、IL-4和IL-17是炎性细胞分泌的特异性细胞因子,Th1主要分泌TFN-γ,Th2主要分泌IL-4,Th17主要分泌IL-17,它们都属于CD4+T淋巴细胞亚群。图5A中IFN-γ比例代表Th1细胞比例,IL-4比例代表Th2细胞比例,图5B中IL-17和CD4双染比例代表Th17细胞比例。与对照组相比,酒精干预后Th1、Th2和Th17细胞比例显著增加(P<0.05或P<0.01)。而在岩藻多糖干预后促炎性Th1、Th2和Th17细胞的比例明显降低,分别降低了18%、27%(P<0.05)和58%(P<0.05)。

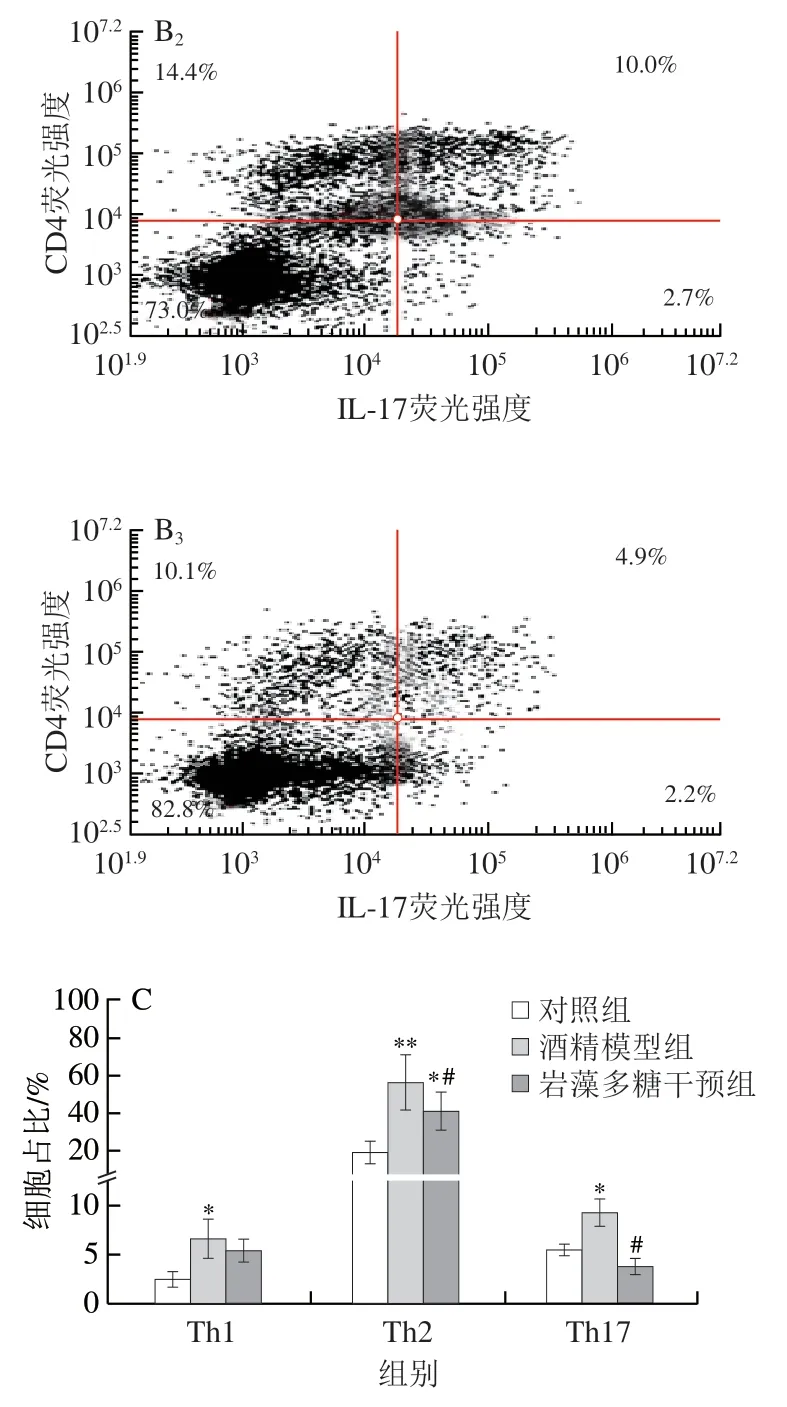
图5 岩藻多糖对Th1、Th2和Th17细胞比例的影响Fig.5 Effect of fucoidan on the proportion of Th1,Th2 and Th17 cells
2.6 岩藻多糖对酒精暴露小鼠自噬蛋白活性的影响
研究酒精对小鼠自噬蛋白活性的影响,证实长期接触酒精可促进p70S6K和eIF4E结合蛋白(eIF4E-binding protein,4EBP1)的磷酸化进而抑制自噬[25]。此外,用体积分数50%乙醇溶液(15 mL/kgmb)持续灌胃小鼠4 周,p62蛋白表达被上调,LC3B II/LC3B I转化率减少,肝细胞自噬被抑制,可见小鼠肝组织脂质积累和氧化应激损伤[26]。另一动物研究也揭示慢性酒精喂养的小鼠肝细胞的溶酶体生物合成和自噬通量水平会减少,其中TFEB的蛋白表达被下调[27]。研究显示,酒精对自噬的抑制机制与mTOR通路有关,酒精可激活mTOR的机制靶点并抑制TFEB的核转位,造成自噬减少进而加重酒精诱导的肝损伤[28]。如图6所示,Western blot结果表明,与对照组相比,酒精干预后p62、p-mTORC1和p-p70S6K磷酸化蛋白表达显著上调(P<0.05或P<0.01),分别增加约9 倍、45%和约1 倍。另外,酒精干预对TFEB和LC3B II蛋白表达有抑制作用,分别降低了42%和39%(P<0.05)。据报道海藻提取物可促进LC3B I向LC3B II的转化,促进Beclin 1的表达,通过降低PI3K/Akt/mTORC1通路关键成分的磷酸化来介导细胞自噬[29]。此外,岩藻多糖作为一种从海藻中提取的硫酸化多糖,已证实其可上调LC3B II/I和TFEB表达,增强p62/SQSTM1选择性自噬,进而抑制NOD结构域样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎性体的激活和细胞脂质积累,减缓颈动脉粥样硬化斑块的进展[30-31]。在体内外实验中,岩藻多糖通过抑制PI3K/Akt/mTOR信号通路,激活自噬,进而抑制小鼠肝癌缺氧诱导的淋巴管生成和淋巴转移,阻止肝癌进一步恶化[32]。研究表明,岩藻多糖能有效降低p62、p-mTORC1和p-p70S6K的蛋白表达(P<0.05)(分别降低26%、24%和39%),明显上调TFEB和LC3B II的蛋白表达(P<0.05)(分别增加51%和35%)(图6)。
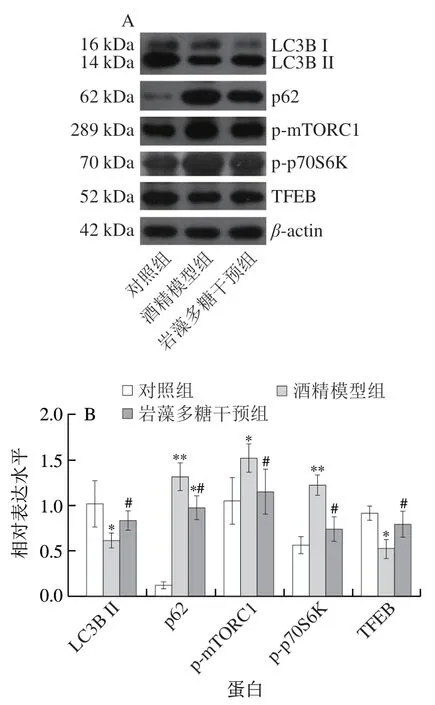
图6 岩藻多糖对ALD小鼠自噬蛋白活性的影响Fig.6 Effect of fucoidan on autophagy-related protein expression in ALD mice
2.7 岩藻多糖对酒精暴露小鼠LC3B蛋白活性的影响
免疫荧光结果(图7)显示,酒精模型组的LC3B蛋白表达水平明显低于对照组,而在岩藻多糖干预后,其LC3B蛋白的表达水平明显高于酒精模型组。肝细胞中LC3B蛋白经荧光染色后被染成红色(即表达阳性),如图8所示,酒精模型组LC3B蛋白表达阳性细胞数水平较对照组降低61%(P<0.05),而岩藻多糖干预后,与酒精模型组相比,LC3B蛋白表达阳性细胞数显著提高(P<0.05),约提高1.5 倍。

图7 免疫荧光分析LC3B蛋白表达水平(400×)Fig.7 Effect of fucoidan on LC3B protein expression analyzed by immunofluorescence (400×)

图8 LC3B蛋白表达阳性细胞数Fig.8 Effect of fucoidan on the number of cells expressing LC3B protein
3 讨论
酒精性肝病因高发生率和死亡率,已成为全球最普遍的慢性肝病类型[33]。ALD是长期大量饮酒所致的一种进行性加重的肝脏疾病,其发病机理复杂,包括酒精及其有毒代谢产物对肝脏的损害作用、氧化应激与脂质过氧化反应、肠道菌群失调和炎症级联应答等[34]。脂肪肝是ALD发生的第一阶段,脂质产物的累积(如TG)导致脂质过氧化和氧化应激,进而诱导肝实质细胞凋亡和肝脏炎症[35]。炎症是ALD的主要特征之一,炎症反应在酒精性肝炎向肝纤维化、肝硬化进展中起着关键性作用。过量饮酒可诱导Kupffer细胞向M1表型转变,后者通过分泌TNF-α、IL-1β、IL-6等促炎细胞因子以及炎症介质招募中性粒细胞、淋巴细胞浸润引起肝内炎症反应[36]。本实验通过8 周酒精灌胃建立ALD小鼠早期病变模型,再给予300 mg/kgmb岩藻多糖进行干预。研究结果表明,酒精干预明显提高了TG、TC、LDL-C、TBA的水平,造成小鼠脂质代谢损伤,而岩藻多糖干预后明显降低小鼠血清TG、TC、LDL-C和TBA的水平,改善了小鼠肝脏脂质代谢紊乱,降低小鼠肝脏脂质毒性,这与Park等[37]发现岩藻多糖可明显降低血清TC、TG和LDL-C水平,改善泊洛沙姆-407诱导的小鼠高脂血症研究结果一致。血清ALT和AST的水平是检测肝损伤常用的敏感指标,ALT和AST的浓度越大,说明肝细胞损伤或坏死越严重[38]。ELISA法检测发现岩藻多糖降低了AST和ALT水平,并有效改善了酒精引起的肝损伤。另外,通过HE染色和透射电子显微镜观察,酒精模型组肝细胞肿胀,有Mallory小体,伴有脂肪变性,以及中央静脉和小叶中央区域可见大量炎性细胞浸润。而岩藻多糖干预后明显改善了肝脏的变形,并恢复了脂肪变性、肿胀和细胞质空泡化等肝细胞不良症状变化,使肝组织的结构趋于正常。
流式细胞仪观察到酒精模型组Th1、Th2和Th17细胞比例显著增加,提示酒精暴露可引起肝细胞炎症。300 mg/kgmb和600 mg/kgmb岩藻多糖干预非肥胖糖尿病小鼠5 周后,明显降低小鼠脾脏IL-1、IL-2、IL-6的水平,也降低Th1型细胞因子数量,下调Th1细胞介导的自身免疫反应[39]。Yang等[40]研究表明,低聚岩藻多糖治疗可降低Th2和Th17细胞数量,减少炎性因子的产生,减少气道炎症。本研究结果也显示岩藻多糖干预后明显降低Th1、Th2和Th17细胞比例。此外,在对小鼠给予酒精灌胃给药8 周后,小鼠肝组织中TNF-α、IL-1β和IL-6水平显著升高,而岩藻多糖干预后TNF-α、IL-1β和IL-6水平显著降低,证实岩藻多糖具有良好的抗炎活性。
Ma Yue等[41]研究显示,用含乙醇的Lieber-DeCarli饮食(前4 周内,乙醇的卡路里从30%增加到36%,每周增加2%)持续喂养小鼠5 周,免疫印迹实验结果证实酒精暴露降低LC3B I的转化,减少了自噬通量水平。在8 周酒精暴露小鼠的研究中,免疫荧光结果也显示酒精降低LC3B荧光表达,同时免疫印迹实验结果也表明酒精明显上调p62、p-mTORC1和p-p70S6K磷酸化蛋白表达,抑制LC3B II/I的转化和TFEB的表达,证实酒精明显抑制小鼠肝细胞自噬。
目前,针对ALD早期患者的治疗方式主要是戒酒、营养支持和药物治疗,因面临戒酒困难,个体遗传差异和药物毒副作用等影响,ALD患者临床总体治疗效果并不理想[42]。因此,迫切需要研究新的特效药物和治疗方法。随着对自噬深入的研究,研究者发现,激活肝细胞自噬是治疗ALD的一种潜在治疗方法。自噬的激活会加速脂质代谢和增加溶酶体中脂滴蛋白和脂质的数量[43]。Saito等[44]研究证实,自噬可通过促进核受体辅阻遏物1(the nuclear receptor corepressors1,NCoR1)的降解进而促进过氧化物酶体增殖剂激活受体-α(peroxisome proliferator-activated receptor-alpha,PPARα)的激活,从而增强β-氧化和酮体的产生,减少脂质氧化受损。此外,酒精代谢会增加体内乙醛、活性氧等有毒代谢产物,引发线粒体损伤,损伤的线粒体会释放线粒体活性氧(mitochondrial reactive oxygen species,mtROS)、mtDNA,进而激活肝巨噬细胞中的NLRP3炎症小体,引发肝炎症反应。而激活自噬清除损伤线粒体可阻止NLRP3炎性体激活,抑制中性粒细胞浸润和炎性因子的分泌进而改善炎症[45]。Yuan Chunlin等[46]研究表明,红景天根可上调自噬蛋白自噬相关4同源物B和LC3B的表达,通过激活自噬促进PPARα、肉碱棕榈酰转移酶1α的表达,增强果糖诱导大鼠的脂肪酸β-氧化,减轻大鼠肝脂肪变性损伤。Kim等[47]发现依折麦布通过AMPK激活和TFEB核易位诱导自噬,抑制NLRP3炎症小体的激活,改善脂肪性肝炎。在本研究中,免疫印迹实验结果显示岩藻多糖干预明显下调了p62、p-mTORC1和p-p70S6K蛋白表达,提高LC3B II/I的转化率,促进TFEB的核转位,表明岩藻多糖通过抑制mTORC1/p70S6K通路促进肝细胞自噬。结果表明,岩藻多糖可能通过激活自噬改善ALD小鼠肝脏脂质毒性和炎症损伤,但其靶向自噬影响脂质代谢和炎症的具体机制在未来还需进一步研究。综上,岩藻多糖可作为预防和治疗酒精性肝病的有效分子。
4 结论
本研究结果表明,岩藻多糖对ALD小鼠早期病变具有改善作用,可减少小鼠肝细胞脂质积累,发挥降脂活性。此外,岩藻多糖也可减少炎性细胞数量和降低炎性因子分泌水平,发挥抗炎活性。另外,岩藻多糖可抑制mTORC1/p70S6K自噬通路,促进肝细胞自噬,抑制ALD小鼠早期病变进展。在机制上,岩藻多糖对ALD小鼠早期病变的改善作用可能与自噬调节有关。因此,合理补充岩藻多糖等海藻类生物活性物质可能是预防ALD的潜在方法。

