自骨密质中分离、培养大鼠骨髓间充质干细胞
边素艳 盖鲁粤 叶 平 郭子宽 王 华 王立生
·论著·
自骨密质中分离、培养大鼠骨髓间充质干细胞
边素艳 盖鲁粤 叶 平 郭子宽 王 华 王立生
目的介绍一种自Wistar大鼠骨密质中分离培养间充质干细胞(Mesenchymal stem cells,MSC)的方法。方法应用骨髓密度梯度离心、酶消化骨密质两种方法分离、培养Wistar大鼠MSC,比较其形态学、体外增殖能力差异;并用碱性磷酸酶染色和油红O染色分别鉴定MSC的成骨和成脂分化潜能。结果采用密度梯度离心骨髓或用酶消化后的骨密质,经贴壁培养后均能够成功分离和培养大鼠的MSC,两者在形态学和体外增殖能力方面无明显差异;且两种方法培养的MSC经特异性诱导剂诱导后,均可向脂肪及成骨细胞分化,油红O染色及碱性磷酸酶染色均阳性。结论自骨髓和骨密质中均能够分离培养出较为纯化的大鼠MSC,两种方法培养的MSC体外生物学性能无明显差异。
大鼠骨髓间充质干细胞骨密质细胞培养
骨髓间充质干细胞(Mesenchymal stem cells,MSC)是一种成体干细胞,能在体内外诱导分化成骨、软骨、肌肉、神经等组织,且易于获得,体外分离培养方法简便,无免疫排斥及伦理问题,目前已成为细胞治疗及组织工程的理想种子细胞[1]。但MSC在骨髓中含量较少,体外扩增能力有限[1]。因此,建立有效的MSC体外分离、扩增、纯化及鉴定体系是该领域研究的重点和基础。
有研究发现,自小鼠骨密质中可成功分离培养MSC,解决了自骨髓中获取MSC的困难。大鼠是实验研究中常用的模型动物,鼠龄越小,体外培养的MSC增殖能力越强,但幼鼠骨髓量少,如果能从大鼠骨密质中分离培养出MSC,且验证它们的生物学性能与骨髓中培养的不存在明显差异,那么将为体外培养、扩增MSC提供另外一条可能的途径,为进一步研究奠定基础,本研究拟通过体外研究对这些问题进行验证。
1 材料与方法
1.1 材料
实验动物为2周龄雌性Wistar大鼠(军事医学科学院实验动物中心提供)。试剂α-MEM培养基(Hyclone公司,美国),特级筛选胎牛血清(Hyclone公司,美国),胎牛血清(北京元亨生物公司),胰酶(Amresco公司,美国),Percoll(Pharmacia公司,美国,比重为1.073 g/L),Ⅱ型胶原酶消化液(Sigma公司,美国,用α-MEM培养基配制,终浓度0.2%),地塞米松、异丁基甲基黄嘌呤和消炎痛(Sigma公司,美国),β-甘油磷酸钠盐和维生素C钠盐(Fluka公司),磷酸对硝基苯酚二钠盐(Amresco公司,美国),BCIP/NBT碱磷酶染色试剂盒(北京中杉金桥生物公司),油红O染料(北京化工厂)。
1.2 实验设备
CO2气体恒温培养箱(Thermo electron公司,美国),超净工作台(北京半导体设备一厂),倒置相差显微镜(Olympus公司,日本),R450型酶标仪(Bio-Rad公司,美国)。
1.3 方法
1.3.1 MSC的分离和培养
骨髓分离培养法:取2周龄的雌性Wistar大鼠2只,断颈处死后以75%乙醇浸泡5 min,移入超净工作台,无菌条件下取出双侧股骨和胫骨,剪去骨骺端,用含10%血清的α-MEM培养基冲出骨髓,离心并弃脂肪层,所获细胞重新用5 mL上述培养基制成细胞悬液,并小心加入含5 mL Percoll分离液(1.073 g/L)的离心管内,保持界面清晰,1 500 r/min离心20 min,小心吸取约1 mL界面细胞层至另一离心管中,用上述培养基重新制成细胞悬液,1 200 r/min离心8 min,反复2次,以洗净细胞悬液中的Percoll,用含10%筛选胎牛血清或普通胎牛血清的α-MEM培养基(含有100 U/mL青霉素,100 U/mL链霉素)重悬并计数细胞,以每孔2×106个细胞接种在6孔板中,37℃、饱和湿度、5%CO2的孵箱内培养。48 h后全量换液,弃未贴壁细胞,以后每3 d换液1次,并用倒置显微镜观察拍照。
骨片培养法:取2周龄的雌性Wistar大鼠2只,用上述方法分离双侧股骨和胫骨,去除骨骺端,用眼科剪剪碎成1 mm3骨片,用0.2%(1 mg/mL)Ⅱ型胶原酶37℃、200 r/min振摇消化1 h,弃消化上清,用α-MEM冲洗骨片3遍,用含10%筛选胎牛血清的α-MEM培养基培养,48 h后换液,倒置显微镜每天观察细胞生长情况。
两种方法均待细胞长至70%~80%融合时,以0.05%的胰蛋白酶消化细胞,并按1∶3的比例传代,对MSC进行增殖与纯化。
1.3.2 细胞生长曲线
将两种方法获得的第3代MSC按3 000个/孔接种于96孔板中,每组每个时间点接种5个复孔,从接种后第1~5天以MTT法检测细胞增殖活性。具体步骤:每孔加入MTT(5 mg/mL)10 μL,37℃培养4 h,吸弃上清后每孔加入DMSO 100 μL,振荡10 min溶解结晶,酶联仪570 nm波长测定光吸收值(OD),并绘制生长曲线。
1.3.3 脂肪和成骨分化诱导[2]及检测
将处于对数生长期的MSC接种于24孔细胞培养板(每孔5 000个)。贴壁培养24 h后,非诱导组继续用完全培养基培养,诱导组应用脂肪诱导培养液(地塞米松1 μmol/L+异丁基甲基黄嘌呤0.5 mmol/L +消炎痛100 μmol/L)或成骨诱导培养液(地塞米松100 nmol/L+β-甘油磷酸钠盐10 mmol/L+维生素C钠盐0.05 mmol/L)进行脂肪或成骨分化诱导,每3天换液,第8天通过油红O染色检测脂质沉积,第14天应用BCIP/NBT染色试剂盒进行碱性磷酸酶(ALP)染色。
1.4 统计学方法
实验结果用均数±标准差(x±s)表示,以STATA 7.0统计分析软件,采用成组t检验进行统计学分析,P<0.05为有显著性差异。
2 结果
2.1 MSC的形态学观察
分离骨髓培养的原代MSC,镜下观察有大量红细胞和有核细胞悬浮于培养液中(图1A);48 h后换液弃去未贴壁的造血细胞,贴壁细胞即为MSC,形态多样,呈梭形、多角形和三角形等;72 h后可见漩涡状或辐射状排列的梭形和三角形细胞集落式生长;第7~10天,细胞增殖迅速,集落中细胞数量增多,呈融合生长,此时可行传代培养(图1B)。
应用骨片培养的MSC,48 h后可见较多梭形或三角形贴壁细胞自骨片周围爬出(图1C);2~5 d后以骨片为中心可见细胞呈放射状集落式生长(图1D);当细胞成融合生长时可进行传代培养。
骨片培养的贴壁细胞数目明显较骨髓分离培养多,易于形成集落。两种方法传代后的MSC形态无明显差异,均呈梭形、三角形、多边形,有长突起,核椭圆形,生长速度无明显差异。10代以前,细胞生长活跃,增殖迅速,均2~4 d传代1次。

图1 大鼠骨髓MSC的形态学观察
2.2 生长曲线
两种方法扩增培养的第3代MSC生长曲线相似(图2)。传代培养1~2 d时,吸光度变化不大,细胞处于潜伏期;第2~3天时,细胞呈对数生长并达高峰;之后,细胞生长均进入平台期。
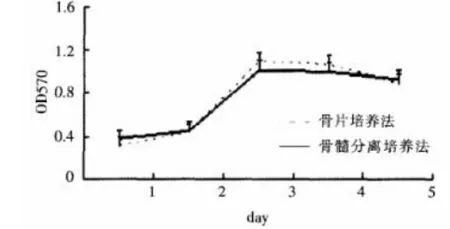
图2 两种方法获得的MSC生长曲线相似
2.3 MSC体外脂肪和成骨分化潜能分析
成脂诱导第8天,细胞形态改变,胞内布满圆形透亮脂质空泡,油红O染色可见脂滴均呈红色深染,说明有大量脂肪细胞生成(图3)。成骨诱导第14天,形成大量扁平状成骨细胞,ALP染色阳性。两种方法培养的MSC,在成脂和成骨分化能力上无明显差异。

图3 大鼠MSC体外脂肪和成骨分化(200×)
3 讨论
MSC数量较为稀少,成人骨髓中的有核细胞含量平均约1/100 000[1]。因此,探索适宜MSC分离、扩增的方法,对进一步研究MSC生物学特性和诱导分化极其重要。
目前,贴壁培养法和密度梯度离心法是较为常用的两种MSC的分离培养方法[3-4]。贴壁法简单,但所获细胞种类复杂,包含有红细胞、巨噬细胞和破骨细胞等多种细胞,不能满足细胞工程对种子细胞的纯度要求。应用密度为1.073 g/mL的Percoll分离液,通过密度梯度离心法,可成功分离出高纯度的骨髓MSC,杂质细胞少,细胞活力相对较强,并能稳定传代且保持其多向分化潜能的特性。密度梯度离心法与贴壁培养法相结合的方法,是目前普遍采用的实验研究或临床应用的培养方法,是根据密度差别,经梯度离心后,有效去除绝大部分红细胞、粒细胞、血小板和脂肪细胞,获得较高纯度的单个核细胞群,然后根据MSC与造血细胞、少量单核-巨噬细胞及成纤维细胞贴壁性能差别,通过换液、对胰蛋白酶消化反应的不同以及传代等方法,可纯化MSC。该方法适用于大动物实验研究或临床应用。而对于小动物,如小鼠或大鼠,由于其骨髓含量少,经密度梯度离心后获得的单个核细胞数目更少,体外分离培养较为困难,故寻求一种简便的方法是实验研究的需要,也可为寻求干细胞的获得新的途径。
郭子宽等[5]以骨片培养法培养小鼠骨髓间充质干细胞,发现骨密质中同样存在广泛的MSC,分离培养后的细胞经鉴定为MSC。本研究将其用于分离培养大鼠MSC,发现此法操作简单,骨髓细胞贴壁率高,细胞形态单一,较易形成集落,传代培养后在细胞形态、生长方式以及体外多向分化潜能上与骨髓法培养法无异,但此法仅适用于较小鼠龄(0~2周)的小鼠或大鼠。需要注意的是,在分离股骨或胫骨时,必须将骨骼肌分离彻底,否则易受骨骼肌细胞污染。
许多细胞的增殖能力在发育的不同阶段明显不同。国内外研究均发现,MSC的数量随年龄增加而逐渐减少,增殖活性随年龄增加而逐渐减低[6]。我们的研究发现,鼠龄越小,分离培养的MSC集落形成率、增殖能力越强。2周龄以上的大鼠均易于获得骨髓,但鼠龄越小分离的MSC体外增殖能力越强。而骨片培养法则适用于乳鼠或4周龄以下幼鼠,但乳鼠股骨分离难度较大,4周龄以上者骨质较硬,不易操作,以2周龄大鼠为宜,且获得的MSC体外扩增能力较强。传代培养绘制生长曲线结果显示,自2周龄幼鼠骨髓或骨片分离培养的第3代MSC,体外增殖能力无明显差异。
因MSC缺乏特异的细胞表面标志,尚无直接方法可鉴定得到MSC。目前MSC鉴定的方法大多是通过排除法,排除CD34(造血干细胞的特异性表面标志)、CD11a(淋巴细胞表面标志)和CD45(白细胞表面标志)等表达,然后逆推得知其是否为MSC[7]。因成骨、成脂分化潜能是MSC的基本生物学特性之一,故用成脂和成骨分化潜能可间接证实MSC的性质,这种方法经济、简单实用,适合作为MSC的鉴定方法。本研究通过体外诱导MSC向脂肪细胞或成骨细胞分化来鉴定MSC的多向分化潜能,间接证实我们分离培养的细胞具备MSC的特性,且同时证实两种不同方法分离培养的细胞在分化潜能上无差异。
综上所述,本实验分别采用骨髓Percoll密度梯度离心和酶消化骨片加贴壁筛选法,均成功分离培养并扩增了大鼠MSC,自骨片(骨密质)中可获得高纯度、具备多向分化潜能的MSC,体外生物学特性与骨髓分离者无显著差异。
[1]Baksh D,Song L,Tuan RS.Adult mesenchymal stem cells: characterization,differentiation,and application in cell and gene therapy[J].J Cell Mol Med,2004,8(3):301-316.
[2]Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cells[J].Sci,1999,284:143-147.
[3]Gront hos S,Zannettino AC,Hay SJ,et al.Molecular and cellular characterization of highly purified stromal stem cells derived from human bone marrow[J].J Cell Sci,2003,116:1827-1835.
[4]Colter DC,Class R,DiGirolamo CM,et al.Rapid expansion of recycling stem cells in cultures of plastic-adherent cells from human bone marrow[J].Proc Natl Acad Sci USA,2000,97(7):3213-3218.
[5]Guo Z,Li H,Li X,et al.In vitro characteristics and in vivo immunosuppressive activity of compact bone-derived murine mesenchymal progenitor cells[J].Stem Cells,2006,24:992-1000.
[6]Mendes SC,Tibbe JM,Veenhof M,et al.Bone tisstle-engineered implants using human bone marrow stromal cells:effect of culture conditions and donor age[J].Tissue Eng,2002,8(6):911-920.
[7]Conget PA,Minguell JJ.Phenotypical and functional properties of huamn bone marrow mesenchymal progenitor cells[J].J Cell Physiol, 1999,181(1):67-73.
Isolation and Culture-Expansion of Rat Compact Bone-Derived Mesenchymal Stem Cells
BIAN Suyan1,GAI Luyue1,YE Ping1,GUO Zikuan2,WANG Hua2,WANG Lisheng2.1 General Hospital of PLA,Beijing 100853,China;2 Department of Experimental hematology,Institute of Radiation Medicine,Academy of Military Medical Sciences,Beijing 100850,China.Corresponding author:WANG Lisheng.
ObjectiveTo introduce a detailed protocol for isolating and expanding mesenchymal stem cells(MSC)from Wistar rat compact bones.MethodsWistar′s MSC were isolated and culture-expanded from bone marrow by Percoll density gradient centrifugation or from compact bone debris by digestion with collagenase type II.The morphological and proliferation features between the two populations of MSC were compared.The in vitro osteogenesis and adipogenesis were identified by intracellular alkaline phosphatase activity and droplets of lipids respectively.ResultsMSC were successfully isolated and culture-expanded by two different methods.Both of these two populations took fibroblast-like morphology and exhibited similar proliferative activity.They could be induced into adipocytes and osteoblasts in vitro under the defined conditions,which were revealed by positive Oil-Red O and alkaline phosphatase staining.ConclusionBoth bone marrow and compact bones could be served as the sources for isolating rat MSC,and the biological properties of the harvested cells are comparable.
Rat;Mesenchymal stem cells;Compact bone-derived;Cell culture
Q813.1+1
A
1673-0364(2010)01-0001-04
2009年11月6日;
2010年1月28日)
10.3969/j.issn.1673-0364.2010.01.001
国家自然科学基金项目(30871018);国家高技术发展规划项目(863项目)(2007AA021007,2007AA02Z454)。
100853北京市中国人民解放军总医院(边素艳,盖鲁粤,叶平);100850北京市军事医学科学院放射医学研究所实验血液学研究室(郭子宽,王华,王立生)。
王立生。

