凝乳酶的研究进展
刘佟, 崔艳华,张兰威,曲晓军
(1.哈尔滨工业大学 食品科学与工程学院,哈尔滨 150090;2.黑龙江省科学院微生物研究所,哈尔滨 150010)
凝乳酶的研究进展
刘佟1, 崔艳华1,张兰威1,曲晓军2
(1.哈尔滨工业大学 食品科学与工程学院,哈尔滨 150090;2.黑龙江省科学院微生物研究所,哈尔滨 150010)
凝乳酶是一种最早在未断奶的小牛胃中发现的天门冬氨酸蛋白酶,可专一地切割乳中κ-酪蛋白的Phe105-Met106之间的肽键,破坏酪蛋白胶束使牛奶凝结,凝乳酶的凝乳能力及蛋白水解能力使其成为干酪生产中形成质构和特殊风味的关键性酶,被广泛地应用于奶酪和酸奶的制作。本文以牛凝乳酶为例介绍了凝乳酶的结构、理化特性和凝乳机理,综述了凝乳酶主要来源以及不同来源凝乳酶之间酶性质差异,旨在为凝乳酶研究提供些许参考。
凝乳酶;凝乳机理;凝乳酶来源;微生物源凝乳酶
0 引 言
随着乳品行业的高速发展,人们对发酵乳制品的需求也日益增加。在干酪生产中,凝乳酶因其可以专一地切割乳中κ-酪蛋白的Phe105-Met106之间的肽键,破坏酪蛋白胶束使牛奶凝结,并由蛋白水解作用产生特有风味,成为重点研究的酶制剂。但由于小牛凝乳酶无法满足现代工业的需求且成本较高,国内外学者致力于寻找动物源凝乳酶的替代品。随着微生物源凝乳酶来源不断扩大,基因技术的不断发展,逐渐成为近年来的研究热点。由于微生物源凝乳酶具有来源广,生长周期短等优点,是最具有发展潜力的方向。
1 凝乳酶结构与理化特性及凝乳机理
1.1 凝乳酶的结构及理化特性
凝乳酶是一种酸性天冬氨酸蛋白酶,分子量介于32 000~49 000 u,主要有A,B,C三种形式,以B形式为主。A与B之间仅相差一个氨基酸位点,A的243氨基酸位点为Asp,而B为Gly,通常认为A和B是由多态基因中的等位基因产生,而不是复等位基因杂交的结果。凝乳酶C是A的自我降解产物,由A自行切除3个残基Asp244—Phe246而产生[1]。还有学者认为,可以根据电泳淌度将凝乳酶(包括前凝乳酶原)分为A、B、C、D四种形式[2]。以小牛凝乳酶为例,凝乳酶一级结构含有323个氨基酸残基,有丰富的二羧基氨基酸和β-羟氨基酸[3];二级结构主要是大量的β折叠和少量的α螺旋;三级结构是大小为40Å×60Å×65Å的晶体,由N端区域和C端区域以双叶折叠形式形成了带有两个活性位点Asp32和Asp215的分裂沟。同时在凝乳酶中含有3个二硫键,分别位于45~50,206~210和249~282,对酶的活性有重要的影响。
凝乳酶的溶解度受pH值、温度和溶液离子强度影响。可溶于pH值为5.5,浓度为1 mol/L的NaCl溶液,晶体结构的凝乳酶在25℃比较稳定,且溶解度随离子强度增强而增强。凝乳酶的等电点为pH值为4.5,在pH值为5.3~6.3最稳定,但pH值为3~4时会因自身降解而活性降低。碱性条件下会发生不可逆的构象变化而使活性降低。组氨酸的氧化作用和赖氨酸的ε-氨基的改变也会轻微影响酶活。在37℃,浓度为4.6 mol/L的尿素培养30 min后其酶活力会降低约一半。另外晶形凝乳酶最为稳定。
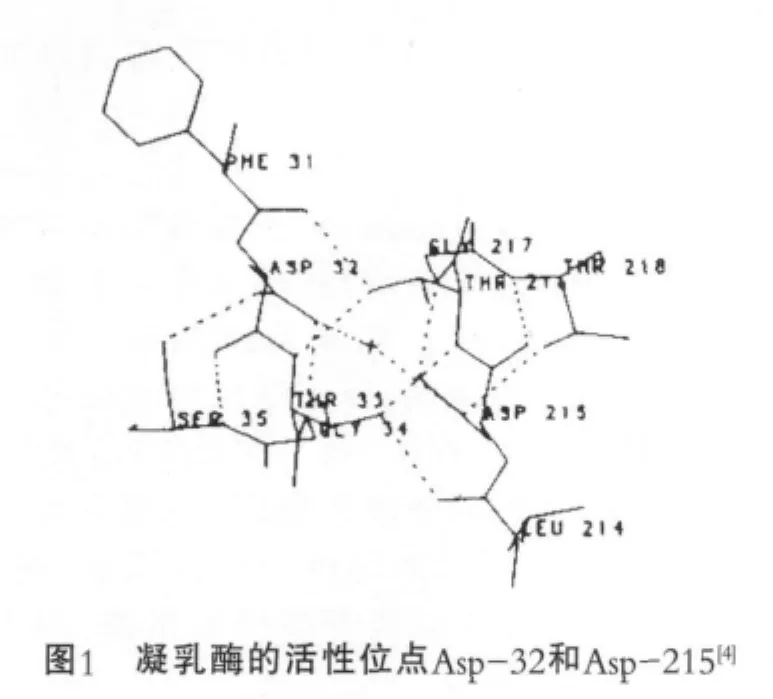
1.2 凝乳酶的凝乳机理
乳中主要存在αS1-酪蛋白 (αS1-CN)、αS2-酪蛋白(αS2-CN)、β-酪蛋白(β-CN)及κ-酪蛋白(κ-CN)4种酪蛋白。αS1-酪蛋白、αS2-酪蛋白和β-酪蛋白是疏水蛋白质,能够被钙离子沉淀,而κ-酪蛋白对钙离子不敏感,并能够形成保护层得到稳定的酪蛋白胶束,从而抑制了α和β酪蛋白的沉淀[5]。酪蛋白胶束本身是由许多直径为80~300 nm的酪蛋白粒子聚合而成,酪蛋白自我联合扩大形成微胶粒,由κ-酪蛋白附着于表面来保持稳定性[6]。凝乳酶的凝乳作用分为两个步骤:第一步是酶专一性的水解乳中κ-酪蛋白多肽链的Phe105-Met106之间的肽键,形成稳定副κ-酪蛋白及亲水性糖巨肽;第二步是当总的κ-酪蛋白被水解掉约80%时,在钙离子存在下通过在酪蛋白胶粒间形成的化学键形成凝块或凝固的乳。这是由于κ-酪蛋白分子位于酪蛋白胶束表面,亚基之间以疏水键和胶体磷酸钙相互作用的方式连接在一起。酪蛋白在凝乳酶的作用下,酪蛋白胶粒表面的κ-酪蛋白分子层部分分解,内部的α,β-酪蛋白失去胶体保护作用成为副酪蛋白,并在钙离子存在下形成不溶性凝块[3,5,6]。
2 凝乳酶的来源
2.1 动物源凝乳酶
凝乳酶最早来源于小牛的第四胃黏膜。Longenbach等阐述了小牛凝乳酶凝乳的生理功能和重要性,反应出凝乳酶的一些生理特性。但由于无法满足现代工业的需求且成本较高,先后开发了多种皱胃酶替代品[7]。研究者连续从其他动物(如猪、羊、狗等)的胃中提取凝乳酶,并通过实验研究证明羔羊皱胃酶凝乳性较低可用乳猪胃酶替代,效果十分理想。Shahidi在格陵兰海豹和鲤鱼的胃中也提取得到了凝乳酶[8]。不同动物来源的凝乳酶的特性存在一定的差异,例如Kumar等人[9]从山羊胃中提取凝乳酶,经纯化后研究发现该凝乳酶的热稳定性高于黄牛凝乳酶,其稳定性与水牛凝乳酶类似。另外在水生动物中也能提取凝乳酶制剂,Shahidi[10]从水生动物中提出多种蛋白酶,其中就包括凝乳酶。由于动物来源的凝乳酶来源不稳定,同时出于对种族、信仰等方面的考虑,研究者已将研究方向转为微生物和植物来源的凝乳酶。
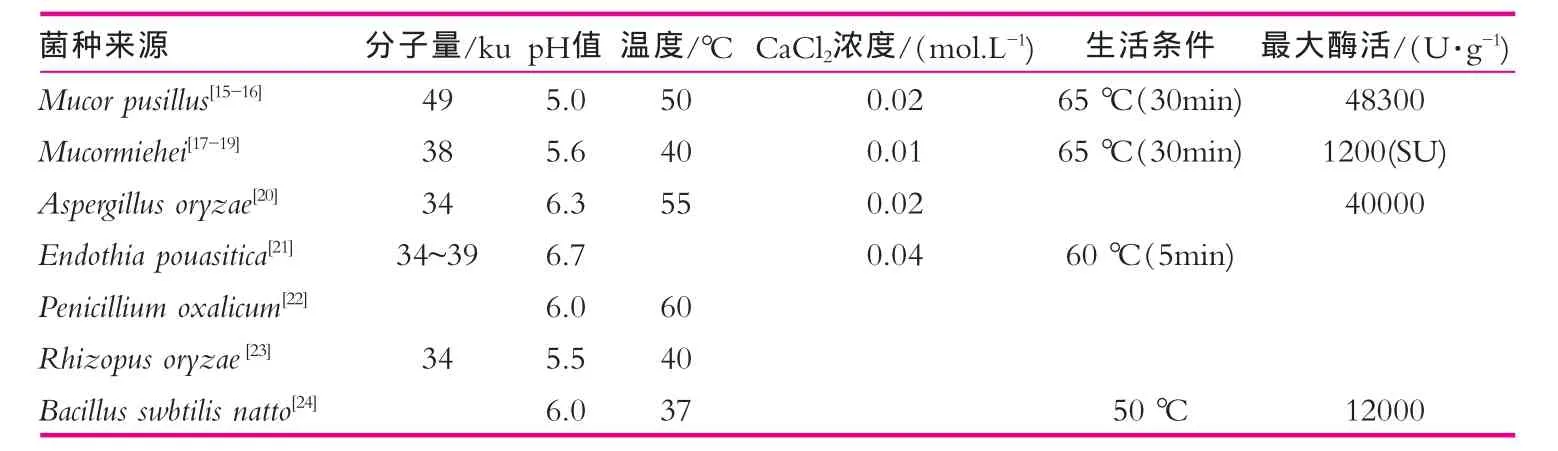
表1 凝乳酸特性及凝乳最适条件
2.2 植物源凝乳酶
许多植物中含有能使乳凝固的蛋白酶,来源非常广泛。目前研究较多的有如下几种,包括木瓜蛋白酶、无花果蛋白酶、菠萝蛋白酶、生姜蛋白酶,合欢蛋白酶,朝鲜蓟蛋白酶等[11]。Chazarra S等人[12]利用朝鲜蓟(洋蓟)提取出3种有凝乳能力的朝鲜蓟蛋白A,B,C作为添加物或替代牛凝乳酶制作干酪,其凝乳能力主要受pH值和温度的影响。同时对A,B,C三种蛋白的凝乳特性进行了比较,发现纯化步骤使A和C的凝乳能力降低,B反而升高,具有更高的活性;从荆棘蓟中获得的凝乳酶多用于La Serena干酪的制作[13]。在干酪生产应用方面,Maria和Malcata证明了植物来源的凝乳酶分解脂肪的能力完全可以替代动物源凝乳酶[14]。研究表明植物蛋白酶有较好的凝乳性,但因水解活力高,在乳制品加工中常出现苦涩感,同时要受到时间、空间、生长周期等诸多条件限制,发展有一定的局限性。
2.3 微生物源凝乳酶
微生物因其具有生长周期短,产量高,受时间、空间限制小,生产成本低,提取方便,经济效益高等优点,是目前凝乳酶来源最有前途的发展方向。目前已发现有40余种微生物可生产一定活力的凝乳酶,主要是真菌、放线菌、细菌等。表1为微生物来源凝乳酶特性及凝乳最适条件。
自1968年Arima发现真菌微小毛霉(Mucor pusillus)可产生高活力的凝乳酶后,国外研究者对真菌来源凝乳酶进行了大量研究。研究者陆续发现毛霉属、曲霉属等真菌可产凝乳酶。我国也在20世纪80年代后期开始对微生物源凝乳酶进行研究[25]。目前广泛得到应用的微生物有微小毛霉、米黑根毛霉、米曲霉、栗疫菌和枯草芽孢杆菌等。郭光远等在云南不同地区,从土样和湖泊底泥中分离出2 500余种菌,最终筛选出一株细菌(枯草芽孢杆菌)和一株真菌(毛霉Y85-8512),酶活力分别达到10 000 U/g和5 000 U/g以上[26]。目前在干酪生产中有1/3都是利用微生物来源的凝乳酶,微生物源凝乳酶最大的一个缺点就是在干酪制作中产生的一些不良风味和苦涩感。
2.3.1 微小毛霉
对于微小毛霉(Mucor pusillus)产凝乳酶的研究,始于1968年。Arim从微小毛霉中提取凝乳酶,并利用离子交换树脂CG-50,葡聚糖凝胶电泳SephadexA-50和Sephadex100纯化粗酶,并使其晶体化。Arim又于1970年对微小毛霉产凝乳酶的特性进行一系列测定,发现其具有高活力,酶活可达到4 650个酶活力单位。Nouani A等人以工业生产的角度从微小毛霉提取纯化出凝乳酶,并以热稳定性、pH值、CaCl2对凝乳能力影响、蛋白水解活力几个方面与传统动物源凝乳酶进行比较。结果证明除了最适温度为50℃,相对于传统凝乳酶的42℃有较大差距,其他特性与传统动物源凝乳酶极为相似,可作为动物来源凝乳酶的替代品用于工业生产。微小毛霉凝乳酶分子量为49 000 u,最适温度50℃,在65℃下加热30 min后酶完全失活[15]。在我国,高维东等人也对微小毛霉(HL-1)凝乳酶的酶学性质进行了研究,发现可用于凝乳酶干酪素和奶酪的生产[16]。
2.3.2 米黑根毛霉
米黑根毛霉(Mucor miehei)产凝乳酶因其R值(凝乳活力与蛋白水解能力之比)较高,获得的高质量和高产量的干酪产品,广泛应用于工业凝乳,当前主要是利用深层发酵获得米黑根毛霉凝乳酶。Beyenal H等人[27]对米黑根毛霉NRRL 3420进行补给D-葡萄糖、无pH值控制长时间连续发酵,确定了操作条件,同时也对凝乳酶应用价值进行分析,其极高的R值具有很大的应用价值。之后,Lima C J等又对米黑根毛霉NRRL 3420产凝乳酶的深层培养条件进行研究,利用干酪乳精中的乳糖和葡萄糖作为碳源对产量的影响,通过响应面方法确定了产酶活力最高为1200 SU,组成质量浓度为20 g/L葡萄糖,4 g/L酪蛋白在pH值为4的条件下培养。其中,糖原对酶活力影响最大[28],并且Silveira1 G G等[17]认为相对于蛋白胨来说,玉米浆是更好的氮源。米黑根毛霉产凝乳酶主要应用于卡门伯特乳酪、伊丹乳酪和切达干酪[18]。
2.3.3 曲霉
曲霉属中米曲霉、黑曲霉、红曲霉等均可以产凝乳酶,其中米曲霉研究与应用比较广泛。我国具几千年的发酵文化,在国内对中国曲产凝乳酶的研究较多。吴进菊从中国曲中分离出酒曲根霉F34菌株,利用Sephadex75纯化粗酶,研究得出F34菌株凝乳酶最适反应温度为50℃,pH值为5.5,Ca2+、Zn2+、Fe2+和Fe3+对凝乳活力有明显促进作用,K+和Mg2+对凝乳活力有微弱的促进作用, 而Na+、Cu2+、Co2+和Li2+对凝乳活力有明显抑制作用[29]。又于2009年对中国曲中凝乳酶高产菌株的筛选及产酶条件的研究,确定了F34菌株产凝乳酶的最佳发酵培养基为:米粉麸皮水解液4.5%,豆粉水解液4.0%,CaCl20.3%,KCl 0.5%(均为质量分数);最适发酵条件:初始pH值为4.5;发酵温度为34℃;培养时间为60 h[30]。邵淑娟等对产凝乳酶黑曲霉JG用微波辐照的方法诱变处理,在酪蛋白培养基上以凝乳圈直径为指标进行初筛;在基础固态发酵培养基上复筛,选育出具有遗传稳定性的突变株WB6-3和WB2-5,其凝乳活力分别提高了35%和14%[31]。范素琴采用酪蛋白平板法和Arima时间法筛选出1株产生凝乳酶能力强的菌株M5,并通过正交试验对该霉菌产凝乳酶发酵条件进行了初步优化[32]。
2.3.4 栗疫菌
栗疫菌 (Endothia parasitica)产凝乳酶研究相对较少。Sardinas J L在381株细菌和540株真菌中筛选出了一株栗疫菌可产凝乳酶。栗疫菌凝乳酶具有晶体构型,能够溶于水和有机溶剂;分子量在34 000~39 000 u;等电点为pH值为4.5;在60℃下加热5 min便完全失活;在pH值为5的水溶液中最为稳定。在凝乳酶的蛋白水解作用中,栗疫菌凝乳酶能够产生丙氨酸、精氨酸、谷氨酸、异亮氨酸、天冬氨酸等多种氨基酸,但不能产生色氨酸[21]。
2.3.5 枯草芽孢杆菌
枯草芽孢杆菌(Bacillus subtilis)是一种非常重要的产酶菌,主要得益于它能够产生和分泌大量胞外酶。虽然当前枯草芽孢杆菌并非主要微生物来源凝乳酶产生菌,但因其在焙烤食品中有较高凝乳活力,所以枯草芽孢杆菌产凝乳酶相关研究具有深远意义[24]。胡永金等从云南某地奶牛场土壤中分离出22株R值较高的产凝乳酶细菌。通过观察形态、生理生化实验、16sRNA序列分析和系统发育分析确定该菌株为枯草芽孢杆菌[33]。丁明亮等对枯草芽孢杆菌产凝乳酶发酵条件通过单因素试验和响应面法进行了优化,得出最优发酵工艺:葡萄糖添加量16.2 g/L(质量浓度)、接种量0.130%(体积分数)、发酵时间120.34 h,所得酶活力(1129.05±74.55)SU/mL[34]。
2.4 基因工程凝乳酶
基因工程凝乳酶即将凝乳酶基因连接到合适载体并转入宿主中所表达产生的酶。目前最常用的宿主是大肠杆菌(Esherichia coli),但是表达的凝乳酶主要以包涵体的形式,需要复性,因此增加了成本。以酿酒酵母为宿主,可形成20%可直接利用的可溶性凝乳酶原,另外80%残留于细胞残片[35]。Maria将凝乳酶原在酿酒酵母中表达出来,可以作为山羊凝乳酶的替代品[36]。Stefan利用在黑曲霉中表达,发酵产生单驼峰凝乳酶,经过与小牛凝乳酶比较发现,重组单驼峰凝乳酶的凝结能力高于小牛凝乳酶70%,且有更高的的耐热稳定性[37]。之后Bansa利用这一结论使用重组单驼峰凝乳酶加工Cheddar干酪,根据干酪特性与传统方法进行比较,显示出并无明显差异[38]。此外,丝状真菌、微小毛霉、米黑根毛霉、构巢曲霉都适用于转入凝乳酶基因[39]。
3 结束语
本文综述了不同来源的凝乳酶及其相应的酶学性质,微生物源凝乳酶因周期短,产量高,受时间、空间限制小,生产成本低,提取方便,经济效益高等优点,是目前凝乳酶来源最有前途的发展方向,开发可产凝乳酶的新菌株和诱变产生高产菌株将成为日后的研究热点。随着基因技术的不断发展,基因工程凝乳酶除具有传统凝乳酶的优点之外,还可根据需求进行改造,因此具有不可估量的发展前景。随着我国消费者对干酪的认识不断加深,健康消费观念的普及,干酪产业具有极大的市场潜力,也为凝乳酶的工业化提供了发展机遇。
[1]FOLTMANN B.A Review on Prorennin and Rennin[J].Proceedings of the Biochemical Society,1966:3-4.
[2]RAMPILLI M,LARSENB R,HARBOE M.Natural Heterogeneity of Chymosin and Pepsin in Extracts of Bovine Stomachs[J].International Dairy Journal,2005,15:1130-1137.
[3]CHITPINITYOL S,CRABBE M J C.Chymosin and Aspartic Proteinases[J].Food Chemistry,1998,61(4):395-418.
[4]NEWMAN M,SAFRO M,FRAZAO C,et al.X-ray Analyses of Aspartic Proteinases IV:Structure and Refinement at 2.2 Å resolution of Bovine Chymosin[J].Journal of Molecular Biology,1991,221:1259-1309.
[5]朱仁俊,石振兴,甘伯中,等.凝乳酶的研究进展[J].中国乳品工业,2010,38(1):39-42.
[6]SANDRA S,ALEXANDER M,DALGLEISH D G.The Rennet Coagulation Mechanism of Skim Milk as Observed by Transmission Diffusing Wave Spectroscopy[J].Journal of Colloid and Interface Science,2007,308:364-373.
[7]LONGENBACH J I,HEINRICHS A J.A Review of the Importance and Physiological Role of Curd Formation in the Abomasum of Young Calves[J].Animal Feed Science and Technology,1998,73:85-97.
[8]HAN X Q,SHAHIDI F.Extraction of Harp Seal Gastric Proteases and their Immobilization on Chitin[J].Food Chemistry,1995,52:71-76.
[9]KUMAR A,SHARMA J,MOHANTY A K,et al.Purification and Characterization of Milk Clotting Enzyme from Goat(Capra hircus)[J].Comparative Biochemistry and Physiology,2006,145:108-113.
[10]SHAHIDI F,JANAK K Y V A.Enzymes from Fish and Aquatic Invertebrates and their Application in the Food Industry[J].Trends in Food Science and Technology,2001,12:435-464.
[11]HASHIMA M M,DONG M,MUHAMMAD F I,et al.Ginger rhizome as a Potential Source of Milk Coagulating Cysteine Protease[J].Phytochemistry,2011,72:458-464.
[12]CHAZARRA S,SIDRACH L,DOROTEA L M,et al.Characterization of the Milk-Clotting Properties of Extracts from Artichoke(Cynara scolymus,L.)Flowers[J].International Dairy Journal,2007,17:1393-1400.
[13]ROA I,BELENV L M,MENDIOLA F J.Residual Clotting Activity and Ripening Properties of Vegetable Rennet from Cynara cardunculus in La Serena Cheese[J].Food Research International,1999,32:413-419.
[14]MARIA J S,MALCATA F X.Ripening of Ovine Milk Cheeses:Effects of Plant Rennet,Pasteurization and Addition of Starter on Lipolysis[J].Food Chemistry,1997,59(3):421-432.
[15]NOUANI A,BELHAMICHE N,SLAMANI R,et al.Extracellular Protease from Mucor pusillus:Purification and Characterization[J].Society of Dairy Technology,2009,62:112-117.
[16]高维东,甘伯中,丁福军,等.微小毛霉凝乳酶的酶学性质研究[J].食品科学,2010,31(03):185-188.
[17]SILVEIRA1 G G,OLIVEIRA1 G M,RIBEIRO E J,et al.Microbial Rennet Produced by Mucor miehei in Solid-State and Submerged Fermentation[J].Brazilian Archives of Biology and Technology,2005,48(6):931-937.
[18]REPS A,JEDRYCHOWSKI L,WISNIEWSKA K,et al.Application of a Coagulating Preparation Obtained with Rhizomucor Miehei N in Cheese-making[J].Pakistan Journal of Nutrition,2006,5(2):97-101.
[19]PREETHA S,BOOPATHY R.Purication and Characterization of a Milk Clotting Protease from Rhizomucor miehei[J].World Journal of Microbiology and Biotechnology,1997,13:573-578.
[20]KURUTAHALLI S V,RAO A G A,SINGH S A.Production and Characterization of a Milk-clotting Enzyme from Aspergillus oryzae MTCC 5341[J].Applied Microbiology and Biotechnology,2010,85:1849-1859.
[21]SARDINAS J L.Rennin Enzyme of Endothia parasitica[J].Journal of Applied Microbiology,1968:248-255.
[22]AMAL M H.Optimization of Milk-clotting Enzyme Productivity by Penicillium Oxalicum[J].Bioresource Technology,1999,70:203-207.
[23]KUMAR S,SHARMAA N S,SAHARANB M R,et al.Extracellular Acid Protease from Rhizopus oryzae:purification and Characterization[J].Process Biochemistry,2005,40:1701-1705.
[24]SHIEHA C J,THIB L A P,SHIH I L.Milk-clotting Enzymes Produced by Culture of Bacillus subtilis natto[J].Biochemical Engineering Journal,2009,43:85-91.
[25]周俊清,林亲录,赵谋明.微生物源凝乳酶的研究进展[J].中国食品添加剂,2004,2:6-9.
[26]马俊,姜成林,郭光远,等.微生物凝乳酶的研究Ⅱ.酶学性质[J].微生物学通报,1989:340-343.
[27]SEKER S,BEYENAL H,AYHAN F,et al.Production of Microbial Rennin from Mucor miehei in a continuously Fed Fermenter[J].Enzyme and Microbial Technology,1998,23:469-474.
[28]LIMA C J B D,CORTEZI M,ROBERTA B,et al.Production of Rennet in Submerged Fermentation with the Filamentous Fungus Mucor miehei NRRL 3420[J].World Applied Science Journal,2008(4):578-585.
[29]吴进菊,徐尔尼,陈卫平,等.酒曲根霉F34菌株凝乳酶的初步纯化及部分酶学性质的研[J].食品工业科技,2008,29(09):135-137.
[30]吴进菊,徐尔尼,张凤英,等.中国曲中凝乳酶高产菌株的筛选及产酶条件的研究[J].中国食品学报,2009,9(1):124-129.
[31]邵淑娟,李铁柱,李倬林,等.产凝乳酶黑曲霉J G的微波诱变育种研究[J].中国酿造,2010,7:47-50.
[32]范素琴,王成忠,杨爱华,等.红曲米中凝乳酶产生菌的筛选及液态发酵条件的优化[J].中国酿造,2009,9:25-28.
[33]胡永金,石振兴,朱仁俊,等.一株产凝乳酶细菌的分离与鉴定[J].中国酿造,2010,5:81-84.
[34]丁明亮,欧阳安然,王望斐,等.枯草芽孢杆菌产凝乳酶发酵条件的优化[J].食品科学,2011,32(03):156-160.
[35]NEELAKANTAN S,MOHANTY A K,KAUSHIK J K.Production and Use of Microbial Enzymes for Dairy Processing[J].Current Science,1999,77(1):143-148.
[36]MARIA C V,ALICIA G C,VILLAR J,et al.Molecular Cloning and Expression in Yeast of Caprine Prochymosin[J].Journal of Biotechnology,2004,114:69-79.
[37]STEFAN R K,BRINK H,HENRIK R N,et al.Characterization of Recombinant Camel Chymosin Reveals Superior Properties for the Coagulation of Bovine and Camel Milk[J].Biochemical and Biophysical Research Communications,2006,342:647-654.
[38]BANSAL N,DRAKE M A,PIRAINO P,et al.Suitability of Recombinant Camel(Camelus dromedarius)Chymosin as a Coagulant for Cheddar Cheese[J].International Dairy Journal,2009,19:510-517.
[39]张红梅.凝乳酶的研究进展[J].同济大学学报,2004,25(3):254-257.
Research advancement of chymosin
LIU Tong1,CUI Yan-hua1,ZHANG Lan-wei1,QU Xiao-jun2
(1.School of Food Science and Engineering,Harbin Institute of Technology,Harbin 150090,China;2.Institute of Microbiology,Heilongjiang Science Academy,Harbin 150010,China)
Chymosin(rennin;EC 3.4.23.4)belongs to a aspartic proteinase family which was found in unweaned bovine stomachs at first.It can specifically cleave the κ-casein at the Phe105-Met106peptide bond to broke the casein micelles causing milk-clotting.In cheese production,chymosin plays an important role as the key enzyme in milk-clotting and processing of texture and flavour.The structure,physicochemical characteristics and milk coagulation mechanism of bovine chymosin were reviewed in this paper.Otherwise,the source of chymosin and the diversity from different sources were discussed.
chymosin;milk coagulation mechanism;chymosin source;microbial chymosin
Q935
B
1001-2230(2011)08-0040-04
2011-06-07
国家自然科学基金资助项目(30901048)。
刘佟(1987-),女,硕士研究生,主要从事分子微生物学研究。
张兰威

