不同处理对Lactobacillus delbrueckii subsp.Bulgaricus LB细胞膜脂肪酸的影响
李扬,李妍,刘艳,袁栋栋,张列兵,杨瑞学
(1.中国农业大学 食品科学与营养工程学院,北京 100083;2.中国农业机械化科学研究院,北京 100083)
不同处理对Lactobacillus delbrueckii subsp.Bulgaricus LB细胞膜脂肪酸的影响
李扬1,李妍1,刘艳1,袁栋栋1,张列兵1,杨瑞学2
(1.中国农业大学 食品科学与营养工程学院,北京 100083;2.中国农业机械化科学研究院,北京 100083)
研究了pH值为6.0(温度为32,37,42和42℃),pH值为5.0和5.5五种培养条件、两个不同生长阶段对Lb.delbrueckii subsp.Bulgaricus LB细胞膜脂肪酸组成的影响,以及冷冻干燥过程中细胞膜脂肪酸组成的变化。实验菌株Lb.LB中主要检测到8种脂肪酸。不同处理条件下Lb.LB细胞膜脂肪酸种类一样,但质量分数存在差异。C12:0和C19cyc9质量分数差异最大,变化范围分别为0.86%~2.16%和4.03%~7.51%。冷冻干燥过程中Lb.LB细胞膜中各脂肪酸质量分数变化甚微。
德氏乳杆菌保加利亚亚种;细胞膜;脂肪酸;冷冻干燥
0 引 言
德氏乳杆菌保加利亚亚种 (Lb.delbrueckii subsp.Bulgaricus)是酸奶生产中常用菌种之一,经冻干后以干粉形式存在,可直接用于发酵乳制品生产。
在较低的温度和pH值下培养时,乳酸菌细胞的冻干耐受性较高[1,2];且处于稳定期不同阶段的乳酸菌细胞,其对冻干的耐受性也不相同[3]。Wang Yu等认为调节细胞膜脂肪酸组成是乳酸菌细胞在胁迫 (stress)环境下自我保护的首选措施[4]。细胞膜中不饱和脂肪酸含量较高时,细胞冻干耐受性较好[5-7]。因此,研究不同条件培养及稳定期不同阶段对乳酸菌细胞膜脂肪酸组成的影响,可以为改善乳酸菌冻干存活率提供一定的理论参考。本文针对这一问题展开研究,并进一步探讨了不同条件培养的Lb.LB细胞在冷冻干燥过程中膜脂肪酸组成的变化。
1 实 验
1.1 材料
菌种:德氏乳杆菌保加利亚亚种 (Lb.delbrueckii subsp.Bulgaricus LB,Lb.LB),实验室保藏菌种。
MRS液体和固体培养基[8]:121℃,15 min灭菌,分别用于菌种活化和活菌计数。
改良MRS培养基:121℃,15 min灭菌,用于菌体培养,实验室改良配方。
菌种保藏:悬浮于灭菌(115℃,15 min)的10%脱脂乳(含1%谷氨酸钠)中,于-40℃冰箱冻存,每次使用前活化。
菌种活化:取原始菌种以质量分数为1%接种量接种至MRS液体培养基中,37℃培养12 h,再以质量分数为1%的接种量连续传代两次后,以质量分数为2%接种量接种至改良MRS液体培养基中培养。
1.2 主要设备
BIOTECH-5BGZA自动发酵罐 (上海保兴)、TGL-20M冷冻离心机 (长沙平凡)、LGJ-10D冷冻干燥机(北京四环)。
1.3 方法
1.2.1 不同条件下Lb.LB的培养
采用5 L全自动发酵罐于pH值为6.0(温度为32,37,42和42℃),pH值为5.0和5.5培养Lb.LB,取对数期末稳定期初期悬液,3 000 g,15 min离心;按菌泥︰保护剂(质量浓度比)=1︰(5~6)比例添加保护剂。-80℃预冻13 h,真空干燥24 h,冷阱温度≤55℃,真空度1.0 Pa。
1.2.2 活菌数测定
采用平板计数法,37℃,MRS固体培养基上培养48~72 h后计数。
1.2.3 细胞膜脂肪酸的测定
(1)细胞膜脂肪酸的提取。
分别取预冻前、预冻后干燥前、干燥后菌液2 mL,5 000 g,10 min离心,菌体细胞用相同体积的无菌水洗涤两次。在Rozes脂肪酸提取方法的基础上略作改动[9,10],即上述菌泥中加入1 mL浓度为1 mol/L甲醇钠的甲醇溶液,剧烈振荡1 min,加入1.8 mL正己烷溶液,振荡20 s,2000 g,5 min离心后,取上清,-40℃冰箱密封保存待测。
(2)气质条件。
使用气质联仪分析Lb.LB细胞膜脂肪酸组成,毛细管柱为HP-5MS,0.25 mm×30 m×0.25 μm,载气为高纯氦气,进样量1 μL,不分流进样。
进样口温度250℃,柱流速1 mL/min,柱起始温度60℃,保持1 min,以8℃/min升至200℃,保持2 min,再以15℃/min升至280℃,保持4 min。
质谱条件:用电子轰击源(EI)分析,电子能量70 eV。
1.2.4 脂肪酸质量分数计算
Lb.LB菌株细胞膜脂肪酸峰面积总和认为是100%,根据每种脂肪酸峰面积占总峰面积的比例计算脂肪酸的相对质量分数,即
某种脂肪酸质量分数=某脂肪酸峰面积/脂肪酸峰面积总和×100%。
1.2.5 数据统计分析
本文中脂肪酸数据为两次平行实验的平均值。实验使用spss17.0进行差异显著性分析。
2 结 果
实验菌株保加利亚乳杆菌Lb.LB细胞膜中主要检测到八种脂肪酸,分别为十二烷酸(C12:0)、十四烷酸(C14:0),十六烯酸(C16:1),十六烷酸(C16:0),十八烯酸(C18:1),十八烷酸(C18:0),十八碳二烯酸(C18:2),dihydrosterculic(9,10-methyleneoctadecanoic,C19cyc9),这些脂肪酸都是乳酸菌细胞膜中常见的脂肪酸[11-13]。
2.1 不同培养条件下Lb.LB细胞膜脂肪酸组成
培养温度对Lb.LB细胞膜脂肪酸组成的影响较大(表1)。 除C14:0和C16:1外,3种不同温度培养的Lb.LB细胞膜中其他6种脂肪酸含量均发生了明显变化 (P<0.05),并且不同脂肪酸随温度的变化规律不同。C12︰0在32℃培养的Lb.LB细胞膜中的质量分数显著高于另2种温度。C16︰0和C18︰1在37℃培养Lb.LB细胞膜中质量分数最高,在42℃培养时质量分数最低;而C18︰0和C18︰2则正相反,在37℃培养的Lb.LB细胞膜质量分数最低,在42℃培养时质量分数最高;C19cyc9在37℃培养的Lb.LB细胞膜中质量分数最高,42℃培养次之,32℃培养时质量分数最低。

表1 不同温度培养时Lb.LB细胞膜脂肪酸的组成
不同pH值培养对Lb.LB细胞膜脂肪酸质量分数也有显著影响(见表2),除C16︰0和C18︰1之外,其他细胞膜脂肪酸的质量分数都因pH值的变化而发生显著变化(P<0.05)。C19cyc9质量分数随着pH值的升高而增加,其他脂肪酸随pH值变化没有明显规律。C12︰0在pH值为5.5培养的Lb.LB细胞膜中质量分数最高,而pH值为6.0培养时质量分数最低。C14︰0和C18︰0在pH值为5.0培养的Lb.LB细胞膜中质量分数最高,在pH值为5.5培养时质量分数最低;而C16:1、C18:2在pH5.0培养的Lb.LB细胞膜中质量分数最低,在pH5.5培养时含量最高。
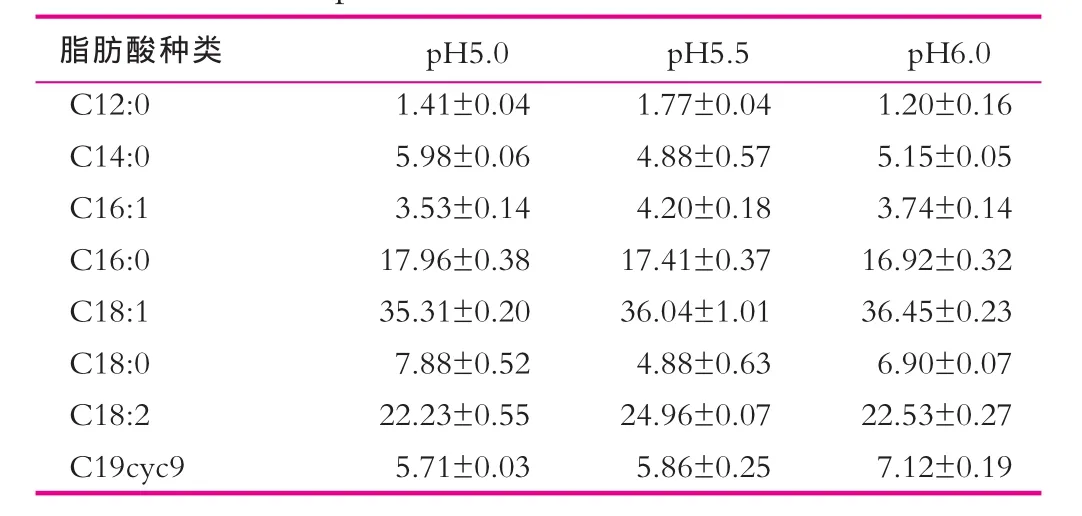
表2 不同pH培养时Lb.LB细胞膜脂肪酸的组成
2.2 不同生长阶段Lb.LB细胞膜脂肪酸组成
乳酸菌增殖培养通常在菌体生长的稳定期收获菌体,并进一步处理制备冻干发酵剂[14-16]。本研究针对稳定期不同阶段Lb.LB细胞膜脂肪酸组成的变化进行分析,结果如表3所示。稳定期初期与中期收获的Lb.LB细胞膜脂肪酸含量无显著差异(P>0.05)。
2.3 冻干中Lb.LB细胞膜脂肪酸组成的变化
结果表明,与培养过程相比,在冷冻干燥过程中Lb.LB细胞膜脂肪酸种类无变化,但某些脂肪酸含量发生了一定变化,并且这种变化因菌株的培养温度和pH值条件的不同而不同,如图1和图2所示。
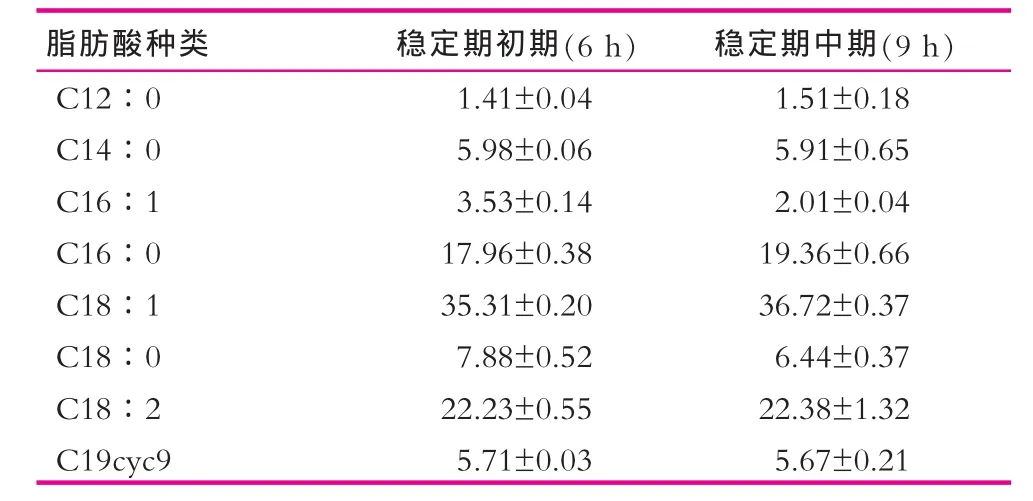
表3 不同生长阶段Lb.LB细胞膜脂肪酸的组成
图1中,pH值控制在6.0,从上至下3个培养温度依次为32,37,42℃。
图2中,温度控制在42℃,从上至下3个培养pH值依次为5.0,5.5,6.0。
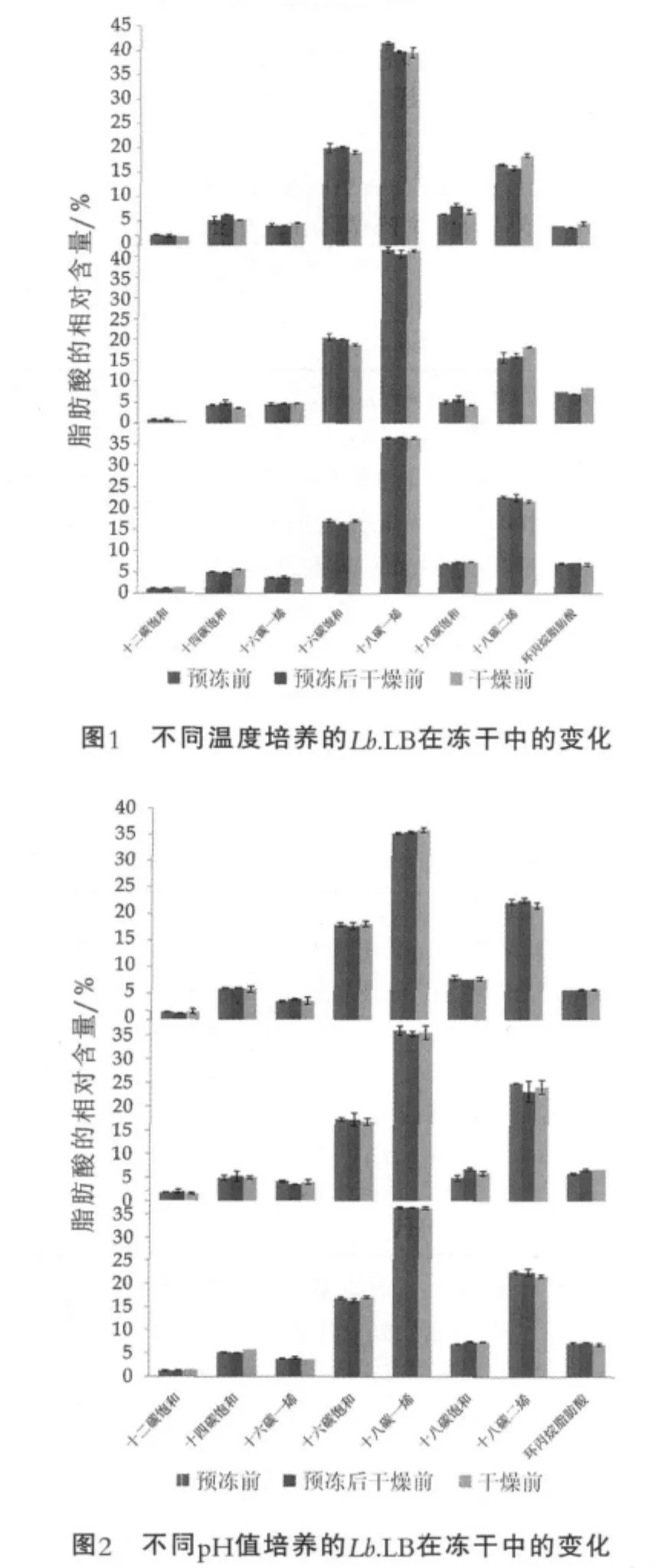
由图1和图2可以看出,在32,37,42℃培养的菌株经冻干后细胞膜中C18︰2,C19cyc9和C18︰0质量分数分别有所增加,统计学差异显著(P<0.05),其他脂肪酸质量分数无显著变化。pH值为5.0培养,细胞膜脂肪酸组成无显著变化(P>0.05)。pH值为5.5培养,预冻后C18︰0质量分数增加,冻干后C19cyc9质量分数增加,差异显著(P<0.05),其他脂肪酸质量分数无显著差异。
3 讨 论
3.1 不同培养条件对Lb.LB的影响
有研究结果表明,微生物细胞处于不同环境中,其细胞膜脂肪酸组成不同[17]。从本文实验结果来看,不同温度和pH培养下Lb.LB细胞膜脂肪酸的含量不同,但其含量变化与培养温度和pH无线性关系。本实验中在32℃和37℃培养下Lb.LB细胞膜不饱和脂肪酸C16:1和C18:1的含量高于42℃培养,而C18:2质量分数低于42℃培养;pH6.0培养下Lb.LB细胞膜C19cyc9的含量高于5.0培养,这与Li Chun等报道的结果类似,他们发现当培养pH值控制在6.0时,较低温度(30℃)培养下Lactobacillus bulgaricus L2细胞膜中C16:1和C18:1质量分数高于较高温度(39℃)培养,而C18:2含量略低于较高温度培养。当培养温度控制在39℃时,pH值为6.0培养下其细胞膜中cycC19:0质量分数高于pH值为5.0培养[12]。本研究中还发现,在较低温度(32℃)培养下Lb.LB细胞膜C12:0的质量分数较高,可能与Lb.LB细胞在较低温度下的自我调节有关,Chiara Montanari等发现L.sanfranciscensis细胞在低温下可通过减短膜脂肪酸碳链链长,增加短链脂肪酸(C12:0)的质量分数以维持细胞膜正常的生理功能[18]。
3.2 不同生长阶段对Lb.LB的影响
有研究证实,不同生长阶段的微生物细胞膜脂肪酸的组成不同,且不同种属微生物之间,这种脂肪酸组成的变化也不相同[16]。但多数报道都认为不同生长阶段细胞冻干存活率的差异和细胞膜脂肪酸组成有关[16,17]。在本研究中,Lb.LB在稳定期初期和稳定期中期细胞膜脂肪酸组成无显著差异(P>0.05),这可能是由于研究所用菌株与之前文献报道的不同,或者所取的样本都处于稳定期内的原因所致。然而,分别在这两个阶段收集的Lb.LB菌体细胞经冷冻干燥后的存活率却明显不同(数据未给出),这说明除细胞膜脂肪酸之外,可能还有其他因素影响菌体细胞在冷冻干燥过程中的存活。
3.3 Lb.LB在冷冻干燥过程中的变化
关于保加利亚乳杆菌冻干过程中细胞膜脂肪酸组成变化的研究较少,本研究分析了不同培养条件下Lb.LB在冻干中细胞膜脂肪酸质量分数的变化,发现冻干中多数细胞膜脂肪酸质量分数未发生变化,只有少数样本的脂肪酸含量增加,幅度也不大。温度为32℃(pH值为6.0)和温度37℃(pH值为6.0),温度为42℃(pH值为5.5)培养下Lb.LB细胞冻干后细胞膜中C18︰2和C19cyc9质量分数分别增加,这可能与Lb.LB菌体细胞膜在冻干胁迫条件下的自我调节有关。有研究认为,微生物细胞面对环境胁迫时,会通过细胞膜脂肪酸的去饱和、形成分支、减短碳链链长或形成环丙烷脂肪酸来维持细胞膜正常的生理功能[12、19-21]。在不饱和和环状脂肪酸质量分数增加同时,我们发现42℃,pH值为6.0培养Lb.LB细胞冻干后饱和脂肪酸C14︰0和C18︰0质量分数也有所增加,Castro等研究也发现37℃培养Lactobacillus bulgaricus冻干后细胞膜饱和脂肪酸含量增加[9],其原因目前还不清楚。
4 结 论
当温度为30~42℃和pH值为5.0~5.5波动时,Lb.LB细胞膜脂肪酸的质量分数变化明显,培养温度对Lb.LB细胞膜脂肪酸质量分数的影响比培养pH值大,其中,C12:0和C19cyc9质量分数差异最大,变化范围分别为0.86%~2.16%和4.03%~7.51%。两个不同生长阶段(稳定期初期与稳定期中期)Lb.LB细胞膜脂肪酸的组成无显著差异。在实验选择的冻干工艺下,不同条件培养的Lb.LB在冷冻干燥过程中细胞膜脂肪酸组成的变化不相同,且变化甚微。冻干中细胞的自我调节机制还不明确,需要进一步研究。
[1]BEAL C,FONSECA F,CORRIEU G.Resistance to Freezing and Frozen Storage of Streptococcus thermophilus is Related to Membrane Fatty Acid Composition[J].J.Dairy Science,2001,84:2347-2356.
[2]LEILA B,CATHY F G,DANIEL A.Study of the Cryotolerance of Lactobacillus acidophilus:Effect of Culture and Freezing Conditions on the Viability and Cellular Protein Levels[J].International Journal of Food Microbiology,2000,59:241-247.
[3]山丽杰.利用真空冷冻干燥技术制备高效浓缩型酸奶发酵剂的研究[D].河北农业大学,2004.
[4]WANG Y,JEROME D,ALAIN G,et al.Influence of Cooling Temperature and Duration on Cold Adaptation of Lactobacillus Acidophilus RD758[J].Cryobiology,2005,50:294–307.
[5]李宗军.大肠杆菌生长温度、膜脂肪酸组成和压力抗性之间的关系[J].微生物学报,2005,45(3):426-430.
[6]朱琳,刘宁,张英华,等.乳酸菌细胞膜的冻干损伤[J].食品科学,2006,27(2):2660269.
[7]ASA S,JANETT F,HERMANN J H,et al.Impact of Fermentation pH and Temperature on Freeze-drying Survival and Membrane Lipid Composition of Lactobacillus Coryniformis Si3[J].J Ind Microbiol Biotechnol,2008,35:175–181.
[8]DE M J C,ROGOSA M,SHARPE M E A.Medium for the Cultivation of Lactobacilli[J].J.Appl.Bacteriol,1960,23(1):130-135.
[9]CASTRO H P,TEIXEIRA P M,KIRBY R.Evidence of Membrane Damage in Lactobacillus Bulgaricus following Freeze-Drying[J].Journal of Applied Microbiology,1997,82:87-94.
[10]ROZES N,SANDRINE G,MURIEL D,et al.A Rapid Method for the Determination of Bacterial Fatty Acid Composition[J].Journal of Applied Microbiology,1993,17:126-131.
[11]ELISABETTA G,ROSALBA L,SANDRO C.Alteration in Cellular Fatty Acid Composition as a Response to Salt,Acid,Oxidative and ThermalStressesinLactobacillusHelveticus[J].Microbiology,2001,147:2255-2264.
[12]LI C,ZHAO J L,WANG Y T,et al.Synthesis of Cyclopropane Fatty Acid and its Effect on Freeze-drying Survival of Lactobacillus bulgaricus L2 at Different Growth Conditions[J].WorldJ.Microbiol Biotechnol,2009,25:1659-1665.
[13]SMITTLE R B,GILLILAND S E,SPECK M L,et al.Relationship of Cellular Fatty Acid Composition to Survival of Lactobacillus bulgaricus in Liquid Nitrogen[J].Journal of Applied Microbiology,1974,27(4):738-743.
[14]常金梅,蔡芷荷,吴清平,等.菌种冷冻干燥保藏的影响因素[J].微生物通报,2008,35(6):959-962.
[15]LI H,ZHAO W Y,WANG H,et al.Influence of Culture pH on Freeze-drying Viability of Oenococcus oeni and its Relationship with FattyAcidComposition[J].FoodandBioproductsProcessing,2009,87:56–61.
[16]JESUS M R,PATRICIA B,ESTRELLA D,et al.Involvement of Cyclopropane Fatty Acids in the Response of Pseudomonas putida KT2440 to Freeze-drying[J].Applied and Environmental Microbiology,2006,72(1):472-477.
[17]CARVALHO A S,JOANA S,PETER H,et al.Relevant Factors for the Preparation of Freeze-dried Lactic Acid Bacteria[J].International Dairy Journal,2004,14:835-847.
[18]CHIARA M,SYLVAIN L S K,DIANA I S,et al.Synthesis of Cyclopropane Fatty Acids in Lactobacillus helveticus and Lactobacillus sanfranciscensis and Their Cellular Fatty Acids Changes following Short Term Acid and Cold Stresses[J].Food Microbiology,2010,27:493-502.
[19]BENEY L,GERVAIS P.Influence of the Fluidity of the Membrane on the Response of Microorganisms to Environmental Stresses[J].Appl Microbiol Biotechnol,2001,57:34–42.
[20]林学政,边际,何培青.极地微生物低温适应性的分子机制[J].极地研究,2003,15(1):75-82.
[21]王胜男,孟祥晨.“冷冻一培养”循环冷冻刺激对植物乳杆菌细胞膜脂肪酸组成的影响[J].中国乳品工业,2008,36(4):13-16.
Effects of different disposes on compositions of membrane fatty acids of Lactobacillus delbrueckii subsp.Bulgaricus LB
LI Yang1,LI Yan1,LIU Yan1,YUAN Dong-dong1,ZHANG Lie-bing1,YANG Rui-xue2
(1.College of Food Science&Natritional Engineening,China Agricultural University,Beijing 100083,China;
2.Chinese Acadency of Agricultural Mechanization Science,Beijing 100083,China)
At pH=6.0,32,37,42 and 42℃,pH=5.0、5.5,the effects of different cultivating temperature,pH and stages on compositions of membrane fatty acids of Lb.delbrueckii subsp.Bulgaricus LB were studied.The changes of membrane fatty acids during freeze-drying were also studied.In different conditions the kinds of fatty acids retained the same,while the content of fatty acids differed from each other,especially the C12:0 and C19cyc9.The content of C12:0 and C19cyc9 ranged from 0.86%to 2.16%and from 4.03%to 7.51%,respectively.Almost,no significant changes of the content of fatty acids had been discovered during freeze-drying.
Lb.delbrueckii subsp.Bulgaricus;membrane;fatty acid;freeze-drying
Q93-33
A
1001-2230(2011)08-0004-04
2011-04-27
现代农业产业技术体系建设专项资金资助(CARS-37)。
李扬(1986-),女,硕士研究生,研究方向为乳品科学。
张列兵

