无梗五加茎中3种酚酸类成分的HPLC-DAD-MS分析
金敏婷, 苏 瑞, 许 鑫, 张舒婷, 方洪壮
(佳木斯大学药学院,黑龙江佳木斯154007)
无梗五加Acanthopananx sessiliflorus(Rupr.Et Maxim.)Seem.为五加科五加属植物,始载于《神农本草经》,具有健肝强肾、益气、活骨疏筋等功效。无梗五加中的酚酸类成分,具有抗炎、抗氧化、抗肿瘤等作用[1-5]。无梗五加的研究报道,多为黄酮、香豆素、多糖、皂苷类等活性成分的提取分离、分析及药理作用[6-10],而关于酚酸类成分的定量测定鲜见报道。本研究通过HPLC-DAD-MS联用技术对无梗五加茎中化学物质进行定性分析,并结合文献相应的质谱[11],确定了原儿茶酸、绿原酸及咖啡酸3种酚酸成分。采用HPLC多波长法同时测定3种酚酸成分,并对12个不同产地无梗五加茎中3种有效成分进行比较。所建立的定量方法简便、快速、准确可靠、应用性强。
1 仪器与材料
Agilent 1200型高效液相色谱/Agilent 6310质谱联用仪,包括:四元泵,自动脱气机,自动进样器,柱温箱,二极管阵列检测器,6310型电喷雾质谱仪,Agilent色谱工作站。原儿茶酸、绿原酸及咖啡酸标准品,纯度≥99.5%(天津一方科技有限公司),乙腈、甲醇为色谱纯(天津市科密欧化学试剂有限公司),磷酸、醋酸均为分析纯。12批样品,分别于2009年采自黑龙江、辽宁不同的县市区,经佳木斯大学宗希明高级实验师鉴定为无梗五加茎。
2 方法与结果
2.1 色谱条件 色谱柱为Agilent Zorbax SB-C8柱(250 mm ×4.6 mm,5 μm);柱温为50 ℃;体积流量为1 mL/min;进样量为10 μL。定性分析与定量分析的流动相,分别为乙腈-甲醇-0.2%甲酸水溶液及乙腈-甲醇-0.4%磷酸水溶液,洗脱方式相同,流动相梯度洗脱见表1。定性分析色谱检测波长为270 nm,数据波长记录范围为200~400 nm。定量测定检测波长为260 nm和324 nm。

表1 梯度洗脱程序Tab.1 The gradient elution program
2.2 质谱条件 ESI电离源,负离子模式扫描,离子阱质量分析器,干燥气(N2)体积流量为10.0 L/min,干燥气温度为350℃,雾化器压力为35.0 psi,质量扫描范围:50~1000 m/z。
2.3 混合对照品溶液制备 取原儿茶酸、绿原酸、咖啡酸对照品适量,精密称定,置于25 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,得原儿茶酸、绿原酸和咖啡酸混合对照品贮备液,原儿茶酸、绿原酸、咖啡酸质量浓度分别为 2.0、5.0、6.0 mg/mL。
2.4 供试品溶液制备 取无梗五加茎(粉碎过50目筛)粉末约5.0 g,精密称定,置具塞圆底烧瓶中,精密加入50 mL甲醇,密塞,称定质量,水浴90℃下回流提取2 h,放冷,再称定质量,用甲醇补足失质量,摇匀,滤过,浓缩提取液。用甲醇转移至25 mL量瓶,并稀释至刻度,滤过,取续滤液,经 0.45 μm微孔滤膜滤过,即得供试品溶液。
2.5 定性分析 在上述检测条件下,供试液在HPLC上经流动相乙腈-甲醇-0.2%甲酸水梯度洗脱分离,分别得到270 nm波长下的色谱图与一级质谱扫描总离子流图(见图1)。从图1可知,无梗五加溶液在保留时间25 min前,有3个较强的谱峰。分别提取3个谱峰的DAD所记录的光谱图(见图2)及MS-MS数据的一级、二级质谱图(见图3~5)。综合分析3种成分的光谱与其准分子离子峰及其碎片离子,经与对照品在相同检测条件下的色谱保留时间、光谱及质谱信息比对,并结合文献的数据与图谱[11],确定3种成分分别为原儿茶酸、绿原酸和咖啡酸。

图1 供试液270 nm色谱图(A)和总离子流图(B)Fig.1 LC chromatograms(A)in 270 nm and total ion current chromatogram(B)of sample

图2 无梗五加中3种成分UV光谱图Fig.2 UV spectra of three compounds in sample

图3 化合物1的一级(A)、二级(B)质谱图Fig.3 MS,MS/MS spectra of compound 1

图4 化合物2的一级(A)、二级(B)质谱图Fig.4 MS,MS/MS spectra of compound 2
2.6 定量分析

图5 化合物3的一级(A)、二级(B)质谱图Fig.5 MS,MS/MS spectra of compound 3
2.6.1 色谱系统适用性 取供试液溶液,按设定的定量色谱条件进样测定,得到样品260 nm和324 nm下的色谱图(见图6)。原儿茶酸、绿原酸及咖啡酸的保留时间分别为 10.23、19.17 和 21.36 min;3种物质理论塔板数分别为20945,69196,63817。原儿茶酸、绿原酸及咖啡酸与相邻色谱峰的分离度大于1.5,分离度符合定量要求。

图6 样品的260 nm和324 nm HPLC色谱图Fig.6 HPLC chromatograms of sample at 260 nm and 324 nm
2.6.2 线性关系 分别精密量取混合对照品溶液0.5、1.0、2.0、4.0、6.0、8.0 mL 置于 10 mL 量瓶中,加甲醇稀释至刻度,摇匀。取混合对照品溶液及其稀释液,按照2.1项下色谱条件测定3种成分的峰面积。以对照品质量浓度X(mg/mL)为横坐标,峰面积Y为纵坐标,分别绘制原儿茶酸、绿原酸及咖啡酸的标准曲线,并进行回归运算,结果表明,3种成分在各自浓度范围内线性关系良好。各成分的回归方程、线性范围及相关系数见表2。

表2 线性关系Tab.2 Linear relationship
2.6.3 精密度试验 取混合对照品溶液4.0 mL置于10 mL量瓶中,加甲醇稀释至刻度,摇匀。在上述的色谱条件下重复进样5次,测定色谱的峰面积,计算原儿茶酸、绿原酸及咖啡酸色谱峰面积的RSD分别为 0.82%,0.64%,0.75%,表明仪器的精密度良好。
2.6.4 重复性试验 取同产地的样品6份,按2.4项下方法制备供试品溶液,并按照2.1项下色谱条件进行分析,测定原儿茶酸、绿原酸及咖啡酸色谱峰面积的 RSD 分别为1.7%,0.34%,1.3%,实验方法重复性良好。
2.6.5 稳定性试验 制备供试品溶液,室温下放置,按照2.1 项下色谱条件分别于 0、2、4、8、12、24 h测定,计算原儿茶酸、绿原酸及咖啡酸峰面积的RSD 分别为1.7%,0.45%,1.4%,表明供试液在 24 h内稳定。
2.6.6 回收率试验 取已知含有量同产地样品9份,各约2.5 g,精密称定,每3份为1组。每组分别精密加入一定量的原儿茶酸、绿原酸及咖啡酸对照品溶液,按2.4项下方法制备低、中、高3个水平供试品溶液。按2.1项下色谱条件进行分析测定,计算原儿茶酸、绿原酸、咖啡酸的回收率,结果见表3。

表3 回收率结果(n=9)Tab.3 Results of recovery(n=9)
2.7 样品的测定 分别取12个不同产地的无梗五加茎粗粉各约5.0 g,精密称定,按2.4项下方法制备供试品溶液,按2.1项下色谱条件测定,采用外标法计算样品中原儿茶酸、绿原酸及咖啡酸,不同产地无梗五加茎中3种成分质量分数,见表4。
3 讨论
3.1 化学成分确定 在HPLC上,混合对照品溶液中原儿茶酸、绿原酸、咖啡酸与样品中的目标峰呈现相同的色谱保留时间;样品中3个目标峰的DAD检测表明,它们各自的紫外光谱与混合对照品中原儿茶酸、绿原酸、咖啡酸的光谱一致;在质谱负离子模式下,目标峰与混合对照品中相应物持的准分子离子、主要碎片离子的质荷比相同。样品中3个目标峰对应的物质被确定为原儿茶酸、绿原酸和咖啡酸。
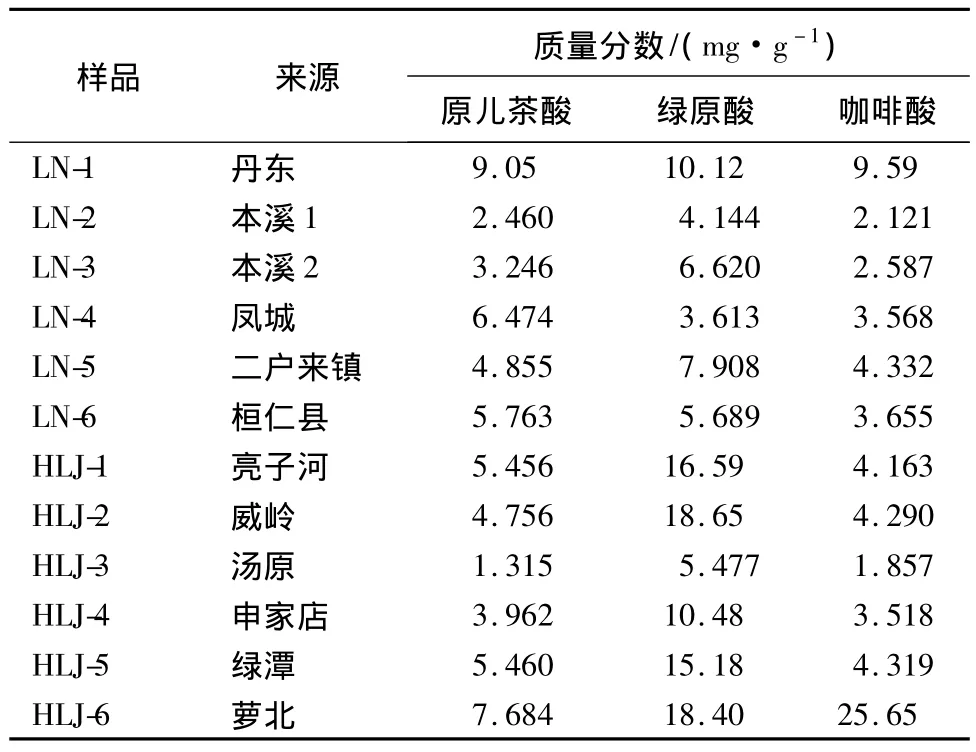
表4 样品测定结果Tab.4 The contents of 3 compound in samples from different areas
3.2 检测波长选择 由3种待测成分的DAD下的光谱图(图3)可知,原儿茶酸最大吸收波长分别是260 nm和295 nm,绿原酸、咖啡酸在295 nm和324 nm均有两个吸收峰。295 nm对于3种成分虽有较强吸收,但其强度不及260 nm、324 nm,故选择260 nm为原儿茶酸检测波长,324 nm为绿原酸及咖啡酸检测波长。
3.3 色谱柱选择 考察了相同规格(250 mm×4.6 mm,5 μm)的 3种不同的 Agilent Zorbax色谱柱(XDB-C18、SB-C18、SB-C8),由于实验中所涉及的流动相酸性较强,舍弃了XDB-C18柱;另由于样品中极性成分较多,待测成分在SB-C18色谱柱未能有效地分离,而所涉及的3种成分在SB-C8柱上,分离效果良好、与邻峰的分离度均大于1.5,故最终选定Agilent Zorbax SB-C8柱。
3.4 流动相及柱温选择 比较了0.2%和0.4%磷酸溶液-乙腈-甲醇梯度洗脱体系,在使用0.2%磷酸溶液时,3种成分的色谱峰有部分拖尾现象,增加酸度后,峰形得到改善。在室温及30℃、40℃柱温条件下,3种成分的色谱分离不理想,升高柱温至50℃后,分离效果达到了定量要求。
由于磷酸水溶液不能挥发,易污染检测器,不宜用作液质分析流动相,故样品在进行质谱定性分析时,流动相中的酸水溶液的酸采用易挥发的甲酸。
3.5 3种成分质量分数比较 12个不同产地的无梗五加茎中绿原酸的量明显高于原儿茶酸和咖啡酸。同一成分因产地的不同,质量分数有较大的差别。辽宁产地原儿茶酸较黑龙江产地量大,其中以丹东(LN-1)的量为最大,而绿原酸与咖啡酸在黑龙江产地量较高,其中萝北(HLJ-6)产地量最多。
[1]张 囡,杜丽丽,王 冬,等.中药酚酸类成分的研究进展[J].中国现代中药,2006,8(2):25-28.
[2]盛卸晃,刘文谦,薛 霞,等.绿原酸体外抗单纯疱疹病毒作用[J].中国天然药物,2008,6(3):232-234.
[3]张 鹏,杨俊卿,苏 强.咖啡酸对慢性铝过负荷致大鼠脑损伤的保护作用[J].中国药理学通报,2009,25(2):197-200.
[4]Kalonia H,Kumar P,Kumar A,et al.Effects of caffeic acid,rofecoxib,and their combination against quinolinic acid-induced behavioral alterations and disruption in glutathione redox status[J].Neurosic Bull,2009,25(6):343-352.
[5]王 晗,刘天庆,朱艳霞,等.原儿茶酸促进人脂肪肝细胞体外增殖的研究[J].生物化学与生物物理学研究进展,2008,35(10):1168-1174.
[6]王晶晶,冯 颖,唐明华,等.无梗五加果实多糖的提取工艺研究[J].现代食品科技,2006,22(2):156-157.
[7]郭丽娜,吴立军,郭祥菊,等.无梗五加茎叶化学成分的研究[J].中草药,2006,37(6):833-834.
[8]王广树,陈燕萍,袁湘杰,等.无梗五加叶化学成分的研究[J].中国药学杂志,1997,32(1):11-13.
[9]韩 莹,李遇伯,李发美,等.HPLC法同时测定无梗五加果中东菪内酯和异秦皮啶的含量[J].沈阳药科大学学报,2006,23(9):573-576.
[10]郭丽娜.无梗五加抗血小板聚集活性部位的化学成分的研究[D].沈阳:沈阳药科大学,2001.
[11]王祝伟.红毛五加化学成分及其多维指纹图谱的研究[D].沈阳:沈阳药科大学,2005.

