高效液相色谱法同时测定解风酒中阿魏酸、原儿茶酸和桂皮醛
王 宁
(湖南省怀化市食品药品检验所,湖南怀化418000)
解风酒是由当归、狗脊、桂枝、独活等多味中药制成的复方制剂。处方源于经验方,具有祛风除湿,舒经通络止痛的作用。用于风湿性关节炎及类风湿性关节炎。其现行质量标准只对制剂中活性成分当归、狗脊、桂枝进行薄层色谱鉴别,无相关的定量测定标准,为了更有效控制本品内在质量,采用高效液相色谱法对方中的阿魏酸、原儿茶酸及桂皮醛进行定量测定。
1 仪器与试药
岛津高效液相色谱仪,包括LC-20AT输液泵,SPD-M20Avp二极管阵列检测器,LCsolution工作站;AUW220D十万分之一电子天平(日本岛津公司),CBL9960A超声波清洗器(上海科导超声仪有限公司)。
阿魏酸(批号:110773-200612)、原儿茶酸(批号:110810-200506)、桂 皮 醛 (批 号:110710-200513)对照品(均由中国药品生物制品检定所提供);解风酒(湖南怀化市中医院制剂,批号为100322、100902、101003);甲醇、乙腈、冰醋酸均为色谱纯;水为超纯水;其它试剂均为分析纯。
2 方法和结果
2.1 色谱条件 kromasil C18色谱柱(250 mm×4.6 mm,5 μm);流动相 A乙腈-B 0.1%冰醋酸溶液,梯度洗脱(0~35 min,75%B ~55%B);体积流量1.0 mL/min;柱温30℃;检测波长260 nm;进样量10 μL。按阿魏酸峰计算,理论板数不低于4000;按原儿茶酸、桂皮醛计算,理论板数不低于5000。
2.2 对照品溶液制备 精密称定经减压干燥18 h的阿魏酸 12.13 mg,原儿茶酸 12.51 mg,桂皮酸对照品5.24 mg,置100 mL量瓶中,用甲醇定容至刻度,作为混合对照品溶液,避光备用。
2.3 供试品溶液的制备 精密量取解风酒20 mL,置50 mL量瓶中加70%甲醇适量溶解,超声处理(功率250 W,频率40 kHz)25 min,再加70%甲醇至刻度,摇匀,过滤,取续滤液即得。
2.4 阴性供试品溶液的制备 按处方比例称取缺当归、狗脊及桂枝以外的其余药材,按制备工艺制成阴性制剂,再按2.3项下的方法制备阴性供试品溶液。
2.5 方法学考察
2.5.1 专属性试验 分别精密吸取阴性供试品溶液、混合对照品溶液、供试品溶液各10 μL注入液相色谱仪,依法测定。阿魏酸、原儿茶酸及桂皮醛的保留时间分别约为 12.8,21.2,27.6 min,与混合对照品溶液的色谱保留时间一致;阴性供试品溶液在该色谱条件下对测定无干扰。见图1。
2.5.2 线性关系考察 精密吸取上述混合对照品溶液 2、4、6、8、10、20 μL 分别注入液相色谱仪,测定峰面积,以进样量(μg)为横坐标,峰面积为纵坐标,绘制标准曲线,得阿魏酸、原儿茶酸、桂皮醛的回归方程分别为 A=2.33×106C-3.21×104(r=0.9999),A=2.42 × 106C - 1.39 × 104(r=0.9999),A=1.47 × 106C - 2.67 × 103(r=0.9999)。结果表明阿魏酸、原儿茶酸、桂皮醛分别在 0.02426 ~ 0.2426 μg、0.02502 ~ 0.2502 μg、0.01048 ~0.1048 μg 范围内,进样量与峰面积呈良好的线性关系。
2.5.3 精密度试验 精密吸取同一混合对照品溶液,按2.1项下的方法连续进样6次,分别测定阿魏酸、原儿茶酸、桂皮醛的峰面积,峰面积RSD分别为 0.48%、0.99% 、0.93%。
2.5.4 重复性试验 取同一批号解风酒(批号:100322)6份 ,按2.3项下方法制备供试品溶液,依法测定,计算,结果阿魏酸、原儿茶酸、桂皮醛的RSD 分别为 1.01%、0.69%、0.98%。
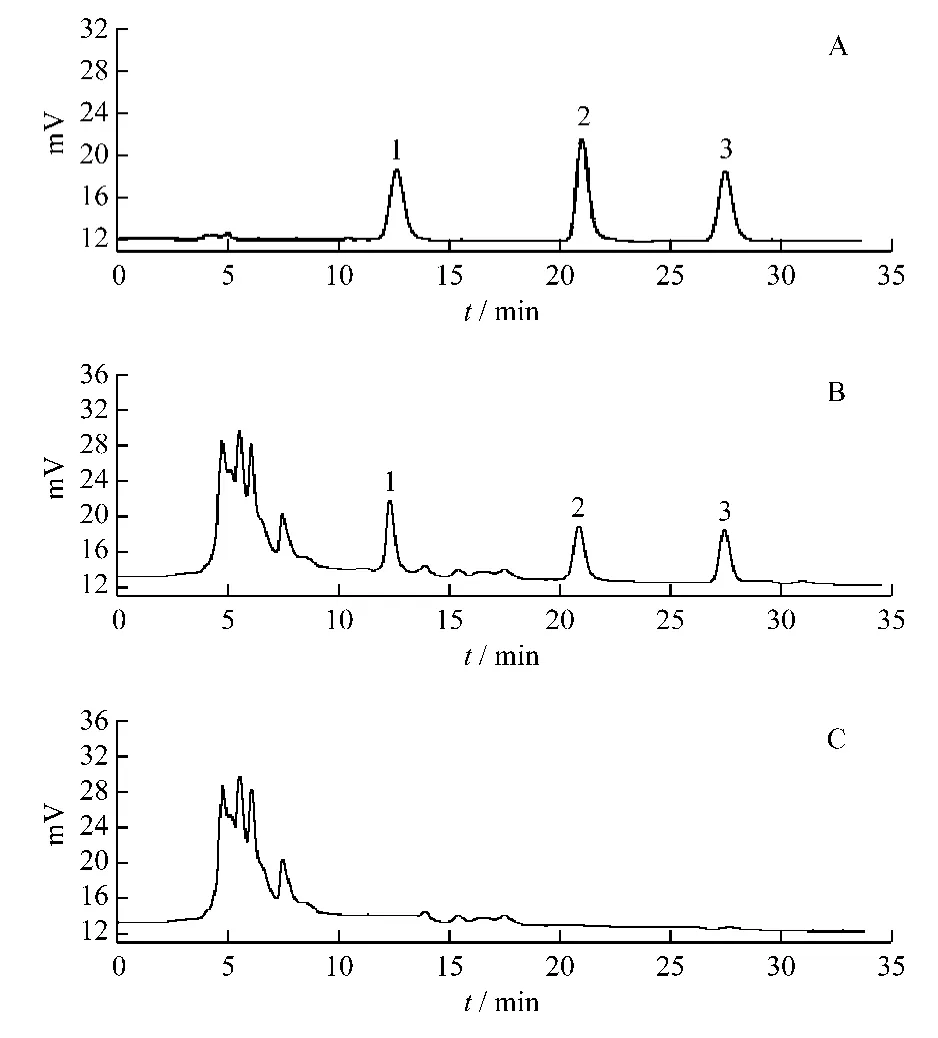
图1 解风酒HPLC色谱图Fig.1 HPLC chromatograms of Jiefeng Wine
2.5.5 稳定性考察 吸取供试品 (批号:100322),按2.3项下的制备条件,于室温放置0、4、8、12、24 h后按2.1项下的色谱条件进行,分别测定阿魏酸、原儿茶酸、桂皮醛的峰面积,RSD分别为0.74%、0.80%、0.65%,表明供试品溶液在 24 h 内基本稳定。
2.5.6 加样回收率试验 精密吸取同一批号样品(批号 100322,含阿魏酸 2.55 mg/瓶;原儿茶酸4.12 mg/瓶;桂皮醛 1.27 mg/瓶;每瓶 500 mL)10 mL,共9份,分别置50 mL量瓶中,分别精密加入混合对照品溶液(阿魏酸0.01213 mg/mL、原儿茶酸0.01251 mg/mL 和桂皮醛 0.00524 mg/mL)5.0,6.0和7.0 mL,按2.3项下的方法制备供试品溶液,并按2.1项下的色谱条件,依法测定,计算平均回收率,结果见表1。
2.5.7 样品测定 取3批样品,按2.2和2.3项下的方法分别制备对照品溶液和供试品溶液,依次对3批次样品(批号:100322,100902,101003)进行测定,结果见表2。
3 讨论
3.1 检测波长的选择 对阿魏酸、原儿茶酸及桂皮醛进行紫外全波段扫描,三者均在260 nm波长处有较大的紫外吸收,故采取260 nm为检测波长。

表1 加样回收率结果Tab.1 The results of Recovery test
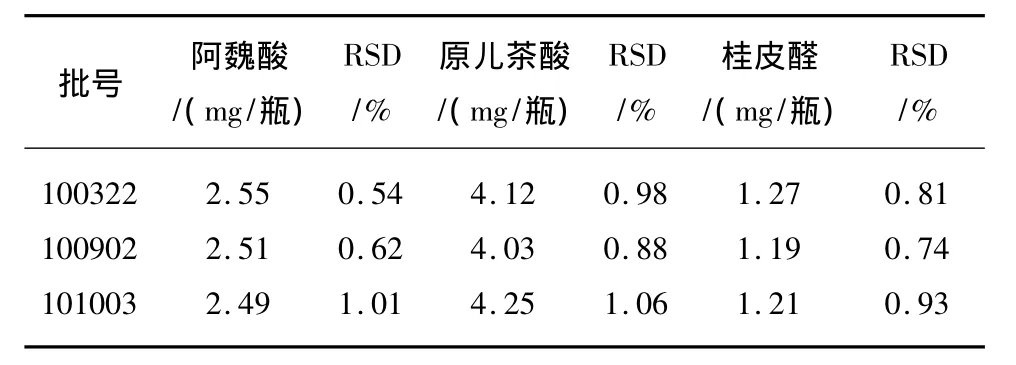
表2 解风酒中阿魏酸、原儿茶酸、桂皮醛测定结果(n=3)Tab.2 Test results of samples(n=3)
3.2 提取溶剂与提取时间的选择 本实验分别采用50%甲醇、70%甲醇、甲醇作为提取溶剂,结果发现70%甲醇提取的样品含有量较其他溶剂高,且杂质影响较小;同时还考察了 15、25、35、45 min不同提取时间对样品的影响,结果25 min时提取最完全,且所测成分稳定。
3.3 柱温的设定 本方法采用的是梯度洗脱,在测定中不设柱温,色谱峰基线漂移较严重,样品峰拖尾明显,设定柱温后,可减少拖尾,基线漂移得到改善,峰形对称,但柱温设定不易过高,过高峰形变差,故柱温设定为30℃为佳。
3.4 流动相及洗脱方式的选择 参阅相关文献[1-11],分别使用了甲醇-0.1%冰醋酸溶液、乙腈-0.1%冰醋酸溶液、乙腈-0.1%磷酸溶液等不同类型、比例的流动相进行实验,选用乙腈-0.1%冰醋酸溶液且进行二元梯度洗脱,结果表明,此洗脱相能更好地分离阿魏酸、原儿茶酸与桂皮醛峰,各主峰之间的分离度均大于1.5,且阴性样品对测定无干扰。
3.5 该品种为临床常用制剂,为完善其质量标准,用本法同时测定解风酒中阿魏酸、原儿茶酸和桂皮醛,方法简便、准确,能够有效控制解风酒的内在质量,为临床用药提供安全保障。
[1]国家药典委员会.中华人民共和国药典:2010年版一部[S].北京:中国医药科技出版社,2010:124,209,259.
[2]袁丽霞,王 红.HPLC法测定当归苦参丸中阿魏酸的含量[J].中国药事,2008,22(1):61.
[3]卞 凌.HPLC法测定养血化瘀合剂中阿魏酸的含量[J].黑龙江中医药,2009(5):49-50.
[4]鲁健武,曾俊芬,宋金春.HPLC法同时测定复方川芎胶囊中阿魏酸和川芎嗪的含量[J].中国药师,2008,11(7):814-816.
[5]刘忠民,郭利民.反相高效液相色谱法测定强肝糖浆中阿魏酸含量[J].中国药业,2006,15(4):18.
[6]张 雪,褚文静,刘伟娜,等.高效液相色谱-二极管阵列检测法测定冠心宁注射液中丹参素、原儿茶酸、原儿茶醛、阿魏酸、迷迭香酸和丹酚酸 B[J].中草药,2010,35(2):1425-1429.
[7]杨 滨,屈巧玲,王谦鹏,等.急支糖浆中原儿茶酸等4种成份的含量测定[J].中国中药杂志,2007,12(9):565-569.
[8]王治平,杨 柯,孟祥平,等.RP-HPLC法测定滇桂艾纳香中原儿茶酸与原儿茶醛含量[J].中药材,2005,28(5):1245-1248.
[9]张淑芳,裴妙荣,裴香萍.反相高效液相色谱法测定炎立消胶囊中原儿茶酸、原儿茶醛和酪酸的含量[J].中国实验方剂学杂志,2008,14(6):457-458.
[10]李丽娇,张元桐,陈晓霞.HPLC法测定人参养荣丸中桂皮醛含量[J].辽宁中医药大学学报,2009,11(6):230-231.
[11]成差群,魏燕华,谭秀芬,等.HPLC法测定肉桂配方颗粒中的桂皮醛和桂皮酸[J].华西药学杂志,2009,23(6):673-674.

