文拉法辛对老年抑郁大鼠海马血管内皮生长因子表达的影响
李 娜 赵兴蓉 胡 静 王廷华 许秀峰 (昆明医学院第一附属医院精神科,云南 昆明 650032)
文拉法辛对老年抑郁大鼠海马血管内皮生长因子表达的影响
李 娜 赵兴蓉 胡 静 王廷华1许秀峰 (昆明医学院第一附属医院精神科,云南 昆明 650032)
目的 探讨抗文拉法辛对老年抑郁大鼠海马血管内皮生长因子(VEGF)表达的影响。方法 老年雄性SD大鼠,随机分为3组,模型组、文拉法辛组各12只均给予慢性不可预测的温和多相应激结合孤养共5 w,文拉法辛组于应激第3周末开始同时给予文拉法辛(5 mg·kg-1·d-1)治疗持续14 d,模型组同时给予生理盐水14 d。对照组12只不给予任何处理。采用敞箱实验和糖水消耗实验观察大鼠抑郁建模情况。采用免疫印迹检测海马VEGF蛋白表达,逆转录聚合酶链反应(RT-PCR)检测VEGF mRNA表达。结果 敞箱实验、液体消耗实验显示模型组及文拉法辛组抑郁模型建立成功。与模型组比较,文拉法辛组垂直得分增高,蔗糖消耗增加(P均<0.05)。与对照组比较,文拉法辛组海马VEGF蛋白及VEGF mRNA表达均增加(P<0.05,P<0.01);模型组海马VEGF蛋白及VEGF mRNA表达均下降(P<0.05)。文拉法辛组与模型组比较,文拉法辛组VEGF蛋白及VEGF mRNA表达均明显增加(P<0.01)。结论 文拉法辛可提高老年抑郁大鼠VEGF表达,并对血管新生可能起到促进作用。
老年抑郁;海马;文拉法辛;血管内皮生长因子
血管新生是一个动态发展的过程,期间受多种血管特异性生长因子的调控。其中血管内皮细胞生长因子(VEGF)可促进内皮细胞存活、增殖、迁移,增加血管通透性、促进毛细血管融合〔1,2〕,因而对血管新生起到促进作用。文拉法辛作为选择性5-羟色胺和去甲肾上腺素再摄取抑制剂,抗抑郁疗效显著,但其对血管新生的作用及作用机制如何,目前尚无相关研究。本研究拟通过应用文拉法辛对慢性应激抑郁老年大鼠模型进行干预,观察其对老年抑郁大鼠海马VEGF蛋白和VEGF mRNA表达的影响,进一步探讨文拉法辛对老年抑郁障碍的血管新生的影响,为老年抑郁障碍的发病机制提供实验依据。
1 材料与方法
1.1 实验动物 SPF级雄性SD老年大鼠36只(20月龄),由成都达硕生物科技有限公司提供,许可证号:SCXK(川)2008-24,动物合格证号:0012758。大鼠体质量(650±50)g。
1.2 实验药品 文拉法辛由成都大西南制药有限公司生产并赠送,25 mg/粒,批准文号:准:H19980051。
1.3 实验试剂 兔抗鼠VEGF多克隆抗体(Santa crudz公司)、兔抗鼠β-actin单克隆抗体(Abmart公司)、Western印迹试剂盒(Merck公司)、羊抗兔 IgG-HRP(abmart公司)、Trizol试剂(Molecular Reseach Center TR 118),RevertAidTM First Strand cDNA Synthesis Kit及 dNTPS(Fermentas Company),DNA Ladder Marker(宝生物工程 D513A)。
1.4 实验方法
1.4.1 动物分组及建模方法 大鼠购自后进行适应性饲养1 w。1 w后大鼠按体质量排序后根据随机数字表将大鼠随机分为文拉法辛组(n=12)、模型组(n=12)、对照组(n=12)。应激前1 d各组进行敞箱实验和蔗糖消耗实验,结束后对照组不进行任何处理,自由进食及摄水,以4只/笼饲养。其余两组大鼠均采用单笼饲养加慢性不可预测的温和多相应激方法(CUMS)共5 w,根据文献并结合本课题组长期实践经验,对应激方法进行改良〔2〕。于应激后3、5 w末各组均进行敞箱实验和蔗糖消耗实验。试验5 w结束后各组即取标本。
1.4.2 给药方法 文拉法辛组于应激后第3周末开始文拉法辛5 mg·kg-1·d-1腹腔注射,剂量的选择根据相关文献确定〔3〕,使用无菌双蒸水稀释,稀释浓度5 ml/kg,每日新鲜配制。模型组同时行0.9%生理盐水腹腔注射,注射剂量5 ml/kg。均持续注射14 d〔4〕,注射时间固定在每日应激前。
1.4.3 抑郁模型评估方法 于应激前1 d、应激第3周末、应激第5周末进行敞箱实验和蔗糖消耗实验。
1.4.3.1 敞箱实验 实验在安静环境及自然光线下进行,将大鼠小心置于方箱底面中央格,同时进行计时。2 min后更换动物继续实验。两者之间用体积分数为10%的酒精清洗方箱周壁及底面,以免上次动物余留的异味影响下次实验结果。观察指标及计分方法:观察大鼠2 min内越过的方格数(大鼠4只脚均在同一格子内为一格)为水平得分,穿越一格计1分;后肢站立次数为垂直得分,双足离地一次计1分;两者之和为敞箱总得分。此外,观察中央格停留时间、清洁时间、粪便粒数。
1.4.3.2 蔗糖消耗实验 于适应性饲养期间,每笼同时放置2个水瓶,均为1%蔗糖水,以后的连续2 d,每笼同时放置2个水瓶,为一瓶1%蔗糖水,一瓶纯水。应激前2 d禁水禁食24 h,应激前1 d进行1 h蔗糖消耗实验,即每笼同时放置2个实验前已称重的水瓶,为一瓶1%蔗糖水,一瓶纯水,于1 h后移走两瓶水并分别称重。计算动物的基础糖水消耗(实验前糖水重量-实验后糖水重量)、纯水消耗(实验前纯水重量-实验后纯水重量)、总液体消耗(糖水消耗+纯水消耗)、糖水偏爱(糖水消耗/总液体消耗 )。
1.4.4 Western印迹 大鼠直接断头处死,冰浴上取出左侧海马组织并称重,按80 mg/ml加入裂解液;冰浴匀浆法提取组织总蛋白;BCA法测定蛋白质含量;SDS-PAGE凝胶电泳配制;转移槽转印蛋白质到PVDF膜;5%脱脂奶粉常温1 h封闭;加入一抗VEGF(1∶1 000)室温孵育2 h,TBST漂洗10 min×2次,TBS洗一次,10 min;加入二抗(羊抗兔IgG-HRP)室温孵育2 h,TBST漂洗10 min×2次,TBS洗一次,10 min;ECL液显影免疫复合物,3个样/张;用计算机图像分析系统软件IMAGE J分析测定VEGF及内参照β-actin的电泳条带平均光密度值,用VEGF/β-actin的平均光密度值比值进行比较。
1.4.5 RT-PCR反应 大鼠直接断头处死,冰浴上取出右侧海马,放入含0.1%的DEPC水中稍作漂洗,立即放入细胞冻存管中,液氮速冻后,放入-70℃ 冰箱中保存备用。用Trizol常规方法提取海马总RNA,紫外分光光度计测RNA样品的纯度,测OD260/280值,计算RNA浓度。1.5%甲醛变性琼脂糖凝胶鉴定RNA质量。取2 μg总RNA经逆转录酶M-MLV催化合成cDNA。VEGF和内参照β-actin引物由大连宝生物公司设计并合成。VEGF引物序列:正义链为5'-AAGCCCATGAAGTGGTGAA-3',反义链为 5'-CAGTGAACGCTCCAGGATTTA-3',产物大小为394 bp;β-actin引物序列:正义链为5'-TGTGCTGTCCCTGTACGCCTCT-3',反义链为 5'-CCTTAATGTCACGCACGATTTCC-3',产物大小为227 bp。PCR反应条件:94℃ 预变性3 min,94℃变性 30 s,退火 30 s(VEGF 50℃、β-actin 56℃),72℃延伸30 s,35个循环,720C终延伸10 min得到扩增产物。10 μl PCR产物经2%琼脂糖凝胶电泳及溴化乙啶染色后,用凝胶成像仪紫外模式下摄取凝胶图片,采用BIO-GEL 2.0型全自动图像分析系统进行半定量分析,计算目的基因扩增条带与β-actin条带平均光密度值的比值,以表示VEGF mRNA表达水平。
1.5 统计分析 用SPSS16.0进行统计分析,数据用±s表示,采用t检验及单因素方差分析,应用LSD及Dunnett检验。
2 结果
2.1 敞箱实验结果 应激后5 w,与对照组比较,文拉法辛组、模型组水平得分、垂直得分、活动得分降低(P<0.01,P<0.05);模型组清洁时间明显缩短(P<0.01)。应激后5 w,与模型组比较,文拉法辛组垂直得分增高(P<0.05)。见表1。
表1 各组应激前后敞箱实验变化(±s)
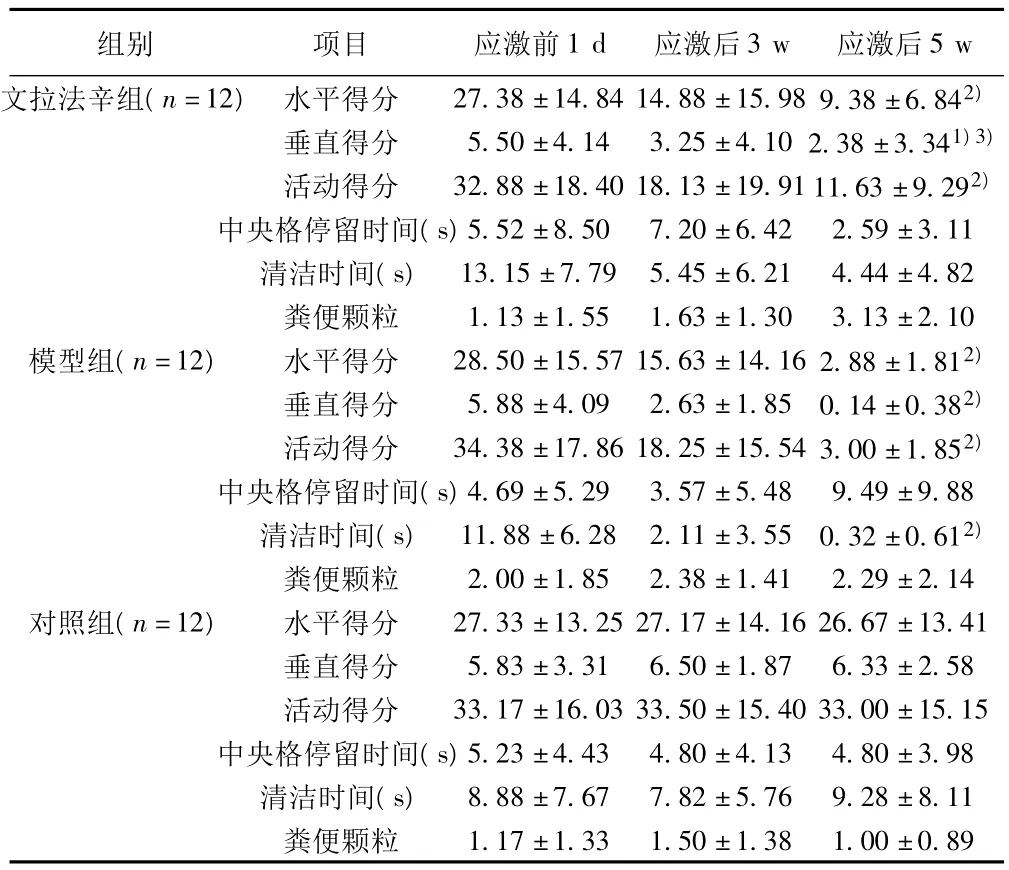
表1 各组应激前后敞箱实验变化(±s)
与对照组比较:1)P<0.05,2)P<0.01;与模型组比较:3)P<0.05,4)P<0.01;下表同
组别 项目 应激前1 d 应激后3 w 应激后5 w文拉法辛组(n=12) 水平得分 27.38±14.84 14.88±15.98 9.38±6.842)垂直得分 5.50±4.14 3.25±4.10 2.38±3.341)3)活动得分 32.88±18.40 18.13±19.91 11.63±9.292)中央格停留时间(s)5.52±8.50 7.20±6.42 2.59±3.11清洁时间(s) 13.15±7.79 5.45±6.21 4.44±4.82粪便颗粒 1.13±1.55 1.63±1.30 3.13±2.10模型组(n=12) 水平得分 28.50±15.57 15.63±14.16 2.88±1.812)垂直得分 5.88±4.09 2.63±1.85 0.14±0.382)活动得分 34.38±17.86 18.25±15.54 3.00±1.852)中央格停留时间(s)4.69±5.29 3.57±5.48 9.49±9.88清洁时间(s) 11.88±6.28 2.11±3.55 0.32±0.612)粪便颗粒 2.00±1.85 2.38±1.41 2.29±2.14对照组(n=12) 水平得分 27.33±13.25 27.17±14.16 26.67±13.41垂直得分 5.83±3.31 6.50±1.87 6.33±2.58活动得分 33.17±16.03 33.50±15.40 33.00±15.15中央格停留时间(s)5.23±4.43 4.80±4.13 4.80±3.98清洁时间(s) 8.88±7.67 7.82±5.76 9.28±8.11粪便颗粒1.17±1.33 1.50±1.38 1.00±0.89
2.2 蔗糖消耗实验结果 应激后5 w,与对照组比较,模型组蔗糖消耗显著减少(P<0.01)。与模型组比较,文拉法辛组蔗糖消耗增加(P<0.05)。见表2。
2.3 VEGF Western印迹结果 各组均检测到1条分子量约42 kD特异性蛋白条带(见图1),与已知的VEGF蛋白分子量一致。与对照组比较,文拉法辛组海马VEGF表达增加(P<0.05);模型组VEGF表达下降(P<0.05)。与模型组比较,文拉法辛组海马VEGF表达明显增加(P<0.01)。见表3。
2.4 VEGF mRNA RT-PCR结果 RT-PCR方法获得大约394 bp的PCR条带(见图2)。与对照组比较,文拉法辛组海马VEGF mRNA表达显著增加(P<0.01);模型组VEGF mRNA表达降低(P<0.05)。与模型组比较,文拉法辛组VEGF mRNA表达显著增加(P<0.01)。见表3。
表2 各组大鼠应激前后蔗糖消耗实验变化(±s)
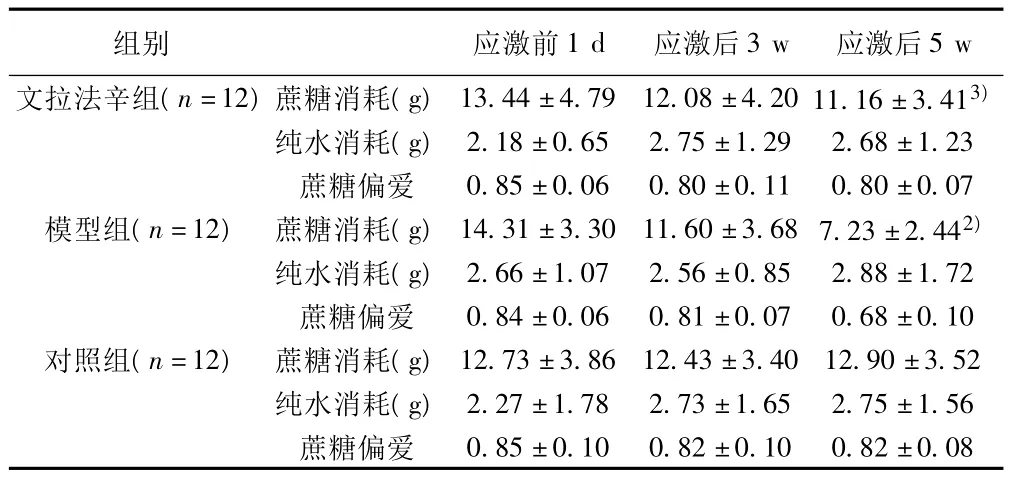
表2 各组大鼠应激前后蔗糖消耗实验变化(±s)
组别 应激前1 d 应激后3 w 应激后5 w文拉法辛组(n=12)蔗糖消耗(g) 13.44±4.79 12.08±4.20 11.16±3.413)纯水消耗(g) 2.18±0.65 2.75±1.29 2.68±1.23蔗糖偏爱 0.85±0.06 0.80±0.11 0.80±0.07模型组(n=12) 蔗糖消耗(g) 14.31±3.30 11.60±3.68 7.23±2.442)纯水消耗(g) 2.66±1.07 2.56±0.85 2.88±1.72蔗糖偏爱 0.84±0.06 0.81±0.07 0.68±0.10对照组(n=12) 蔗糖消耗(g) 12.73±3.86 12.43±3.40 12.90±3.52纯水消耗(g) 2.27±1.78 2.73±1.65 2.75±1.56蔗糖偏爱0.85±0.10 0.82±0.10 0.82±0.08
表3 Western印迹及RT-PCR法测定各组大鼠海马VEGF蛋白、VEGF mRNA表达情况( ± s,n=12)
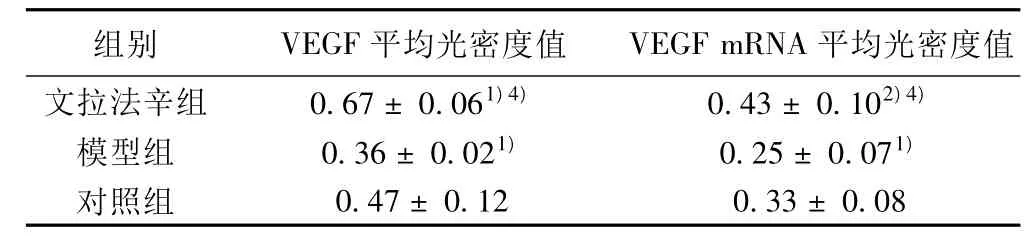
表3 Western印迹及RT-PCR法测定各组大鼠海马VEGF蛋白、VEGF mRNA表达情况( ± s,n=12)
组别 VEGF平均光密度值 VEGF mRNA 平均光密度值文拉法辛组 0.67±0.061)4) 0.43±0.102)4)模型组 0.36±0.021) 0.25±0.071)对照组0.47±0.12 0.33±0.08
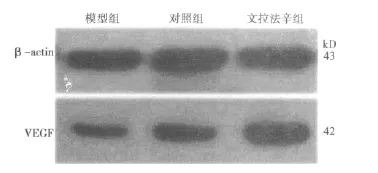
图1 各组大鼠海马VEGF蛋白免疫印迹图
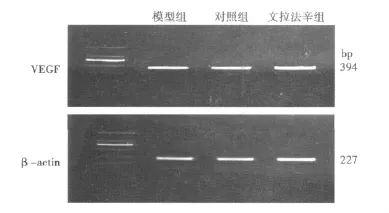
图2 各组大鼠海马VEGF mRNA电泳图
3 讨论
VEGF是内皮细胞特异性的促有丝分裂原,是公认的刺激血管新生的最强因子之一〔4〕,其表达受多种因素调控,目前认为缺血导致局部组织缺氧是主要的刺激因素,组织缺氧的发生可以提升细胞内缺氧诱导因子(HIF-1α)蛋白的水平,进而上调VEGF的表达〔5〕。在本研究中,三组VEGF蛋白及基因均有表达。就对照组而言,其表达可能与大鼠衰老导致血管自身退变、脑血流灌注减少以及 HIF-1α的作用有关〔6〕。而模型组VEGF蛋白及基因表达均低于对照组,此结果与多数研究结论一致〔7〕。推测降低原因一方面与高皮质醇的调节作用有关。慢性应激可以上升血中皮质醇的水平,升高的皮质醇能抑制血管平滑肌、成骨细胞和肾上腺中VEGF的表达,并明显降低海马齿状回颗粒细胞层下区VEGF及其受体KDR/Flk-1的水平,进一步抑制血管新生〔8〕。另一方面,VEGF表达水平的变化也与时间有密切关系,在血管新生的早期阶段其表达可明显增高,随时间的延长表达逐渐降低,数个研究显示分界点为7 d〔9〕。本研究中,VEGF蛋白及基因表达的测定时间为5 w末,已远远超过上述分界时间点。应激初期海马神经元缺血缺氧导致的VEGF代偿性增高随应激时间的不断延长,可能已转入后期的VEGF合成失代偿状态,同时合并其他抗血管新生因子的表达增高,继而出现VEGF水平下降,最终血管新生可能受抑而加重神经元的损伤〔10〕。故促进血管新生有赖于内、外源性干预等措施〔11〕,其中外源性干预是目前主要的研究方向。
抗抑郁药物文拉法辛,早期的研究认为“单胺学说”即其抗抑郁机制。近来更新的研究表明单胺类神经递质(NT)和NT受体可能只是其抗抑郁作用的开始,最终产生的疗效与后续的神经适应性变化有关〔12〕。而VEGF可能参与了此种适应性变化过程继而发挥抗抑郁样活性〔13〕。一方面,抗抑郁治疗后上抬的VEGF及其所促进的血管新生对于支持海马神经元的再生提供了一个重要而有利的血管环境。另一方面,升高的VEGF也可通过受体KDR/Flk-1及多个信号通路直接促进神经干细胞增殖,增加神经元和胶质细胞数量,并起到神经营养和神经保护作用〔14〕。本研究提示文拉法辛可提高老年抑郁大鼠VEGF表达。对于文拉法辛致VEGF升高的原因尚不清楚,可能与多种机制有关。有资料显示帕罗西汀等抗抑郁药物可作用于糖皮质激素受体,增加其对糖皮质激素的结合能力,恢复其受体活性,从而使HPA轴对糖皮质激素的反馈作用更加敏感,拮抗过量的皮质醇〔15〕。本研究文拉辛机制可能也与此有关。此外,药物还可通过G蛋白影响细胞内信号转导,提高环磷酸腺苷(CAMP)浓度,导致CAMP信号级联及其下游CAMP反应元件结合蛋白(CREB)等发生变化,激活蛋白激酶A(PKA)和蛋白激酶C(PKC),并促进转录因子磷酸化,诱导转录基因表达,使VEGF及其受体表达上调,从而发挥抗抑郁作用〔16〕。第三,文拉法辛可能类似其他抗抑郁药物,尚可通过活化的5羟色胺2(5-HT2)受体直接增加海马的血管内皮细胞的数量并促进其增殖,进而上调VEGF的表达。而究竟是何具体机制,尚需进一步的研究加以论证。
1 Rasmussen HS,Rasmussen CS,Macko J.VEGF gene therapy for coronary artery disease and peripheral vascular disease〔J〕.Cardiovasc Radiat Med,2002;(3):114-7.
2 Post MJ,Laham R,Sellke FW,et al.Therapeutic angiogenesis in cardiology using protein formulations〔J〕.Cardiovasc Res,2001;49(3):522-31.
3 Xu H,Steven Richardson J,Li XM.Dose-related effects of chronic antidepressants on neuroprotective proteins BDNF,Bcl-2 and Cu/Zn-SOD in rat hippocampus〔J〕.Neuropsychoharmacology,2003;28(1):53-62.
4 Willner P.Chronic mild stress(CMS)revisited:consistency and behavioural-neurobiological concordance in the effects of CMS〔J〕.Neuropsy-chobiology,2005;52(2):90-110.
4 Shen F,Su H,Fan Y,et al.Adeno-associated viral-vector-mediated hypoxia-inducible vascular endothelial growth factor gene expression attenuates ischemic brain injury after focal cerebral ischemia in mice〔J〕.Stroke,2009;37(10):2601-6.
5 Shen F,Fan Y,Su H,et al.Adeno-associated viral vector-mediated hypoxia-regulated VEGF gene transfer promotes angiogenesis following focal cerebral ischemia in mice〔J〕.Gene Ther,2008;15(1):30-9.
6 Hoehn BD,Harik SI,Hudetz AG,et al.VEGF mRNA expressed in microvessels of neonatal and adult rat cerebral cortex〔J〕.Mol Brain Res,2002;101(1-2):103-8.
7 Greene J,Banasr M,Lee B,et al.Vascular endothelial growth factor signaling is required for the behavioral actions of antidepressant treatment:pharmacological and cellular characterization〔J〕.Neuropsychopharmacology,2009;34(11):2459-68.
8 Heine VM,Zareno J,Maslam S,et al.Chronic stress in the adult dentate gyrus reduces cell proliferation near the vasculature and VEGF and Flk-1 protein expression〔J〕.Eur J Neurosci,2005;21(5):1304-14.
9 Choi JS,Kim HY,Cha JH,et al.Up regulation of vascular endothelial growth factor receptors Flt-1 and Flk-1 in rat hippocampus after transient forebrain ischemia〔J〕.J Neurotrauma,2007;24(3):521-31.
10 Navailles S,Hof PR,Schauss C.Antidepressant drug-induced stimulation of mouse hippocampal neurogenesis is age-dependent and altered by early life stress〔J〕.J Comp Neurol,2008;509(4):372-81.
11 Zhang S,Zhang P,Guo J.Enhanced cytoprotection and angiogenesis by bone marrow cell transplantation may contribute to improved ischemic myocardial function〔J〕.Eur J Cardiothorac Surg,2004;(25):188-95.
12 Boldrini M,Underwood MD,Hen R,et al.Antidepressants increase neural progenitor in the human hippocampus〔J〕.Neuropsychopharmacology,2009;34(11):2376-89.
13 Palmer TD,Willhoite AR,Gage FH.Vascular niche for adult hippocampal neurogenesis〔J〕.J Comp Neurol,2000;425(4):479-94.
14 Sun Y,Jin K,Childs JT,et al.Vascular endothelial growth factor-B(VEGFB)stimulates neurogenesis:evidence from knockout mice and growth factor administration〔J〕.Dev Biol,2006;289(2):329-35.
15 Par Iante CM,Miller AH.Glucocorticoid receptors in major depression:relevance to pathophysiology and treatment〔J〕.Biol Psychiatry,2001;49(5):391-404.
16 Sairanen M,Lucas G,Ernfors P,et al.Brain-derived neurotrophic factor and antidepressant drugs have different but coordinated effects on neuronal turnover,proliferation,and survival in the adult dentate gyrus〔J〕.J Neurosci,2005;25(5):1089-94.
Effect of Venlafaxine on vascular endothelial growth factor in hippocampus in elderly rat model of depression
LI Na,ZHAO Xing-Rong,HU Jing,et al.
The First Hospital Affiliated Kunming Medical College,Kunming 650032,Yunnan,China
Objective To study the effect of antidepressant Venlafaxine on vascular endothelial growth factor(VEGF)in hippocampus in elderly rat model of depression.Methods 36 SD male rats in elder(20 months)were randomly and divided into 3 groups:venlafaxine,model and blank matched control group.Separation and chronic mild stress were used to establish depression in all rats except those in the blank matched control group for 5 weeks.Behavior of all animals was evaluated by open-field and fluid consumption test.VEGF expressions were detected by Western blot and RT-PCR after intraperitoneal injection respectively with venlafaxine to venlafaxine group or normal sodium to the model group at third weekend for 14 d.Results Venlafaxine group and the model group were established depression model successfully assessed by open-field and fluid consumption test.Compared with the blank control group,VEGF protein and VEGF mRNA expression in hippocampus were obviously increased in venlafaxine group(P<0.01 or P<0.05);but decreased in the model group(P<0.05).After venlafaxine administration for 14 d,VEGF protein and VEGF mRNA expression in hippocampus were significantly increased in venlafaxine group than those of model group(P<0.01).Conclusions Antidepressant venlafaxine treatment may increases VEGF expression in hippocampus of elderly rat depression model and promote angiogenesis.
Elderly depression;Hippocampus;Venlafaxine;Vascular endothelial growth factor
R749.4
A
1005-9202(2012)17-3713-04;
10.3969/j.issn.1005-9202.2012.17.046
云南省中青年学术和技术带头人后备人才培养(2004PY01-28);云南省教育厅科学研究基金项目(2010Y172)
1 昆明医学院神经科学研究所
王廷华(1968-),男,教授,博士生导师,主要从事神经元再生的基础研究。许秀峰(1962-),男,教授,硕士生导师,主要从事抑郁障碍的临床与基础研究。
李 娜(1975-),女,主治医师,在读博士,主要从事老年抑郁障碍临床与基础研究。
〔2011-08-15收稿 2011-12-30修回〕
(编辑 曹梦园)

