二氢青蒿素体外抑制胃癌细胞的黏附、迁移和侵袭
王爱军 冯俊伟 刘 萱 王红钰 高 宏 郑宝军 施 华
(唐山市工人医院肿瘤外科,河北 唐山 063000)
二氢青蒿素体外抑制胃癌细胞的黏附、迁移和侵袭
王爱军 冯俊伟 刘 萱1王红钰 高 宏2郑宝军 施 华
(唐山市工人医院肿瘤外科,河北 唐山 063000)
目的 探讨二氢青蒿素(DHA)对人胃癌SGC7901细胞体外黏附、迁移和侵袭的影响及其可能机制。方法 1.25、2.5、5、10、20 μmol/L DHA作用体外培养的人胃癌SGC7901细胞24 h后,MTT法检测细胞活力;1.25、2.5、5 μmol/L DHA作用人胃癌SGC7901细胞24 h后,细胞黏附分析检测细胞黏附率;细胞划痕实验观察其对细胞迁移能力的影响;Transwell小室侵袭实验观察其对细胞侵袭能力的影响;RT-PCR和Western印迹分别检测ICAM-1、MMP-2、MMP-9、TIMP-2 mRNA和蛋白的表达水平。结果 与对照组相比,1.25、2.5、5 μmol/L DHA对SGC7901细胞增殖没有影响,但显著抑制SGC7901细胞黏附、迁移和侵袭能力,且抑制作用具有剂量依赖性。RT-PCR和Western印迹结果显示,与对照组相比,5 μmol/L DHA作用人胃癌SGC7901细胞24 h,细胞内ICAM-1、MMP-2、MMP-9 mRNA和蛋白表达显著降低(P<0.05),TIMP-2 mRNA和蛋白表达显著增加(P<0.05)。结论 DHA可体外抑制胃癌SGC7901细胞的黏附、迁移和侵袭能力,其机制可能与上调TIMP-2的表达,下调ICAM-1、MMP-2、MMP-9的表达有关。
二氢青蒿素;胃癌;黏附;迁移;侵袭
胃癌是常见的恶性消化道肿瘤之一,术后肝、肺、骨等远处转移和复发是导致患者死亡的主要原因。侵袭、转移行为是恶性肿瘤的本质特性,也是肿瘤患者治疗失败和致死的主要原因,因此,抑制肿瘤侵袭成为抗肿瘤转移的重要环节〔1〕。二氢青蒿素(DHA)为青蒿素类药物在体内的主要活性代谢产物。已经证实,DHA具有很强的抗肿瘤活性,但目前尚未见到DHA抑制肿瘤细胞侵袭和转移的报道。因此,本研究将DHA作用于体外培养的人胃癌细胞株SGC7901,观察其对胃癌细胞侵袭转移能力的影响,并从分子水平上初步探讨其作用机制。
1 材料与方法
1.1 材料
1.1.1 细胞株 人SGC7901购自河北医科大学第四医院,用含10%胎牛血清、青霉素(100 U/ml)、链霉素(100 μg/ml)的RPMI 1640培养液常规(37℃,5%CO2)培养。细胞生长至80%融合状态时,以0.25%胰蛋白酶消化传代,隔日换液,每3~4 d传代1次。收集对数生长期细胞用于实验。
1.1.2 药物 DHA(批号:100184-200402)购于中国生物药品检定所。DHA用二甲基亚砜(DMSO)配成浓度为100 mmol/L的储液,-70℃保存。作用于细胞时再用RPMI 1640培养液稀释成不同终浓度(1.25、2.5、5、10、20 μmol/L)。以含 0.1%DMSO的培养基为阴性对照组,共分为6组。
1.1.3 主要试剂 胎牛血清、RPMI 1640培养基购自Gibco公司;胰蛋白酶、噻唑蓝(MTT)、DMSO购自Sigma公司;Matrigel胶购自美国BD Bioscience公司;Transwell侵袭小室购自美国Costar公司;RT-PCR试剂盒购自大连宝生物技术公司;细胞间黏附因子-1(ICAM-1)、基质金属蛋白酶(MMP)-2、MMP-9、MMP抑制剂(TIMP)-2和β-肌动蛋白(β-actin)PCR由上海生工生物技术公司合成;ICAM-1、MMP-2、MMP-9、TIMP-2、β-actin 一抗购自Santa Cruz公司。引物序列如下:ICAM-1上游:5'-TGTCTACTGACCCCAACCCTTGATG-3',下游:5'-GCAAGCTCCCAGTGAAATGCAAAC-3',扩增产物长 498 bp。MMP-2 上游:5'-TCTCCTGACATTGACCTTGGC-3',下 游:5'-AGGGTGCTGGCTGAGTAGAT-3',扩增产物长 300 bp。MMP-9 上游:5'-TCTACACCCAGGACGGCAAT-3',下游:5'-CGCCACGAGGAACAAACT GT-3',扩增产物长 370 bp。TIMP-2上游:5'-CTGGACGTTGGAGGAAAGAAGG-3',下游:5'-GCTGTTTCCAGGAAGGGATGTC-3',扩增产物长 450 bp。β-actin上游5'-CAGGGTGTGATGGTGGG-3',下游 5'-GGAAGAGGATGCGGCAG-3',扩增产物长度500 bp。
1.2 方法
1.2.1 细胞增殖分析 将对数生长期的SGC7901细胞分为对照组和 DHA 组,DHA 组加入含不同浓度(1.25、2.5、5、10、20 μmol/L)DHA的培养基,每组设置6个复孔,对照组加入等量的含0.1%DMSO的培养基。孵育20 h,各孔中加入MTT(浓度为5 mg/ml),继续培养4 h,弃去培养液,每孔加入DMSO 150 μl,室温振荡15 min。酶标仪490 nm测 OD值,求出其平均值。增殖率(%)=DHA组平均OD值/对照组平均OD值×100%。
1.2.2 细胞黏附分析 将1.25、2.5、5 μmol/L DHA处理24 h的SGC7901细胞消化离心后,按5×104个/孔的密度将细胞加入Matrigel包被好的96孔板中培养,每组设6个复孔,培养1 h后,弃去未黏附的细胞,加入100 μl RMPI 1640培养基和20 μl MTT(5 mg/ml)继续培养4 h,弃去培养液,每孔加入150 μl DMSO,室温振荡15 min。酶标仪490 nm测OD值。细胞黏附率(%)=DHA组平均OD值/对照组平均OD值×100%。
1.2.3 细胞划痕实验 将对数生长期的SGC7901细胞制成悬液,以1×106个/ml的密度接种于6孔板,待细胞生长至100%汇合后,吸去培养液,磷酸盐缓冲液(PBS)洗涤1次,用无菌吸头沿培养板底部划一直线形划痕。PBS再次洗去被刮下的未贴壁细胞,DHA组加入含1.25、2.5、5 μmol/L DHA 的培养基,对照组加入等量的0.1%DMSO培养基,继续培养24 h后,于显微镜下观察细胞伤口愈合情况。任意取5个视野,计数越过划线生长的细胞数。抑制率(%)=(1-DHA组迁移细胞的数量/对照组迁移细胞的数量)×100%。
1.2.4 Transwell小室侵袭实验 将 1.25、2.5、5 μmol/L DHA作用24 h的SGC7901细胞用0.25%胰蛋白酶消化,调整浓度为2×105个/ml,各组分别吸取200 μl接种于上层小室,将小室置于24孔板,下室加入含10%小牛血清的RPMI 1640培养液,培养24 h后,用棉签擦掉上室面的Matrigel和细胞,膜用甲醇固定10 min,结晶紫染色,高倍镜下随机计数5个视野中的细胞数。抑制率(%)=(1-DHA组侵袭细胞的数量/对照组侵袭细胞的数量)×100%。
1.2.5 RT-PCR 检测 ICAM-1、MMP-2、MMP-9、TIMP-2 mRNA的表达 收集5 μmol/L DHA作用24 h的SGC7901细胞,采用Trizol一步法从细胞中提取总RNA,使用紫外分光光度计和琼脂糖凝胶电泳鉴定RNA浓度及纯度。各组取等量RNA反转录,以反转录产物cDNA为模板进行PCR扩增目的片段,PCR反应条件为96℃ 4 min 预变性,95℃ 30 s、58℃ 40 s、72℃ 30 s,30个循环后,72℃延伸10 min。PCR扩增产物用1.5%琼脂糖凝胶电泳分离,扫描成像,用凝胶成像分析系统进行密度分析。以β-actin作为内参照。用各目的基因片段密度值/内参照密度值的比值进行比较。
1.2.6 Western 印迹分析 ICAM-1、MMP-2、MMP-9、TIMP-2 蛋白的表达 收集5 μmol/L DHA作用24 h的SGC7901细胞,冷的PBS清洗后,加入冷的蛋白裂解液冰上裂解30 min,4℃,离心取上清定量后,每孔上样蛋白(50 μg),经10%十二烷基硫酸钠(SDS)-聚丙烯酰胺分离,转移到氟偏聚丙烯(PVDF)膜上,5%脱脂奶粉封闭1 h,用各目标分子特异性一抗4℃孵育过夜,Tris盐酸缓冲液(TBST)漂洗3次,每次10 min,加相应二抗,室温孵育2 h,TBST漂洗3次,每次10 min,化学发光法显色,对条带进行吸光度积分扫描。目的基因蛋白表达量以各目的蛋白条带吸光度值/内参照β-actin吸光度值的比值表示。
1.3 统计学方法 采用SPSS13.0统计软件进行分析,计数数据以±s表示,采用ANOVA分析处理和Dunnett检验。
2 结果
2.1 DHA对 SGC7901细胞增殖的抑制作用 10、20 μmol/L DHA均能抑制SGC7901细胞的增殖,与对照组相比,差异有统计学意义(P < 0.05)。而 1.25、2.5、5 μmol/L DHA 作用SGC7901细胞,对细胞增殖没有明显的抑制作用(P>0.05)。为排除DHA对细胞的迁移和侵袭的作用受到细胞的活力的影响,后续实 验条件均采用 1.25、2.5、5 μmol/L DHA 作用SGC7901细胞24 h。见表1。
表1 DHA对SGC7901细胞增殖率的影响(n=6±s)
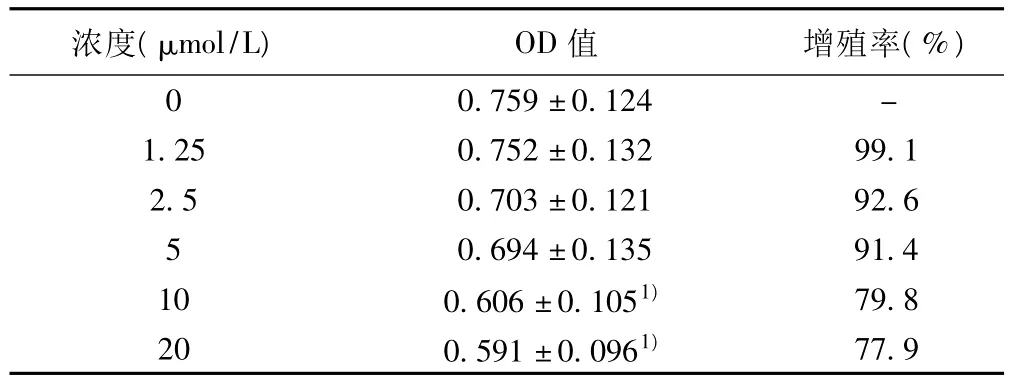
表1 DHA对SGC7901细胞增殖率的影响(n=6±s)
与0 μmol/L(对照)组比较:1)P <0.05;下表同
浓度(μmol/L) OD值 增殖率(%)0 0.759±0.124 -1.25 0.752±0.132 99.1 2.5 0.703±0.121 92.6 5 0.694±0.135 91.4 10 0.606±0.1051) 79.8 20 0.591±0.0961)77.9
2.2 DHA对SGC7901细胞黏附的影响 1.25、2.5、5 μmol/L DHA作用SGC7901细胞24 h,随着DHA浓度的增加,细胞黏附率逐渐下降,呈明显的剂量依赖关系,分别为(81.6±12.3)%、(65.3±10.5)%、(46.8±8.6)%。
2.3 DHA对SGC7901细胞迁移的影响 划痕实验结果显示,1.25、2.5、5 μmol/L DHA 对 SGC7901 细胞的迁移均有抑制作用,迁移抑制率分别为(26.1±4.8)%、(39.8±6.5)%和(50.5±8.3)%。
2.4 DHA对SGC7901细胞黏附、迁移和侵袭相关分子表达的影响 RT-PCR和Western印迹分析结果显示,与对照组相比,5 μmol/L DHA 作用 SGC7901细胞 24 h,细胞内 ICAM-1、MMP-2、MMP-9 mRNA和蛋白表达均明显降低(P<0.05),TIMP-2 mRNA和蛋白表达均明显增加(P<0.05)。见表2,表3,图1,图2。
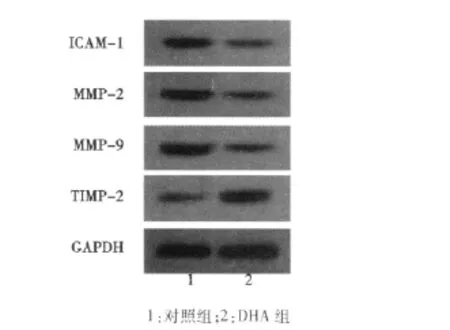
图2 DHA对 SGC7901细胞ICAM-1、MMP-2、MMP-9、TIMP-2蛋白表达的影响
表2 DHA对SGC7901细胞ICAM-1、MMP-2、MMP-9、TIMP-2 mRNA表达的影响(n=6±s)

表2 DHA对SGC7901细胞ICAM-1、MMP-2、MMP-9、TIMP-2 mRNA表达的影响(n=6±s)
组别ICAM-1 MMP-2 MMP-9 TIMP-2对照组0.73±0.25 0.66±0.18 0.57±0.13 0.24±0.05 DHA组 0.26±0.061) 0.33±0.081) 0.18±0.041) 0.53±0.121)
2.5 DHA对SGC7901细胞侵袭的影响 Transwell小室侵袭实验结果显示,不同浓度(1.25、2.5、5 μmol/L)DHA 作用SGC7901细胞24 h,细胞的侵袭能力随着作用浓度逐渐下降,侵袭抑制率分别为(13.2±3.1)%、(19.9±4.9)%、(27.6±5.6)%。
表3 DHA 对 SGC7901 细胞 ICAM-1、MMP-2、MMP-9、TIMP-2蛋白表达的影响(n=6±s)

表3 DHA 对 SGC7901 细胞 ICAM-1、MMP-2、MMP-9、TIMP-2蛋白表达的影响(n=6±s)
组别ICAM-1 MMP-2 MMP-9 TIMP-2对照组0.68±0.17 0.85±0.27 0.76±0.24 0.29±0.04 DHA组 0.34±0.051) 0.47±0.091) 0.23±0.031) 0.56±0.091)
3 讨论
青蒿素(artemisinin)及其衍生物是我国科学家自主研制的一类传统抗疟药,DHA是青蒿素的重要衍生物之一,其分子式为C15H24O5,分子量为284.35,水溶性强、口服利用度高。随着对DHA研究的深入,人们发现除了高效的抗疟作用外,DHA还具有抗炎、免疫调节及抗癌等生物学功能〔2~4〕,不仅如此,其抗肿瘤活性强,能抑制多种肿瘤细胞的生长,但作用机制还不完全明了。
肿瘤的侵袭转移是一个多阶段的复杂过程,从分子水平可概括为黏附、蛋白降解和移动三个步骤,这三个步骤不断连续反复进行,临床上表现为肿瘤细胞的侵袭、浸润和转移。因此,阻止任何一个步骤,都可以发挥抑制肿瘤迁移和侵袭的作用。本研究首先通过MTT分析,选用对细胞增殖没有影响的1.25、2.5、5 μmol/L三个浓度进行后续实验。黏附是肿瘤细胞侵袭的始动因素,只有肿瘤细胞与细胞外基质黏附后,才能穿透基底膜,降解细胞外基质,进一步侵袭周围组织。本研究首先通过黏附实验发现,DHA可剂量依赖抑制SGC7901细胞黏附率。ICAM-1是一种跨膜蛋白,能够介导细胞间及细胞与胞外基质间的黏附。本研究发现,对照组SGC7901细胞ICAM-1表达较高,DHA作用后,ICAM-1的表达呈剂量依赖性下降。
Matrigel被称为人工基底膜胶,主要由Ⅳ型胶原和层黏连蛋白组成,与基底膜结构非常相似,将Matrigel铺在Transwell小室膜上,能形成类似于天然基底膜的结构,可作为研究肿瘤细胞侵袭过程很好的体外模型。本文分别通过细胞划痕实验和Transwell小室侵袭实验证实了SGC7901细胞的迁移和侵袭能力也随着DHA浓度的增加逐渐降低。肿瘤要发生转移和侵袭,首先要降解和破坏细胞外基质(ECM),而MMPs家族是降解和破坏细胞外基质的主要蛋白水解酶类,在肿瘤转移过程中发挥着重要作用〔5〕。其中MMP-2和MMP-9是MMPs家族的重要成员,是一种依赖锌离子的蛋白水解酶。多种肿瘤细胞都可分泌MMP-2和MMP-9,二者通常以酶原的形式存在,激活后才能将基底膜和ECM中的胶原蛋白降解。MMPs的过表达或活性增高与胃癌生长、侵袭转移密切相关。本研究结果表明,DHA抑制了MMP-2和MMP-9的表达。
TIMPs是在体内分布广泛的一个多基因家族的编码蛋白,是MMPs的天然抑制剂,可通过与MMPs非共价结合抑制其活性。在负性调节基底膜降解过程中,TIMPs与MMPs之间存在着微妙的平衡关系,在胃癌细胞的迁移、侵袭转移过程中均发挥着重要的作用〔6〕。如果TIMPs与MMPs之间的平衡被打破,也会导致肿瘤的侵袭转移。本研究发现DHA作用SGC7901细胞后,可显著上调TIMP-2的表达,提示DHA可通过多种途径抑制胃癌转移。
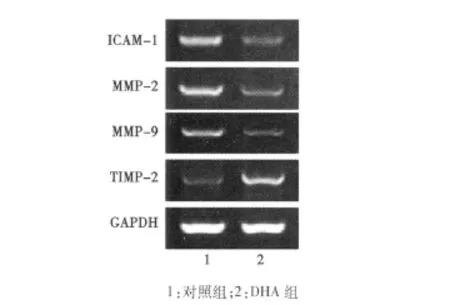
图1 DHA对 SGC7901细胞ICAM-1、MMP-2、MMP-9、TIMP-2 mRNA表达的影响
综上所述,DHA可体外抑制SGC7901细胞的黏附、迁移和侵袭能力;其机制可能与上调TIMP-2的表达,下调ICAM-1、MMP-2、MMP-9的表达有关。然而,由于体外实验的局限性和体内生理环境的复杂性,尚需结合更深入的体内实验,继续探讨DHA对SGC7901细胞生物学行为的分子机制,以期为临床治疗胃癌提供有力的实验依据。
1 Noh HJ,Sung EG,Kim JY,et al.Suppression of phorbol-12-myristate-13-acetate-induced tumor cell invasion by apigenin via the inhibition of p38 mitogen-activated protein kinase-dependent matrix metalloproteinase-9 expression〔J〕.Oncol Rep,2010;24(1):277-83.
2 Li HJ,Wang W,Li YZ,et al.Effects of artemether,artesunate and dihydroartemisinin administered orally at multiple doses or combination in treatment of mice infected with Schistosoma japonicum〔J〕.Parasitol Res,2011;109(2):515-9.
3 Noori S,Hassan ZM.Dihydroartemisinin shift the immune response towards Th1,inhibit the tumor growth in vitro and in vivo〔J〕.Cell Immunol,2011;271(1):67-72.
4 Lu JJ,Chen SM,Zhang XW,et al.The anti-cancer activity of dihydroartemisinin is associated with induction of iron-dependent endoplasmic reticulum stress in colorectal carcinoma HCT116 cells〔J〕.Invest New Drugs,2011;29(6):1276-83.
5 Patel S,Sumitra G,Koner BC,et al.Role of serum matrix metalloproteinase-2 and-9 to predict breast cancer progression〔J〕.Clin Biochem,2011;44(10-11):869-72.
6 de Mingo M,Morán A,Sánchez-Pernaute A,et al.Expression of MMP-9 and TIMP-1 as prognostic markers in gastric carcinoma〔J〕.Hepatogastroenterology,2007;54(73):315-9.
R735.2
A
1005-9202(2012)17-3716-04;
10.3969/j.issn.1005-9202.2012.17.047
1 唐山市工人医院耳鼻喉科 2 唐山市工人医院泌尿外科
王爱军(1967-),男,硕士,副主任医师,主要从事普外肿瘤的临床与基础研究。
〔2012-01-03收稿 2012-01-13修回〕
(编辑 袁左鸣)

