芦丁对大鼠肠缺血再灌注损伤的保护作用
黄金珠
芦丁对大鼠肠缺血再灌注损伤的保护作用
黄金珠
目的观察芦丁对肠缺血再灌注损伤的保护作用,探讨其可能的机制。方法 将40只健康Wistar大鼠随机分为4组(每组10只):A组为假手术对照组,B组为缺血再灌注组,C组为缺血再灌注+维生素C组,D组为缺血再灌注+芦丁组。所有大鼠均行开腹手术并分离肠系膜上动脉。A组不夹闭肠系膜上动脉,B组、C组、D组夹闭肠系膜上动脉45 min,再复灌60 min。C组于复灌前10 min静脉给予维生素C注射液180mg/kg,D组于复灌前10min静脉给予芦丁注射液50mg/kg。复灌60min后由腹主动脉穿刺采血制备血清检测SOD、MPO、D-乳酸、内毒素,处死动物取小肠组织,制备肠组织匀浆检测SOD、MPO。结果B组与A组相比,B组大鼠血清及肠组织中SOD含量明显减少,MPO水平增高,血清中D-乳酸和内毒素的水平增高;D组与B组比较,D组中血清及肠组织的SOD含量显著增加,MPO水平下降,血清中的D-乳酸和内毒素水平有所减少,并且,D组血清及肠组织的SOD含量高于C组,MPO的水平低于C组,血清中D-乳酸和内毒素的水平比C组低。结论芦丁具有保护肠缺血再灌注损伤的作用,其机制可能是降低氧自由基的水平,恢复SOD活性,抑制脂质过氧化反应,保护了肠道屏障功能,使得细菌“移位”减少,并抑制炎症反应。
肠缺血再灌注;芦丁;超氧化物歧化酶;D-乳酸;内毒素;髓过氧化物酶
各种原因导致缺血时,组织器官会出现细胞代谢障碍和结构破坏等损伤,而当恢复血流时,上述损伤反而进一步恶化,这种现象称为缺血再灌注损伤(ischemia reperfusion injury,IRI)。肠道是缺血再灌注损伤发生的高危场所,尤其在一些较为严重的临床疾病如休克、感染、创伤、手术、心肺功能不全等的发生发展中,肠缺血再灌注损伤成为这些疾病恶化的助推器。肠缺血再灌注时不仅损伤肠道本身,还会因为屏障功能的损坏,导致肠内大量细菌和毒素入血,进而使网状内皮系统产生一系列反应,释放出更多的细胞因子和炎症介质,引发脓毒血症、全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)和多脏器功能不全综合征(multiple organ dysfunction syndrome,MODS)。预防与阻止上述严重问题的发生与发展是当今临床工作中面临的难点与焦点,因此肠组织成为研究探讨缺血再灌注损伤的重要方向之一。
芦丁(rutin)又名芸香苷、紫槲皮苷,属于黄酮类化合物,具有抗自由基活性、抗脂质过氧化作用、抑制血小板激活因子(PAF)、抑制低密度脂蛋白的氧化修饰、抑制醛糖还原酶、舒张血管、降低毛细血管通透性和脆性等药理活性,已广泛应用于临床[1],但目前用于肠缺血再灌注损伤方面的报道较少见。本实验旨在通过动物模型,观察芦丁在大鼠肠缺血再灌注损伤中的作用效果,以探究其可能的保护机制。
1 材料与方法
1.1 动物分组及模型制作 40只健康Wistar大鼠(不限♀♂),体重220~280 g,由华中科技大学同济医学院提供。所有大鼠均无消化道症状,未使用过抗生素及影响肠道菌群的药物。随机将大鼠分为4组,每组10只。所有大鼠禁食12 h,饮水自由,称重后腹腔内注射10%水合氯醛(0.3 ml/100 g)麻醉。将大鼠仰卧固定,腹部脱毛并消毒,取上腹正中部位切口进腹,暴露出肠系膜上动脉(superiormesenteric artery,SMA)。A组:假手术对照组,开腹后只分离出肠系膜上动脉;B组:缺血再灌注组,用无创动脉夹夹闭肠系膜上动脉根部造成缺血,45 min后去掉动脉夹,使血液再灌注60 min;C组:缺血再灌注+维生素C组,手术同B组,在松夹之前10 min经股静脉给予维生素C注射液180 mg/kg;D组:缺血再灌注+芦丁组,手术同B组,在松夹之前10 min经股静脉给予芦丁注射液50 mg/kg。
1.2 标本采集 松夹60 min后,由腹主动脉穿刺采血4 m l,静置30 min,离心(3000r/min)10 min,取上清液,即血清,-70℃保存备用。采血后处死大鼠,距离盲肠10 cm处取长4 cm的小肠一段,剪开清洗后,精确秤取0.2 g,添加2 ml 4℃生理盐水,低温下匀浆30秒,保持4℃离心(4500 r/min)30 min,取上清液,即肠组织匀浆,-70℃保存备用。
1.3 检测指标 检测血清和肠组织中超氧化物歧化酶(SOD)、髓过氧化物酶(MPO),血清 D-乳酸、内毒素水平。采用SOD、D-乳酸、内毒素、MPO测定试剂盒,按照说明书进行操作。
1.4 统计学处理 采用SPSS 18.0统计软件包进行数据分析。所有数值用均数±标准差(±s)表示。以P<0.05表示差异有统计学意义。
2 结果
2.1 血清及肠组织中SOD含量见表1。
表1 SOD levels in the serum and intestinal tissue(±s)
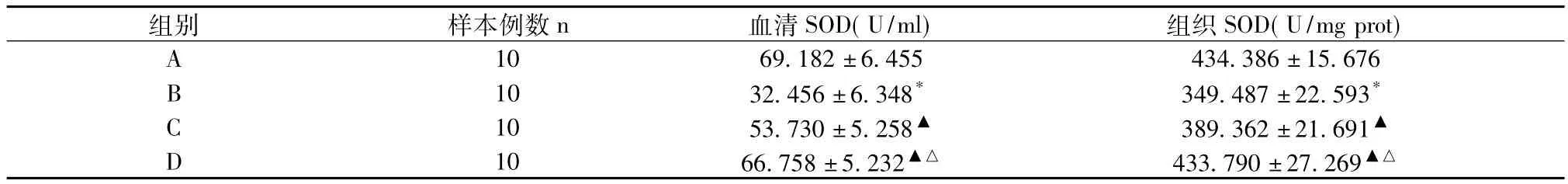
表1 SOD levels in the serum and intestinal tissue(±s)
注:B组与A组比较,*P<0.05;C组与B组比较,D组与B组比较,▲P<0.05;D组与C组比较,△P<0.05
组别 样本例数n 血清SOD(U/ml) 组织SOD(U/mg prot)A 10 69.182±6.455 434.386±15.676 B 10 32.456±6.348* 349.487±22.593*C 10 53.730±5.258▲ 389.362±21.691▲D 10 66.758±5.232▲△ 433.790±27.269▲△
3 讨论
肠缺血再灌注损伤发生机制非常复杂,但大量氧自由基产生的破坏作用已经明确[2]。超氧化物歧化酶(SOD)是内源性抗氧自由基物质,如果氧自由基生成过多,那么SOD就会被大量消耗掉,我们把SOD活性的变化作为观察缺血再灌注中氧自由基产生的指标。本实验显示,B组大鼠血清和组织中的SOD活性明显低于A组(P<0.05),说明在肠缺血再灌注中有大量的氧自由基产生。而C组和D组大鼠血清和组织中SOD活性均高于B组(P<0.05),说明维生素C和芦丁均具有抗氧化的作用,并且芦丁的抗氧化能力强于维生素C(P<0.05)。这与前人对芦丁抗氧自由基的研究结果相一致[3]。
人体不会产生D-乳酸,它是由消化道内的定植细菌产生,如克雷伯杆菌、大肠杆菌等。病理情况下,如严重创伤、休克、胰腺炎等,肠道黏膜保护屏障被破坏,D-乳酸就会进入循环血液,并且人体也不能或仅能缓慢把它代谢掉。经动物实验研究发现,急性肠道缺血可使D-乳酸含量迅速升高[4],其水平会随着缺血时间的延长而增高[5,6]。内毒素是革兰氏阴性细菌细胞壁的一种成分,如果肠道革兰氏阴性细菌过度生长,就会扩大内毒素池,此时若肠道屏障受损,就会使细菌和内毒素溢入血液循环,即所谓的“移位”现象,进一步对全身器官组织造成严重损害,甚至引起SIRS和MODS。本实验证实,B组大鼠血清中D-乳酸和内毒素水平明显高于A组(P<0.05),说明肠缺血再灌注后肠黏膜屏障严重损坏,通透性显著增加,细菌发生了“移位”。D组中D-乳酸和内毒素水平低于B组和C组(P<0.05),说明芦丁可能抑制了肠道菌群“移位”,阻止损伤的加重。
研究表明抑制中性粒细胞的激活可以保护小肠缺血再灌注损伤[7]。无论是缺血期还是再灌注期,组织中都存在大量中性粒细胞聚集,它被激活后会释放大量氧自由基,尤其在再灌注期氧供充足时,氧自由基的产生呈爆发式。氧自由基加上各种炎症介质和细胞因子,一方面直接造成肠组织细胞损伤,另外一方面参与介导SIRS和MODS的发生发展。中性粒细胞的嗜天青颗粒中有一种能清除氧自由基的酶-髓过氧化物酶(MPO),每个中性粒细胞所含的MPO的量是一定的,所以MPO被公认为中性粒细胞的标志物[8]。本实验发现,B组比A组肠组织中的MPO增多(P<0.05),表明缺血再灌注时有大量中性粒细胞向肠组织聚集并且活化,D组MPO明显少于B组和C组(P<0.05),说明芦丁可以抑制中性粒细胞的聚集,这可能与芦丁的抗炎作用有关,武征等人通过大鼠急性胰腺炎模型证实,芦丁通过抑制NF-κB的活化使靶基因TNF-α、ICAM-1等炎症性细胞因子表达降低,从而抑制炎症级联反应[9]。
4 结论
芦丁可降低肠缺血再灌注损伤中氧自由基的水平,恢复SOD活性,抑制脂质过氧化反应,保护肠道屏障功能,改善肠黏膜通透性,使细菌“移位”减少,抑制炎症反应,起到对肠缺血再灌注损伤的保护作用。
[1]林静.芦丁的临床药理特点.中国临床药理学杂志,2009,25(3):263.
[2]Hoffman JW Jr,Gilbert TB,Poston RS,et al.Myocardial reperfusion injury:etiology,mechanisms,and therapies.Extra Corpor Technol,2004,36(4):391-411.
[3]顾洪雁,张媛英,翟静,等.维生素C和芦丁对力竭运动小鼠组织自由基代谢的影响.中国临床康复,2005,44(9):132-134.
[4]Novak F,Heyland DK,Avenell A,etal.Glutamine supplementation inserious illness:a systematic review of the evidence.Crit CareMed,2002,30(9):2022-2029.
[5]MS,Uribarri J,et al.Metabolic utilization and renal handling of D-lactate in men.Metabolism,1985;34:621-625.
[6]孙晓庆,吕艺,晋桦,等.大鼠肠缺血再灌流损伤对肠黏膜通透性的影响.创伤外科杂志,1999,1(4):208-210.
[7]Farmer DG,Anselmo D,Da Shen X,et al.Disruption of P-selectin signaling modulates cell traf-ficking and results in improved outcomes aftermousewarm intes-tinal ischemia and reperfusion injury.Transplantation,2005,80:828-35.
[8]Yu JR,Yan S,Liu XS,etal.At-tenuation of graft ischemia-reperfusion injury by urinary trypsininhibitor in mouse intestinal transplantation.World JGastroenterol,2005,11:1605-9.
[9]武征,赵维中,汪琳,等.芸香苷对实验性急性胰腺炎肺损伤的保护作用及机制.中国药理学通报,2006,22(9):1125.
473061 南阳医学高等专科学校
2.2 血清中D-乳酸、内毒素含量见表2。
表2 D-lactate and Endotoxin levels in the serum(±s)
注:B组与A组比较,C组与A组比较,*P<0.05;D组与B组比较,▲P<0.05;D组与C组比较,△P<0.05
组别 样本例数n 血清D-乳酸(mmol/L) 血清内毒素(EU/ml)A 10 0.178±0.027 0.168±0.045 B 10 0.398±0.033*0.212±0.023*C 10 0.323±0.029*0.209±0.048*D 10 0.199±0.031▲△0.179±0.019▲△
2.3 血清及肠组织中MPO含量见表3。
表4 MPO levels in the serum and intestinal tissue(±s)
注:B组与A组比较,*P<0.05;C组与B组比较,▽P<0.05;D组与B组比较,▲P<0.05;D组与C组比较,△P<0.05
组别 样本例数n 血清MPO(u/ml) 组织MPO(u/ml prot)A 10 48.16±7.14 0.39±0.12 B 10 128.39±30.452*1.54±0.19*C 10 84.67±7.97▽0.92±0.08▽D 10 59.67±9.81▲△0.54±0.10▲△

