人脐静脉内皮细胞的分离及原代培养体会
杜利君,蒋兴亮
(1.南充市中心医院,川北医学院第二临床医学院;2.川北医学院附属医院,四川南充 637000)
体外建立人血管内皮细胞模型是研究人体大血管内皮功能的主要手段之一。由于内皮细胞株ECV304在形态学、基因学等生物特性上与内皮细胞比较存在明显差异[1],因此,体外分离和原代培养人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs)已成为国内外学者获取内皮细胞的重要途径。本实验在借鉴其他学者体外分离、培养HUVECs技术的基础上,通过大量的实验并对此加以改良,旨在建立一种操作简便、且能够获得数量较多及活力良好的HUVECs的分离、培养方法,为进一步研究血管内皮细胞的功能及阐明相关疾病的生理和病理机制奠定基础。
1 材料与方法
1.1 材料
M199培养液和胎牛血清分别为Invitrogen公司和Hyclone公司产品,IV型胶原酶、内皮细胞生长因子(ECGS)、肝素钠均为Sigma公司产品,胰蛋白酶为Amresco公司产品,PBS、兔抗人Ⅷ因子抗体及FITC标记的羊抗兔IgG抗体为北京中杉金桥公司产品,青霉素和链霉素为华北制药股份有限公司产品。25 cm2培养瓶和15 mL无菌离心管为Corning公司产品,0.22 μm一次性过滤器为Millipore产品。二氧化碳细胞培养箱、超净工作台为Heal Force公司生产,倒置荧光显微镜为Olympus公司生产。
1.2 脐带来源
收集川北医学院附属医院剖腹产新生儿脐带。选择无HBV和HIV感染、无妊娠期高血压的健康孕妇,剖腹产手术后无菌获取15~20 cm新生儿脐带,保存于4℃ PBS液中,2 h内分离HUVECs。
1.3 方法
1.3.1 人脐静脉内皮细胞的分离 无菌条件下取长度为15~20 cm的新生儿脐带,立即于超净工作台内剪去脐带两端的钳痕、血肿并修齐断面,找到管壁较薄、管腔略大的脐静脉。将7号静脉输液针、连带针鞘一并轻轻插入脐静脉内,用止血钳固定输液针,输液针的另一端连接20 mL注射器,吸取37℃预热的PBS冲洗脐静脉至流出的液体无色透明。抽取37℃预热的0.1%IV型胶原酶溶液将脐静脉内剩余的PBS冲出,待下端流出黄色胶原酶溶液时用止血钳夹闭血管,继续注入胶原酶溶液至脐静脉充盈饱满,37℃消化10 min。将脐带用无菌纱布包裹,轻轻揉搓1~2 min,促进脐静脉内皮细胞从管壁脱落。将消化液收集于离心管内,用含20%FBS的培养液冲洗脐静脉,将其一并收集于离心管内,1 000 r/min离心10 min,弃上清,加入37℃预热的M199完全培养基(含20%胎牛血清、25 μg/mL内皮细胞生长因子、0.25 mg/mL肝素、100 U/mL青霉素和 100 U/mL链霉素),吹打混匀,制成 1×106/mL的细胞悬液,将其接种至25 cm2的培养瓶中,置于37℃、5%CO2的细胞培养箱培养。24 h后更换培养液,以后每隔2~3 d换液,直至细胞长至80%融合状态。
1.3.2 人脐静脉内皮细胞的传代培养 当内皮细胞长至80%融合状态时,在无菌操作下吸弃旧培养液,PBS洗涤细胞2次。加入0.25%胰蛋白酶溶液,倒置显微镜见大部分细胞开始回缩变圆时,迅速吸弃胰蛋白酶溶液,加入5 mL M199完全培养基中止消化。反复吹打瓶底贴壁细胞使之脱落,加入足量的M199完全培养基制成细胞悬液,按1∶3的比例将其接种于新的培养瓶内,置于细胞培养箱培养。24 h后更换培养液,以后每隔2~3 d换液,直至细胞生长至80%融合状态。
1.3.3 人脐静脉内皮细胞的鉴定 ①人脐静脉内皮细胞的接种:取生长至80%融合状态的第1~2代细胞,用0.25%胰蛋白酶溶液常规消化,将密度为5×105/mL的细胞悬液接种至六孔板内的无菌盖玻片上,置于细胞培养箱培养。②形态学鉴定:每隔24 h,在倒置显微镜下观察细胞的生长状态和形态特点。③免疫荧光鉴定(以下操作均是先吸弃上清,再加入100 μL作用液)。
当细胞生长至80%融合状态时,用37℃预热的PBS洗涤细胞3次。预冷的4%多聚甲醛固定10 min,PBS荡洗3次,每次5 min。10%封闭正常羊血清室温封闭30 min,加入兔抗人Ⅷ因子抗体(稀释度1∶100),对照组以 PBS代替Ⅷ因子抗体,置于4℃湿盒内孵育过夜(10 h)。PBS洗涤4次,每次5 min。加入FITC标记的羊抗兔IgG(稀释度1∶100),37℃湿盒内避光作用30 min。PBS洗涤4次,每次10 min。荧光倒置显微镜下观察并采集图片。
2 结果
2.1 人脐静脉内皮细胞的形态学观察
原代分离的人脐静脉内皮细胞单个或聚集成团,2 h后大部分细胞开始贴壁生长。贴壁后,单个细胞呈多角形或长梭形生长,成团的细胞逐渐伸展为中心排列密集、边缘排列较疏松的单层细胞集落,呈鱼贯状相连或旋窝状排列,周边细胞多为长梭形并游离向外生长。传代培养细胞生长较快,接种后0.5~1 h大部分细胞开始贴壁,呈单个、圆形并散在均匀分布;12~24 h多数细胞呈小多角形或圆形,少数细胞形态伸展,呈短梭形,单个或团簇存在;24~72 h细胞生长加快,胞核清晰,胞浆丰富,内含小颗粒,细胞呈长梭形或椭圆形生长,逐渐融合成片,呈扁平多角形相互嵌合,如典型的铺路石状镶嵌 排列(图1)。
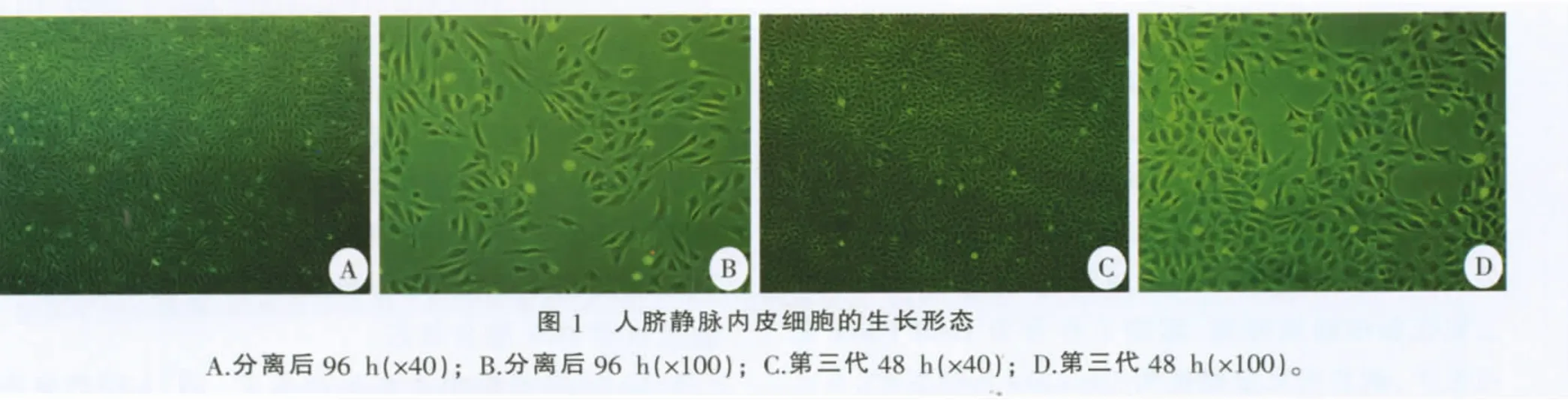
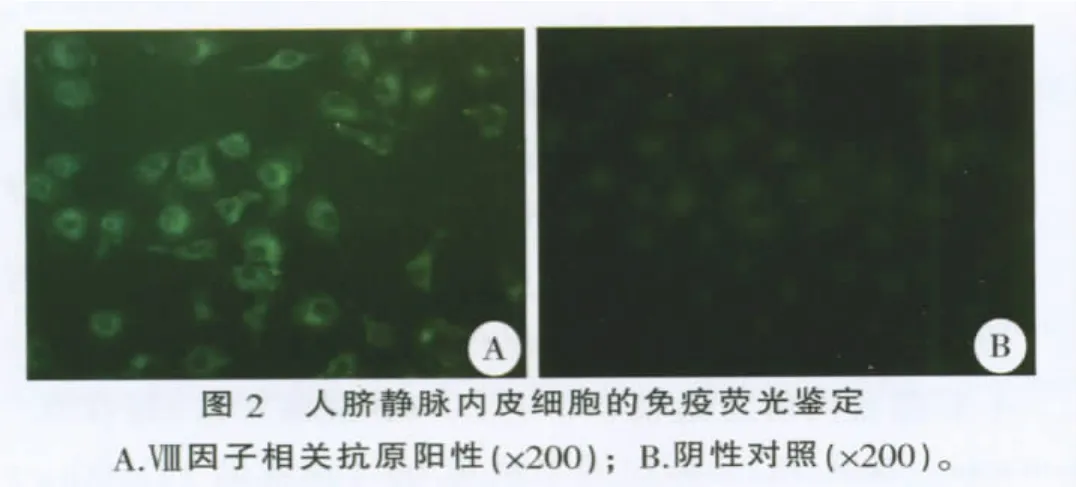
2.2 人脐静脉内皮细胞的免疫荧光鉴定
加入Ⅷ因子抗体的细胞轮廓清晰,99%以上细胞的胞浆内有绿色荧光颗粒,胞核呈黑色无荧光着染;而阴性对照孔中仅见模糊的细胞轮廓,无荧光着染(图2)。提示分离得到的细胞有Ⅷ因子相关抗原存在,鉴定为人脐静脉内皮细胞。
3 讨论
内皮细胞是血管壁的重要组成部分,具有重要的屏障功能。内皮细胞结构、功能受损是动脉粥样硬化发生的始动因素,在心脑血管疾病的发生发展中具有重要作用[2]。本研究选择人脐静脉内皮细胞作为获取血管内皮细胞的来源,是因为HUVECs具有以下优点:①与来源于其它哺乳动物(牛、兔、鼠)的血管内皮细胞相比,HUVECs可使实验条件和所获结果更符合人体情况。②相对于人体其它血管来说,脐静脉流动的是含氧丰富的动脉血,HUVECs结构和功能接近于动脉内皮细胞。此外,新生儿脐带来源丰富,取材方便,且能获得较多数量的内皮细胞,为后续实验的顺利进行奠定了基础。③原代人脐静脉内皮细胞与内皮细胞株的比较。内皮细胞株ECV304 已被证实为膀胱癌上皮细胞[3],Brown 等[1]研究显示,与原代人脐静脉内皮细胞比较,ECV304在形态学、基因学等生物特性上存在明显差异。此外,路静等[4]研究发现与原代人脐静脉内皮细胞相比,HUVECs细胞株部分抗原减弱或丢失,可能与其传代次数过多有关。
人脐静脉内皮细胞分离及原代培养的影响因素较多,其中忽略任何一个环节都可能导致实验失败。我们在借鉴其他国内外学者采用酶灌注消化法[5]分离人脐静脉内皮细胞技术的基础上,经过多次摸索,主要有以下体会。①无菌培养:严格的无菌观念、无菌操作是保证细胞体外生存的首要条件。②新鲜脐带:脐带离体2 h内完成脐静脉内皮细胞的分离,此时细胞成活率最高。③胶原酶和消化时间:多数文献选择8~15 min作为胶原酶消化时间[6],但本研究通过多次摸索认为胶原酶的活力不仅与消化时间有关,还与酶的生产批号、消化温度以及是否新鲜配置等因素相关。根据以上影响胶原酶活力的因素,严格掌握消化时间是成功分离内皮细胞的关键。④灌注揉搓法分离HUVECs:有研究[7]认为,“灌注搓揉法”能获得较多数量的HUVECs,但我们通过多次摸索认为,如果消化酶的活力较强则不宜用灌注揉搓法,否则易有静脉壁中层的细胞消化参杂。而且,此过程中揉搓的力度必须轻柔,需要反复摸索控制揉搓力度。⑤HUVECs生长营养条件:HUVECs是一种增殖能力相对较低的细胞,对营养成分要求较高。优质胎牛血清和优质培养液必不可少,此外,添加生长因子和肝素亦能明显促进内皮细胞分裂增殖[8]。⑥培养基pH值:培养基pH值是影响细胞生长的重要因素之一。M199培养基可加入能较长时间控制恒定pH值范围的10 mmol/L HEPES缓冲液,使培养液pH值为7.0左右,这样易于细胞贴壁生长。此外,4℃保存的培养基在使用前将其置于5%CO2细胞培养箱内37℃预热以调整培养基的pH,有利于细胞生长。⑦HUVECs接种密度:原代分离HUVECs接种密度约为1×106个/mL,传代细胞以(1~4)×105个/mL的密度接种,细胞分布均匀,生长状态良好。⑧HUVECs实验代数:采用3~5代的细胞实验,随着传代次数增加,5代以上的细胞增殖减慢,且细胞胞浆逐渐减少,细胞变得较为扁平,呈煎鸡蛋状,与3~5细胞的形态有较大差别。
关于内皮细胞的鉴定,我们在相差倒置显微镜下观察发现分离得到的细胞呈梭形或椭圆形生长,单层铺路石状排列或呈漩涡状排列,具有HUVECs典型的形态学特点。此外,我们还通过最为可靠的免疫荧光抗体法证明胞浆内有Ⅷ因子相关抗原存在。因为人体的Ⅷ因子相关抗原仅在内皮细胞、血小板和巨噬细胞中存在,所以可与血管平滑肌细胞和成纤维细胞鉴别。通过免疫荧光技术检测,在荧光显微镜下观察,我们发现细胞的胞浆内有大量绿色荧光颗粒,提示分离得到的细胞有Ⅷ因子相关抗原存在,以及结合形态学观察鉴定为人脐静脉内皮细胞。
通过对30余例人脐静脉内皮细胞的分离和传代培养,我们认为采用酶消化法分离、培养脐静脉内皮细胞的方法简单、可靠。此方法不仅能够获得足够数量和高纯度的血管内皮细胞,并且细胞活力高,增殖能力强,是体外研究血管内皮细胞的理想方法,对进一步研究血管内皮细胞的生物学特性及其与各种疾病的关系有重要意义。
[1] Brown J,Reading SJ,Jones S,et al.Critical evaluation of ECV304 as a human endothelial cell model defined by genetic analysis and functional responses:a comparison with the human bladder cancer derived epithelial cell line T24/83[J].Lab Invest,2000,80(1):37-45
[2] Victor VM,Rocha M,Solá E,et al.Oxidative stress,endothelial dysfunction and atherosclerosis[J].Curr Pharm Des,2009,15(26):2988-3002
[3] Dirks WG,MacLeod RA,Drexler HG.ECV304(endothelial)is really T24(bladder carcinoma):cell line cross-contamination at source[J].In Vitro Cell Dev Biol Anim,1999,35(10):558-559
[4] 路 静,白睿华,杨洪艳,等.原代脐静脉内皮细胞与脐静脉内皮细胞株的生物学特性比较[J].第四军医大学学报,2008,29(20):1888-1891
[5] Baudin B,Bruneel A,Bosselut N,et al.A protocol for isolation and culture of human umbilical vein endothelial cells[J].Nat Protoc,2007,2(3):481-485
[6] 吴金义,张 蕾,张秀英,等.人脐静脉内皮细胞分离培养及鉴定技术[J].中国实验诊断学,2010,14(4):511-513
[7] 吕艳欣,金 松,王 琳,等.人脐静脉内皮细胞的体外培养[J].齐齐哈尔医学院学报,2009,30(8):918-919
[8] Hewett PW.Vascular endothelial cells from human micro and macrovessels:isolation,characterisation and culture[J].Methods Mol Biol,2009,467:95-111

