去甲肾上腺素对吗啡依赖大鼠中枢痛觉的调制
石铁锋,杨春晓,杨东晓,闫彬彬,许 艳,张 辉,张 颖,徐满英
(哈尔滨医科大学1.附属第二医院、2.生理学教研室,黑龙江 哈尔滨 150081)
阿片类药物依赖已成当今世界的重要社会问题之一,不仅危害人类的身心健康和家庭幸福,而且还严重地干扰了社会安宁和生产发展。吗啡依赖是一种顽固的、慢性复发性脑病[1],是多个脑区、多种神经递质参与的复杂的一系列神经系统适应性改变。动物在吗啡依赖过程中,脑内肾上腺素能等神经递质系统发生一定变化,这些变化可能与吗啡成瘾的产生有密切关系。
在大鼠脑内,去甲肾上腺素(NE)是一种重要的神经递质。NE参与许多脑功能,包括觉醒、注意力、情绪、学习、记忆和应激反应[2]。NE对疼痛的影响是复杂的。NE对疼痛的作用取决于其在中枢神经系统的特异位点,NE能受体亚型的分布,病理性疼痛状态的持续时间和当时的情况。NE和其他化学物质在下行抑制系统发挥重要的作用。NE可抑制C纤维传导周围伤害性刺激信息到脊髓侧角[3]。
伏核(NAc)是位于边缘系统和基底神经节交界处的一个较大的核团。NAc接受大脑不同区域的各种神经纤维的投射,参与调节机体的多种功能,如药物成瘾、行为、学习、运动和心血管活动等。NAc还含有丰富的内源性阿片肽,并在中枢神经系统疼痛传送和调制中起着重要作用。NAc内的阿片肽和胆囊收缩素相互作用可以调节疼痛。来自中脑导水管周围灰质(PAG)神经纤维上行投射到NAc和NAc神经纤维下行投射到PAG,它们均参与镇痛作用。我们研究室已证明[4],谷氨酸、地卓西平马来酸盐和N-甲基-D-天冬氨酸受体参与NAc内伤害性信息传送的调制。近年来,多项研究已经证实在NAc内存在NE,并表明它在疼痛调节中起着重要作用[5]。但是,NE和酚妥拉明对吗啡依赖大鼠NAc内PENs和PINs的痛诱发电活动的影响尚不清楚。因此,本研究使用细胞外的电生理记录技术,探讨NE和酚妥拉明对吗啡依赖大鼠NAc内PENs和PINs的痛诱发电活动的影响,以便揭示NE和NAc在吗啡依赖大鼠中枢痛觉生产和调制的作用。
1 材料和方法
1.1 动物 实验选用成年、健康Wistar大鼠,清洁级,♀♂不拘,体质量为220~250 g(哈尔滨医科大学附属第二医院动物中心提供,级别:Ⅱ,许可证号:黑20020002)。
1.2 方法 大鼠在注射盐酸吗啡前,记录30 min的行为变化。然后,大鼠按逐日递增剂量的原则,背部皮下注射盐酸吗啡,连续给药6 d,每日药量依次为:5、10、20、40、50、60 mg·kg-1,3 次 .d-1(8 ∶00,12 ∶00,16 ∶00),建立吗啡成瘾大鼠的模型[6-7]。
将60只吗啡依赖大鼠随机地分为3组:(1)生理盐水组(20只):NAc内注射生理盐水0.5 μl;(2)NE 组(20 只):NAc内注射 NE(4 g·L-1,0.5 μl);(3)酚妥拉明组(20只):NAc内注射酚妥拉明(4 g·L-1,0.5 μl);给每种药的时间均为2 min。d 7 早8∶00观察大鼠的自然戒断症状后,开始实验。吗啡依赖大鼠用200 g·L-1氨基甲酸乙酯(5 ml·kg-1,北京化工厂)腹腔注射麻醉和 50 g·L-1利多卡因必要时创口补充麻醉下实施常规手术,即气管插管、颅骨开窗、挑开小脑延髓池处的硬脑膜引流脑脊液和分离坐骨神经。术后,将大鼠头部固定在SN-2脑立体定位仪(Narishige,Japan)上。大鼠腹腔注射温生理盐水5 ml补液,热水袋保暖,维持肛温37℃ ~38℃。根据 Pellegrino图谱 B座标系统[8],对NAc进行定位:A:3.2~4.0 mm;R 或 L:1.0~1.8 mm;H:6.2~7.0 mm。然后进行人工呼吸,并大鼠腹腔注射1 g·L-1氯化筒箭毒碱 (1 ml·kg-1)制动,以松弛肌肉排除肌细胞电活动对本实验的影响。将带保护的两根银丝刺激电极平行钩在坐骨神经上,松紧适宜,用液体石蜡浸没神经。SEN-3301型电子刺激器(Nihon Konden,Japan)发出的串脉冲(延迟:0 ms,间隔:5 ms,强度:5 mA,持续时间:0.3 ms,脉冲:5个)刺激大鼠坐骨神经,作为伤害性痛刺激。关节运动和毛发触摸被用作非伤害性刺激,以确定疼痛相关的神经元。将内充3 mol·L-1氯化钾溶液,直流电阻为10~30 MΩ的玻璃微电极固定在SM-21型微电极操纵器(Narishige,Japan)上,并插入NAc内引导痛反应神经元的放电。根据Pellegrino图谱B座标系统[8],将内充生理盐水或NE、酚妥拉明的玻璃微电极固定在SM-11型微电极操纵器(Narishige,Japan)上,并插入NAc(A:3.6 mm;R或L:1.6 mm;H:6.2 mm)内,然后用ZCZ-50型自动抽注仪分别向NAc内匀速注入0.5 μl的生理盐水或 NE(4 g·L-1,0.5 μl)、酚妥拉明(4 g·L-1,0.5 μl),给药时间均为 2 min。观察注药前、后痛反应神经元电活动的变化,电信号经JSD-731-F前级放大器(信号的高频过滤器:3 kHz,低频率滤波器:0.01 s,放大倍数:100-fold)放大,显示于VC-9示波器(Nihon Konden,Japan)监视,并用ST-CH707X型双道磁带录音机记录痛反应神经元的电变化。每个痛反应神经元的放电记录3次,每2 min 1次,连续观察30 min。
1.3 神经元的定义 在NAc记录的神经元分为3种类型:(1)无关神经元:对伤害性刺激或非伤害性刺激均没有反应;(2)会聚神经元:对伤害性刺激和非伤害性刺激均有反应;(3)痛反应神经元:只对伤害性刺激有反应。痛反应神经元可分为痛兴奋神经元(PENs)和痛抑制神经元(PINs)。PENs的定义是指对伤害性刺激增加其放电频率反应的神经元;而PINs的定义是指对伤害性刺激降低其放电频率反应的神经元。该研究主要是观察和记录PENs和PINs的电活动。
1.4 观察指标 净增值(NIV,Hz),是指 PEN或PIN在伤害性刺激前2 s内放电平均频率和伤害性刺激后诱发放电平均频率之间差值。潜伏期(s)是指从伤害性刺激起到出现PEN放电的时间。抑制时程(ID,s)是指从伤害性刺激起到出现PIN放电之间的持续时间。
1.5 统计学方法 实验结果经Powerlab/8 s(ADInstruments)数据处理仪处理后输入计算机,用Chart v 5.3软件(Australian)进行数据分析。所有数据均以±s表示和用SPSS 16.0软件进行分析。统计差异用重复测量方差分析和F检验。两组间差异显著性用LSD法。
2 结果
2.1 生理盐水对吗啡依赖大鼠NAc痛反应神经元痛诱发电活动的影响 在生理盐水组,NAc内给予正常生理盐水,吗啡依赖大鼠的26 PENs或20 PINs的痛诱发电活动没有明显变化(Fig 1a和Fig 2a)。
2.2 NE对吗啡依赖大鼠NAc痛反应神经元痛诱发电活动的影响 在NE组,24 PENs的平均潜伏期是(0.15±0.03)s,而平均 NIV是(5.53±0.12)Hz。NAc内注射NE后立刻,PENs的潜伏期开始增加,NIV开始下降(Fig 1b)。在给NE后8 min,这些作用达到高峰,即平均潜伏期为(0.69±0.02)s(F=3.174,P<0.0001),NIV 为(1.28±0.09)Hz(F=2.458,P<0.0001)。在给 NE后0~16 min期间,PENs的平均潜伏期(F=60.167,P<0.0001)和NIV(F=3.681,P<0.0001)分别与生理盐水组同期相比差异有显著性(Fig 3)。在给NE 20 min后,PENs的潜伏期和NIV开始逐渐恢复。
18 PINs的平均ID是(1.70±0.04)s,而 NIV是(-2.68±0.12)Hz。NAc内注射NE后,PINs的ID开始缩短,并NIV开始增加(Fig 2b)。在给NE后8 min,这些作用达到高峰,即平均 ID下降到(0.44±0.02)s(F=2.904,P<0.0001),而 NIV 增加到(-0.21±0.03)Hz(F=66.150,P<0.0001)。在注射后的4~16 min,平均 ID(F=9.126,P<0.0001)和NIV(F=1.455,P<0.0001)出现了明显变化与生理盐水组同期相比(Fig 4)。
2.3 酚妥拉明对吗啡依赖大鼠NAc痛反应神经元痛诱发电活动的影响 在酚妥拉明组,22PENs的平均潜伏期为(0.16±0.02)s,而NIV为(5.13±0.14)Hz。NAc内给予酚妥拉明后,PENs的潜伏期开始缩短,而NIV开始增加(Fig 1c)。这些效应在给药后8 min达到高峰,平均潜伏期下降到(0.01±0.03)s(F=138.889,P<0.0001),而 NIV 增加到(9.77±0.18)Hz(F=1.432,P<0.0001)。在给药后4~12 min期间,PENs的平均潜伏期(F=5.596,P=0.031)和 NIV(F=3.138,P<0.0001)分别与生理盐水组同期相比差异有显著性(Fig 3)。
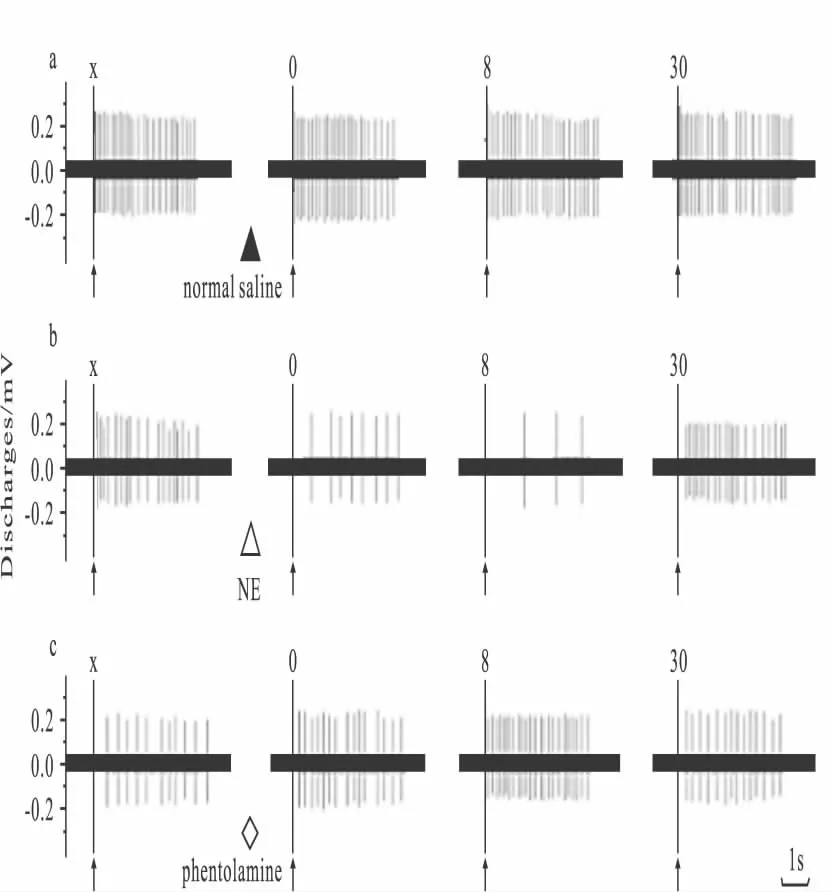
Fig 1 Effects of intra-NAc microinjection of normal saline(a)or NE(b),phentolamine(c)on the evoked discharges of PEN in the NAc of morphine-dependent rats
17 PINs的平均 ID为(1.68±0.05)s,而 NIV为(-2.78±0.09)Hz。在注射酚妥拉明后,ID开始延长,而NIV开始减少(Fig 2c)。在给予酚妥拉明后8 min,PINs的平均ID增加到(4.07±0.02)s(F=2.485,P<0.0001),而NIV下降到(-4.80±0.13)Hz(F=3.456,P<0.0001)。在给药后0~16 min期间,PINs的平均 ID(F=5.675,P<0.0001)和NIV(F=1.955,P<0.0001)分别与生理盐水组同期相比有明显差异(Fig 4)。在给予酚妥拉明后20 min,PINs的平均ID和NIV开始恢复。
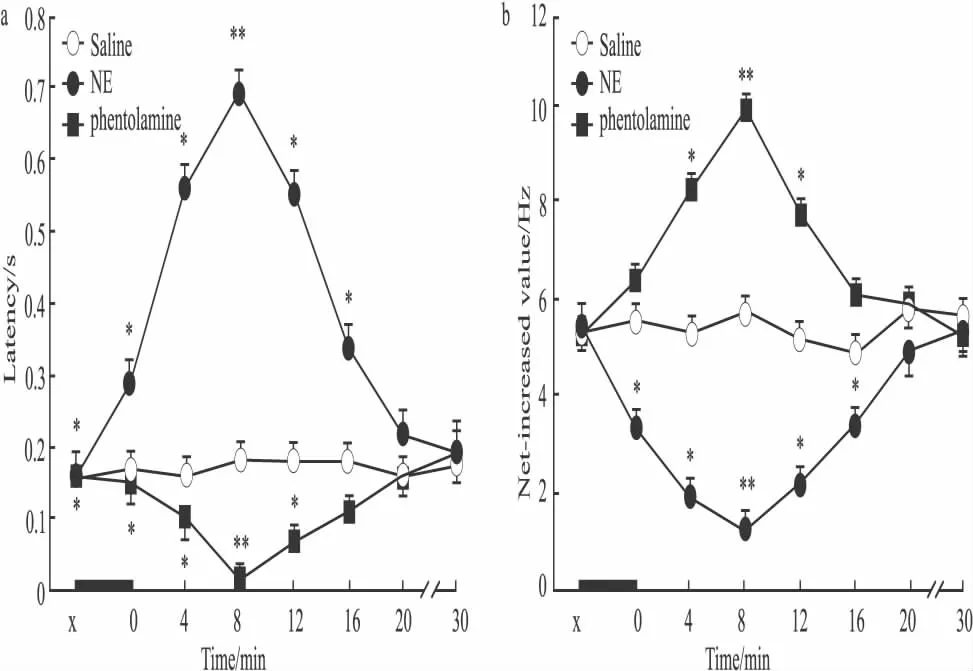
Fig 3 Influences of intra-NAc microinjection of different substances on the latency(a)and NIV(b)of PENs in the NAc of morphine-dependent rats
3 讨论
本研究观察了NE和酚妥拉明对吗啡依赖大鼠NAc内PENs和PINs生物电活动的影响。该结果揭示,NAc内给予NE可抑制PENs的电活动,而增强PINs的电活动;而酚妥拉明能增强PENs的电活动和抑制PINs的电活动。可见,酚妥拉明和NE两者之间在吗啡依赖大鼠NAc内的作用是对立的。结果表明,NE参与吗啡依赖大鼠NAc内伤害性信息传送的调制。此外,PENs和PINs可以被认为是疼痛研究的指标[9]。PENs和PINs对相同的物质具有相反的反应,这也许可以解释NE和酚妥拉明对疼痛的调制作用。

Fig 4 Influences of intra-NAc microinjection of different substances on the ID(a)and NIV(b)of PINs in the NAc of morphine-dependent rats
NE是一种单胺神经递质,其对中枢痛觉调节作用相当复杂。我们研究室曾证明,尾核内注射NE可增加吗啡依赖大鼠尾核内PEN的电活动,降低PIN的电活动,即出现了NE易化疼痛效应[10]。但侧脑室注射NE能抑制吗啡依赖大鼠核束旁的PEN电活动,加强PIN电活动,即表现出NE的镇痛作用。在本研究中,我们发现NAc内注射NE也能产生镇痛效果。由于NE广泛地分布在大脑中。许多脑结构会聚于脑干组成了下行抑制系统,可调节脊髓痛觉的传递。NE、5-羟色胺(5-HT)等在下行抑制系统中起着重要的作用。NE能抑制外周C纤维传送伤害性刺激信息到脊髓侧角[3]。NE再摄取抑制剂,从而减轻初期由伤害性刺激引起的疼痛感觉[11]。单胺类,包括 NE、多巴胺(DA),5 - HT 等,通过不同的神经递质受体亚型调节背角神经元的兴奋性和伤害性疼痛[12]。NE在基础条件下对痛觉影响不大,但长期疼痛可通过负反馈促进NE介导抑制疼痛[13]。NE和5-HT通过在大脑和脊髓中的下行抑制途径参与痛觉调制[14]。揭示,NE能系统和痛觉调制系统之间有着密切的关系。
NAc位于尾状核吻侧下方,视神经管顶部。NAc接收来自谷氨酸能、5-HT能和NE能神经元的投射。NAc中含有大量的内源性阿片肽,在控制疼痛的传送和调制起着重要的作用。NAc可通过阿片肽和胆囊收缩素之间的相互作用来调制疼痛。大量证据表明[15],DA与NE由额叶前皮质NE能的末稍共同释放的。NAc的主要神经递质是DA和NE,研究已证实在NAc内,NE和DA神经递质的水平是相等的。可见,NAc是中枢痛觉调制系统中重要核团之一。
该系列结果揭示,NAc内给予NE不仅可抑制吗啡依赖大鼠NAc内PEN的电活动,还能加强PIN的电活动,呈现出NE的镇痛效应。当NAc内给予α-受体拮抗剂酚妥拉明时,NAc内PEN的电活动加强,而PIN的电活动减弱,表现出酚妥拉明易化疼痛效应。提示,NE或酚妥拉明是通过α-受体介导改变了NAc内PEN和PIN的电活动来调控中枢痛觉的。
[1]刘文涛,王维胜,何 玲,刘景根.成瘾行为消退性学习的研究进展[J].中国药理学通报,2011,27(6):741-5.
[1]Liu W T,Wang W S,He L,Liu J G.Progresses in extinct research of addictive behaviors[J].Chin Pharmacol Bull,2011,27(6):741-5.
[2]Sofuoglu M,Powell R A.Norepinephrine and stimulant addiction[J].Addict Biol,2009,14(2):119 -29.
[3]Lu Y,Perl E R.Selective action of noradrenaline and serotonin on neurones of the spinal superficial dorsal horn in the rat[J].JPhysiol,2007,582(1):127-36.
[4]Shi T F,Yang C X,Yang D X,et al.MK-801 changes the role of glutamic acid on modulation of algesia in nucleus accumbens[J].Biochem Biophys Res Commun,2010,395(3):407-11.
[5]Tong J,Hornykiewicz O,Kish S J.Identification of a noradrenaline-rich subdivision of the human nucleus accumbens[J].J Neurochem,2006,96(2):349-54.
[6]张 颖,苏 洁,徐满英.氟哌利多影响DA对吗啡成瘾大鼠痛觉的调制[J].中国药理学通报,2007,23(5):594-7.
[6]Zhang Y,Su J,Xu M Y.Role of droperidol in modulation of dopamine on central painful sense in morphinistic rats[J].Chin Pharmacol Bull,2007,23(5):594-7.
[7]杨春晓,杨宝峰,张 辉,等.CCK-8对吗啡成瘾大鼠戒断症状及尾核内c-jun蛋白表达的影响[J].中国药理学通报,2008,24(9):1166-70.
[7]Yang C X,Yang B F,Zhang H,et al.Effects of CCK-8 on the withdrawal symptoms and expression of c-jun protein in Cd of morphinomania rats[J].Chin Pharmacol Bull,2008,24(9):1166-70.
[8]Pellegrino L J,Pellegrino A S,Cushman A J.A stereotaxic atlas of the rat brain[M].New York:Plenum Press,1979:44-50.
[9]Yang X F,Xiao Y,Xu M Y.Both endogenous and exogenous ACh plays antinociceptive role in the hippocampus CA1 of rats[J].J Neural Transm,2008,115(1):1-6.
[10] Zhang G W,Yang C X,Zhang D,et al.Noradrenergic mechanism involved in the nociceptive modulation of nociceptive-related neurons in the caudate putamen [J].Neurosci Let,2010,480(1):59-63.
[11] Gilron I,Watson C P,Cahill C M,et al.Neuropathic pain:a practical guide for the clinician[J].CMAJ,2006,175(3):265-75.
[12] Benarroch E E.Descending monoaminergic pain modulation:bidirectional control and clinical relevance[J].Neurology,2008,71(3):217-21.
[13] Pertovaara A.Noradrenergic pain modulation[J].Prog Neurobiol,2006,80(2):53-83.
[14] Wernicke J F,Pritchett Y L,D'Souza D N,et al.A randomized controlled trial of duloxetine in diabetic peripheral neuropathic pain[J].Neurology,2006,67(8):1411 -20.
[15] Devoto P,Flore G,Pira L,et al.Co-release of noradrenaline and dopamine in the prefrontal cortex after acute morphine and during morphine withdrawal[J].Psychopharmacology,2002,160(2):220-4.

