全雄黄颡鱼摄食前后消化酶活性变化规律的研究
■杨家威 孙龙生 蔡春光 赵 跃 杨泽禹 丛 宁
(1.扬州大学动物科学与技术学院,江苏扬州225009;2.扬州市水产生产技术指导站,江苏扬州225101)
黄颡鱼(Pelteobagrus fulvidraco)肉质细嫩、味道鲜美、营养及药用价值高,深受消费者喜爱,是目前主推淡水养殖品种。在相同养殖条件下,雄性黄颡鱼比雌鱼生长速度快30%左右,导致雌雄生长速度和个体大小差异悬殊。刘汉勤等[1]采用性逆转与雌核发育的方法生产出全雄黄颡鱼(all-mallPelteobagrus fulvidraco),解决了商品鱼规格不齐问题,显著提高了黄颡鱼的产量和效益。近年来,人们围绕黄颡鱼消化生理,从发育阶段、饵料来源、投喂频率、酶动力学等方面对黄颡鱼消化酶活性开展了相关研究。李芹等[2]研究了瓦氏黄颡鱼发育过程中酶活性的变化,发现不同酶比活力变化模式不同,但主要消化酶活性均随着生长而变化显著;李芹等[3]报道,投喂活饵料组瓦氏黄颡鱼蛋白酶活性高于人工饲料组,而脂肪酶和淀粉酶活性却相反;王武等[4]研究表明,投喂频率刺激对黄颡鱼肠蛋白酶活性有显著影响,其活性随投喂频率的增加而显著降低;余涛等[5]对黄颡鱼消化器官蛋白酶和淀粉酶活性进行了测定分析,结果显示肠是黄颡鱼主要的消化器官之一,其蛋白酶最适pH值为7.0,且中肠的蛋白酶和淀粉酶活性最强。有关黄颡鱼摄食前后消化酶活性动态变化规律方面的研究尚未见报道。本研究旨在比较摄食前后全雄黄颡鱼不同消化器官(肝胰腺、胃、肠道)消化酶活性的高低,探讨全雄黄颡鱼摄食前后不同时间消化酶活性的动态变化规律,为了解全雄黄颡鱼消化生理提供参考。
1 材料与方法
1.1 试验动物与饲养管理
全雄黄颡鱼幼鱼由高邮董氏特种水产养殖公司提供。试验前选择体质健壮、规格整齐、平均体重(10.11±0.12)g的幼鱼150尾,随机分配到3个水族箱中(100 cm×40 cm×50 cm),每个水族箱50尾。试验采用微循环水流,间隙式增氧;温度控制在26~28℃。
1.2 试验设计与试验饲料
试验饲料配方及营养水平见表1。饲料原料按配比定量后混合,加水揉匀,用F-26型颗粒饲料挤条机加工成粒径为2 mm硬颗粒饲料,自然风干后,密封保存于-20℃冰箱中备用。
试验鱼每天投喂2次(7:00和17:00),驯养3周。正式试验前,试验鱼先饥饿28 h,取样后立即投喂,并以此时间作为0 h开始计时,分别于0、1、2、4、6、8 h等6个时间点进行采样,每组6个重复,样品置于冰盘解剖,分别采集肝胰腺、肠和胃,迅速置于液氮冻存,-70℃保存以备消化酶活性测定。

表1 试验饲料组成及营养水平(风干基础,%)
1.3 消化酶活性的测定
待测组织样品分析前于冰上解冻,除去内容物,用双蒸水冲洗,滤纸吸干,称重后与预冷的去离子水按1∶9质量体积比稀释,冰浴中用高速组织匀浆机匀浆,匀浆液4 000 r/min、4℃离心15 min,取上清液作为粗酶液。
淀粉酶、脂肪酶、胃蛋白酶和胰蛋白酶活性均采用南京建成生物工程研究所生产的试剂盒测定,具体方法参见试剂盒所附说明书。
组织淀粉酶活性单位定义:组织中每毫克蛋白在37℃与底物作用30 min,水解10 mg淀粉定义为1个淀粉酶活性单位。
组织脂肪酶活性单位定义:在37℃条件下,每克组织蛋白在本反应体系中与底物反应1 min,每消耗1 μmol底物为1个酶活性单位。
组织胃蛋白酶活性单位定义:每毫克组织蛋白37℃每分钟分解蛋白生成1 μg氨基酸相当于1个酶活性单位。
组织胰蛋白酶活性单位定义:在pH值8.0、37℃条件下,每毫克蛋白中含有的胰蛋白酶每分钟使吸光度变化0.003即为1个酶活性单位。
1.4 数据统计与分析
用EXCEL记录数据,试验数据采用 SPSS 19.0 for Windows软件分析,以不同时间点为影响因素,对所得数据进行单因素方差分析(One-Way Analysis,ANOVA),多重比较采用Duncan's法,显著水平设定为P<0.05。分析结果以平均值±标准差表示(Means±SD)。
2 结果
2.1 摄食前后全雄黄颡鱼淀粉酶活性变化规律
摄食前后不同时间点全雄黄颡鱼消化道组织淀粉酶活性的变化规律见图1和表2。
淀粉酶活性以肠道最强,在摄食后0~8 h内,其活性分别是肝胰腺的10~30倍、胃的10~200倍,其高低顺序为肠>肝胰腺>胃。肝胰腺淀粉酶活性在摄食后1 h[(37.18±2.35)U/mg protein]高于摄食前[(7.39±0.50)U/mg protein](P<0.01),摄食后4~8 h降到最低;肠淀粉酶活性摄食后1~2 h较摄食前高[(196.40±19.87)U/mg protein](P<0.01),其最高值出现在摄食后 2 h[(374.17±0.05)U/mg protein],除与摄食后 1 h之间差异不显著(P>0.05),均极显著高于其它各时间点(P<0.01);胃淀粉酶活性则是摄食后极显著低于摄食前[(11.03±1.73)U/mg protein](P<0.01),且摄食后1~8 h其活力一直维持在较低水平(P>0.05)。
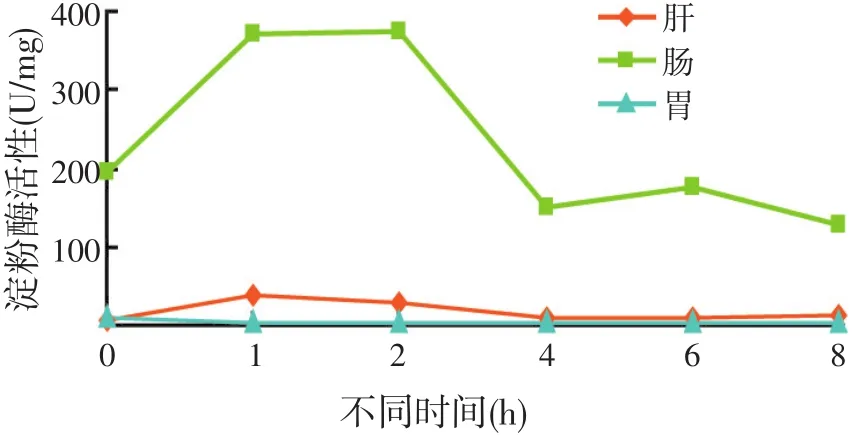
图1 摄食对全雄黄颡鱼淀粉酶活性的影响
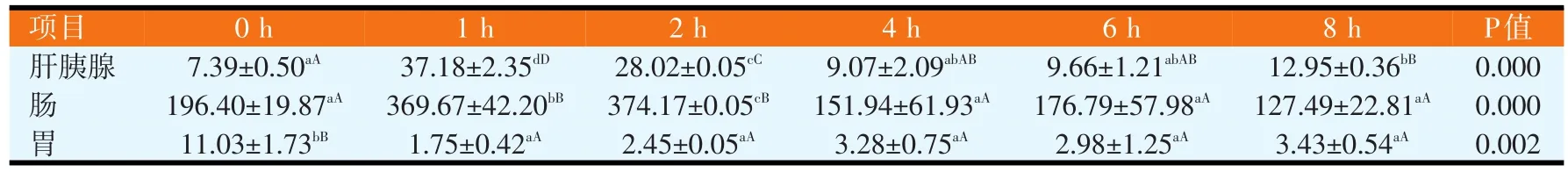
表2 摄食对全雄黄颡鱼淀粉酶活性的影响(U/mg)
2.2 摄食前后全雄黄颡鱼脂肪酶活性变化规律
摄食前后不同时间点全雄黄颡鱼消化道组织脂肪酶活性的变化规律见图2和表3。
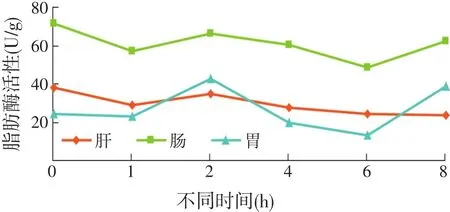
图2 摄食对全雄黄颡鱼脂肪酶活性的影响
脂肪酶活性高低顺序为肠>肝胰腺>胃,但肝胰腺及肠脂肪酶活性摄食后各时间段与摄食前比较差异不显著(P>0.05)。相反,胃脂肪酶活性在摄食2 h明显高于摄食0~1 h(P<0.05),摄食后4~6h 降至较低水平(P>0.05),摄食后8 h有升高的趋势,但与摄食后2 h之间没有显著差异(P>0.05)。
2.3 摄食前后全雄黄颡鱼胃蛋白酶活性变化规律
摄食前后不同时间点全雄黄颡鱼消化道组织胃蛋白活性的变化规律见图3和表4。
胃蛋白酶主要存在于黄颡鱼的胃组织、肝胰腺和肠道组织中,胃蛋白酶活性在摄食后始终维持在低水平,且胃组织中胃蛋白酶活性在各时间点均高于肝胰腺和肠。胃组织中胃蛋白酶活性在摄食后1 h[(3.71±0.31)U/mg protein]与摄食前[(4.22±0.52)U/mg]有显著性差异(P<0.05),摄食后2~4 h略有升高,且摄食后6~8 h维持在较低水平。

表3 摄食对全雄黄颡鱼脂肪酶活性的影响(U/g)
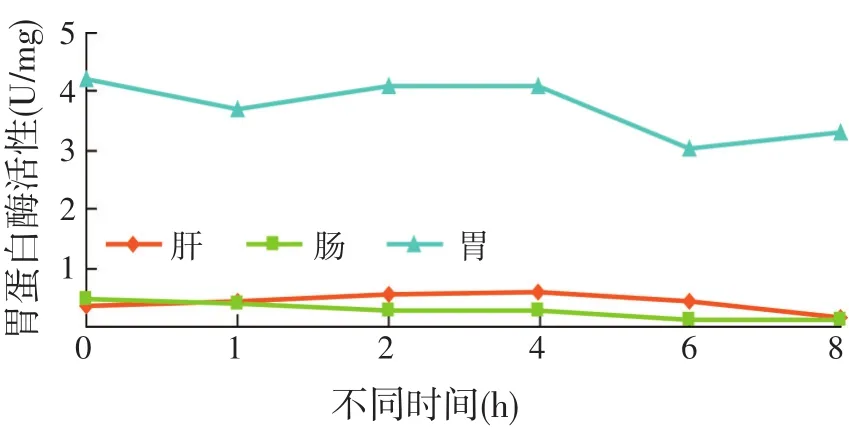
图3 摄食对全雄黄颡鱼胃蛋白酶活性的影响
2.4 摄食前后全雄黄颡鱼胰蛋白酶活性变化规律
摄食前后不同时间点全雄黄颡鱼消化道组织胰蛋白酶活性的变化规律见图4和表5。
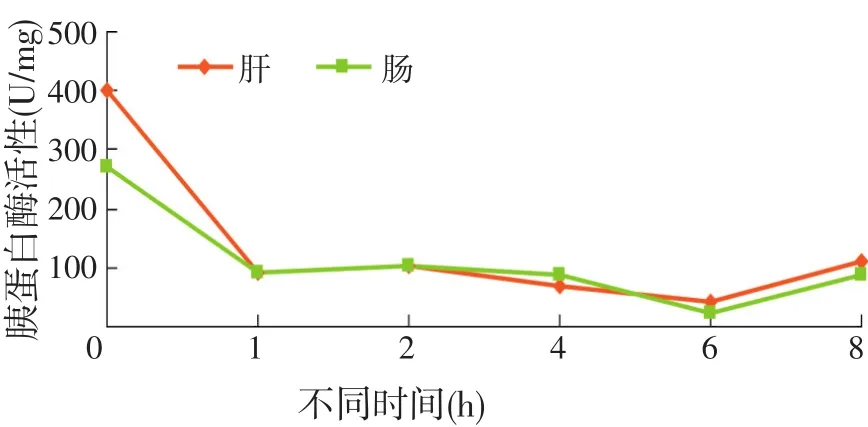
图4 摄食对全雄黄颡鱼胰蛋白酶活性的影响
胰蛋白酶主要存在于肝胰腺和肠道组织,试验中未检测出胃组织中存在胰蛋白酶活性,且胰蛋白酶活性均是在摄食前最高,摄食后快速下降。肝胰腺胰蛋白酶活性在摄食后1 h[(91.62±10.33)U/mg]与摄食前[(402.03±64.41)U/mg]有极显著性差异(P<0.01),随着摄食后时间的延长,胰蛋白酶活性逐渐降低,在摄食后6 h降至最低[(43.76±10.23)U/mg],但在摄食8 h[(110.76±15.56)U/mg]有逐渐升高的趋势;肠胰蛋白酶活性摄食前后变化规律与肝胰腺相似。

表4 摄食对全雄黄颡鱼胃蛋白酶活性的影响(U/mg)

表5 摄食对全雄黄颡鱼胰蛋白酶活性的影响(U/mg)
3 讨论
鱼类消化酶的分泌与摄食活动密切相关,摄食后消化酶的分泌既受到食物的影响,同时也受到鱼体自身生理特点的约束与影响[6];消化酶的分泌过程存在多种调节机制,但摄食食物是主要的诱导因素。王立波等[7]研究摄食对怀头鲇(Silurus soldatovi)胃肠道消化酶活性影响发现,怀头鲇胃蛋白酶活性在摄食后先降低后快速上升,而肠蛋白酶活性一直保持上升的趋势,他认为蛋白酶活性在摄食后先下降后升高是肉食性鱼类长期以来形成的,即在摄食前就在消化器官中储备一定的酶,以便更有效地利用饲料中的营养物质。本试验测定了全雄黄颡鱼肝胰腺、胃及肠道组织的淀粉酶活性、脂肪酶活性、胃蛋白酶活性和胰蛋白酶活性,发现除肠道淀粉酶活性在摄食后升高,其它消化酶的活力在摄食后均有不同程度的降低。酶活性先下降后升高的现象表明,摄食前组织中存在酶的基础分泌现象,随后酶活性持续缓慢下降说明组织分泌酶的量在减少,而此时食糜中酶的活性应较高。可以看出,摄食刺激对全雄黄颡鱼消化组织相关酶的分泌并不完全是增强,具有一定的组织差异性,其深层原因有待进一步研究。
研究显示,鱼类在进化过程中唾液腺逐渐退化,淀粉酶主要由肝脏产生。周景祥等[8]试验证明,鱼类淀粉酶主要由肝胰腺分泌产生,但倪寿文等[9]证明肠道也可以产生淀粉酶,且具有较高的活性。本试验中在3种消化组织中均能检测到淀粉酶存在,这与孙翰昌等[10]、王武等[11]研究结果相一致;鱼类胃淀粉酶活性较低,且不随饲料成分的改变而变化[12-13],再者胃内酸性较强,因此可以认为淀粉酶在胃内的消化作用微乎其微。黄颡鱼摄食前后,肠淀粉酶活性均高于肝胰腺和胃,在摄食后不同时间段分别是肝胰腺的10~30倍、胃的10~200倍,肠淀粉酶活性最高值出现在摄食后1~2 h,由此可以推测黄颡鱼肠道能够产生并分泌淀粉酶,且对淀粉具有较高的利用能力,此外肠道对淀粉的消化主要是在摄食后的1~2 h。
胃消化作用主要是对饲料中的蛋白质进行初步分解,胃蛋白酶只有在强酸环境下才能分解蛋白质,因此在3种组织中胃组织中胃蛋白酶活性远高于肝和肠;肠中能够检测到胃蛋白酶活性,但其变化规律与胃组织一致,分析原因可能是胃蛋白酶随食糜进入肠道所致。
摄食活动影响鱼类消化酶的分泌,而食物的组成也是影响鱼类消化酶分泌的主要因素[14]。目前鱼类饲料蛋白源中植物类蛋白较多,当豆粕和菜粕类原料作为饲料蛋白源使用时,胰蛋白酶的分泌会受到抗营养因子的影响。田丽霞等[15]比较了鱼粉和黄豆饼为蛋白源时草鱼肠蛋白酶活性的变化,发现鱼粉组在摄食后胰蛋白酶活性持续上升,而黄豆饼组在摄食0~5 h内急剧下降,10 h上升。她认为,黄豆饼组肠组织蛋白酶活性在摄食后先有一个下降过程,这很可能是由于黄豆饼中含有抗胰蛋白酶抑制了肠内胰蛋白酶的活性。在本试验中,黄颡鱼肝胰腺和肠道组织中的胰蛋白酶活性在摄食后急剧降低,在6 h时降至最低,随后逐渐回升,这与田丽霞等人的研究结果一致。分析发现,试验饲料原料中膨化大豆、豆粕及菜粕等占到30%,摄食后的胰蛋白酶活性急剧下降可能与饲料中抗胰蛋白酶因子有关。此外,胰蛋白酶活性在摄食后急剧下降也可能与食物刺激带来的消化器官内储酶大量分泌有关。Kawis.,Ikeda[16]给鲤鱼投喂市售的颗粒饲料,结果发现,肝胰腺蛋白酶活性在2 h后达到最低,他推测肝胰腺和肠道分泌细胞不断形成的消化酶积累在分泌细胞或腺泡腔内,鱼类的摄食以及食团对肠道的刺激引起消化组织内积累的消化酶排入消化道,这导致消化组织的酶活性在摄食后降低,而此时肠内容物酶活性可能升高。试验中未对肠道内容物胰蛋白酶活性进行检测,有关因食物刺激而导致的组织胰蛋白酶活性降低这一情况有待进一步研究。
本试验各消化酶活性是在一次性摄食后测定的,而影响消化酶活性的因素很多,摄食量、饲料蛋白质水平以及日常投喂频率等均会影响摄食前后酶活性的高低,有关全雄黄颡鱼消化器官分泌消化酶的生理机制,还有待进一步深入研究。
4 结论
全雄黄颡鱼摄食前后消化道不同消化酶活性存在时序变化和组织差异性。

