姜黄素对人宫颈癌Hela细胞增殖的抑制作用
陈昌明,刘慧芳,曹雪姣,李新莉,辛毅,张翠丽(大连医科大学生物技术系,辽宁 大连 116044)
姜黄素(Curcumin)是从姜科姜黄属植物姜黄(Curcuma longa)根茎中提取的一种酚性色素,具有抗炎、抗氧化、降脂、抗病毒、清除自由基的作用[1-2],同时还可抑制小鼠肉瘤S180、人大肠癌细胞HT29、肾癌细胞293、肝癌细胞HepG2细胞生长[3-5]。有文献报道,姜黄素可抑制酪氨酸蛋白激酶(PTK)活性,从而抑制肿瘤细胞增殖,并通过阻断细胞信号传导途径促发细胞凋亡[6]。本研究通过姜黄素对人宫颈癌Hela细胞的增殖抑制、促凋亡和细胞周期各时相的变化以及抑癌基因p53蛋白的表达影响的研究,为姜黄素的抗癌研究和应用提供实验依据。
1 材料
1.1 仪器
E100型倒置相差显微镜[尼康仪器(上海)有限公司];CO2孵箱、MK3型酶标仪(美国Thermo公司);FC500型流式细胞仪(美国Beckman公司)。
1.2 药材
姜黄于2012年4月购于大连中药店,经大连医科大学生物技术系李新莉讲师鉴定为真品。
1.3 药品与试剂
姜黄素对照品(天津一方科技有限公司,批号:20121259,纯度:≥98%);MTT(美国Amresco公司);抗体β-actin、p53、HRP辣根过氧化物酶(武汉博士德生物工程有限公司)。
1.4 细胞
人宫颈癌Hela细胞株由大连医科大学生物技术系实验室提供。
2 方法
2.1 姜黄素的提取
姜黄置50Ⅸ恒温干燥箱过夜,粉碎过200目筛网。姜黄粉末按1∶10(m/V)加入70%乙醇浸提48h,抽滤浸提液,旋蒸,等分提取物分别以酸碱法和萃取法提纯,计算得率[7]。姜黄提取液置-20Ⅸ贮藏,备用。
2.2 姜黄提取液质量浓度的测定
准确称取20mg姜黄素对照品,加入200μl甲醇溶解得姜黄素对照品溶液(100mg/ml)。定量移取姜黄素对照品溶液(100mg/ml)适量,甲醇逐级10倍稀释至0.1mg/ml;分别取0.1mg/ml的姜黄素对照品溶液10、20、30、40、50、60μl与姜黄提取液30μl(甲醇溶解,质量浓度为0.1mg/ml),均设3复孔,以甲醇定容至200μl量瓶中,检测420nm波长处的光密度(OD)[8]。分别以姜黄素浓度(c)为横坐标,OD为纵坐标,进行线性回归,计算姜黄提取液的质量浓度。
2.3 细胞增殖抑制实验[6]
取1.0×105ml-1的对数生长期Hela细胞,接种于96孔板(200μl/孔)。至细胞贴壁,每孔加入200μl姜黄提取液(以0.05mg/ml为单位添加,自0.05mg/ml至0.50mg/ml计10个质量浓度,各质量浓度设3个平行孔);以同体积1640培养液为空白对照;以只加姜黄提取液的甲醇溶液为阴性对照(200μl/孔,3复孔)。酶标仪检测589nm波长处的OD,计算细胞增殖抑制率。抑制率=(空白对照组OD-用药组OD)/空白对照组OD×100%。
2.4 形态学观察
取对数生长期的Hela细胞,加入终质量浓度为0.02、0.06、0.10mg/ml的姜素提取液3ml,培养24h,以倒置显微镜观察Hela细胞形态学变化。
2.5 Hela细胞总蛋白含量的测定[7-8]
取分别加入0.05、0.25mg/ml的姜黄提取液(药物组)以及常规1640培养液(空白对照)培养24h的Hela细胞,以0.25%胰蛋白酶消化,4Ⅸ下,以离心半径为8 cm、4000 r/min离心6min,加1ml PBS(pH7.2)沉淀,移入1.5ml离心管中,再次离心弃上清。向离心管中加入200μl细胞裂解液[苯甲基磺酰氟(PMSF)10μl/ml],冰上反复吹吸10min,4Ⅸ下,以离心半径为8 cm、12000 r/min离心10min,取上清,以小牛血清白蛋白(BSA)为标准品检测蛋白质含量,-20Ⅸ贮藏,备用。
2.6 Western blot检测p53蛋白
常规SDS-PAGE凝胶电泳(5%的浓缩胶,10%的分离胶,蛋白质上样量60μg,30 mA恒流,待溴酚蓝至胶底端1 cm时停止电泳);依据蛋白Marker切取凝胶(含目的蛋白)及等尺寸的滤纸、硝酸纤维素薄膜(NC膜),半干式电转仪转膜45~55min;取NC膜,以TBST清洗2~3次,5min/次,5%脱脂奶粉封闭2 h,TBST清洗NC膜10min/次(2~3次)后,转入1∶500稀释的一抗(β-actin、p53)中,4Ⅸ过夜;TBST清洗NC膜3次(10min/次),HRP辣根过氧化物酶(二抗,稀释倍数1∶5000,V/V)室温孵育1 h,TBST洗涤(10min/次,2~3次),加入 ECL发光试剂,全自动凝胶成像仪成像(每5s成像1次,成像300s),Quantity One分析软件分析[9]。
2.7 流式细胞仪测定Hela细胞的凋亡
0.02、0.06、0.10mg/ml的姜黄提取液作用于Hela细胞24h,消化、收集细胞,PBS清洗,用于凋亡和周期(70%冷乙醇固定,过200目网,调整细胞数为1×106ml-1)各时相变化的检测[10]。
3 结果
3.1 姜黄素提取率计算结果
40 g姜黄粗提物,经酸碱法纯化得姜黄素0.3696 g,萃取法得0.6664 g。提取率依次为0.924%和1.666%,萃取法提纯是酸碱法的1.8倍,因此选择萃取法提取。
3.2 姜黄素含量计算结果
回归方程为A=423.71 c-0.0566(r2=0.9907),姜黄提取液中姜黄素含量为58.34%。
3.3 姜黄素对Hela细胞增殖的抑制作用
姜黄提取液质量浓度为0.2mg/ml(含姜黄素116.68μg/ml)时其抑制率达到峰值63.20%,半数抑制质量浓度(IC50)为0.33mg/ml(含姜黄素 192.52μg/ml),且抑制率在 0.05~0.2mg/ml质量浓度范围内随质量浓度增高而增大(P<0.01)。姜黄素对Hela细胞增殖的抑制作用见表1。
表1 姜黄素对Hela细胞增殖的抑制作用(,n=3)Tab 1 Inhibitory effects of different concentrations of curcumin on the growth of Hela cells in 24h(,n=3)

表1 姜黄素对Hela细胞增殖的抑制作用(,n=3)Tab 1 Inhibitory effects of different concentrations of curcumin on the growth of Hela cells in 24h(,n=3)
姜黄素提取液质量浓度,mg/ml 0.050.100.150.200.250.300.350.400.450.50姜黄素质量浓度,μg/ml 29.1758.3487.51116.68145.85175.02204.19233.36262.53291.7 O D 0.437±0.0310.314±0.0310.205±0.0130.170±0.0080.210±0.0080.256±0.0210.257±0.0180.268±0.0130.277±0.0140.286±0.086抑制率,%15.3437.3156.9063.2056.0047.7947.7345.6444.0242.46
3.4 姜黄素对Hela细胞形态学的影响
加入0.02mg/ml(含姜黄素11.67μg/ml)、0.06mg/ml(含姜黄素35.00μg/ml)、0.10mg/ml(含姜黄素58.34μg/ml)姜黄提取液培养24h的Hela细胞,其细胞数目明显少于空白对照,且细胞变圆、缩小、老化,核质发散,并随浓度的升高,凋亡明显。Hela细胞的形态学见图1。
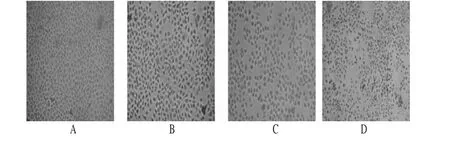
图1 Hela细胞的形态学A.空白对照组;B.0.02mg/ml姜黄提取液组;C.0.06mg/ml姜黄提取液组;D.0.10mg/ml姜黄提取液组Fig 1 Morphology of Hela cellsA.blank control group;B.0.02mg/ml C.longa extract;C.0.06mg/mlC.longa extract;D.0.10mg/mlC.longa extract
3.5 姜黄素对Hela细胞p53蛋白表达的影响
质量浓度为0.05mg/ml(含姜黄素29.17μg/ml)、0.25mg/ml(含姜黄素145.85μg/ml)时姜黄提取液作用Hela细胞24h,p53蛋白的表达与空白对照比较明显增强。Hela细胞p53蛋白的表达见图2(图中0mg/ml为空白对照)。

图2 Hela细胞p53蛋白的表达Fig 2 The expression of p53protein in Hela cells
3.6 姜黄素对Hela细胞凋亡的影响
姜黄提取液处理24h后,早期凋亡细胞所占的百分比由0.74%增加到1.43%,晚期凋亡细胞由2.45%增加到96.50%,即姜黄素诱导Hela细胞的死亡性质为凋亡,且其作用具有明显剂量依赖性。Hela细胞凋亡见图3。

图3 Hela细胞凋亡A.空白对照组;B.0.02mg/ml姜黄提取液组;C.0.06mg/ml姜黄提取液组;D.0.10mg/ml姜黄提取液组Fig 3 The apoptosis of Hela cellsA.blank control group;B.0.02mg/ml C.longa extract;C.0.06mg/mlC.longa extract;D.0.10mg/mlC.longa extract
3.7 姜黄素对Hela细胞周期的影响
不同质量浓度姜黄提取液(姜黄素质量浓度同“3.4”项下)处理24h后,G2/M期细胞比例由5.02%增至16.96%,同时G0/G1期与S期细胞比例减少,提示姜黄素使Hela细胞周期阻滞在G2/M期,从而抑制细胞增殖。Hela细胞周期分布见表2(表中0mg/ml为空白对照)。

表2 Hela细胞周期分布Tab 2 The cycle distribution of Hela cells
4 讨论
宫颈癌现已成为危害女性健康的第二杀手。我国每年新发病例14万,占妇女生殖道恶性肿瘤的第1位[11-12]。细胞凋亡始终是肿瘤的分子生物学研究热点[13]。p53蛋白表达与宫颈癌的发生有关[14-15],且在细胞周期调控、细胞凋亡诱导等过程中发挥重要作用。本文以Hela细胞为研究对象,探讨姜黄素对Hela细胞生长、凋亡及p53蛋白表达的影响。结果表明,姜黄素对Hela细胞有较明显的抑制作用,在116.68μg/ml附近出现抑制率峰值,在一定质量浓度范围内,姜黄素作用Hela细胞24h,p53蛋白表达随质量浓度增加而增强;细胞流式仪检测细胞凋亡数目相对增多;姜黄素对Hela细胞G2期有阻滞,从而使G1期和S期细胞相对减少,G2/M期细胞相对增多,即对Hela细胞G2/M期有明显的阻滞作用,使细胞凋亡率增高。
肿瘤的发生发展与细胞凋亡有关,诱导细胞凋亡已成为肿瘤治疗的热点,亦成为评估抗癌药物作用能力的重要指标。由于姜黄素对肿瘤细胞的作用并非针对单一靶点,具有广泛的生物学作用,因此对姜黄素诱导Hela细胞凋亡机制的进一步研究以及阻滞细胞传导通路、信使的相关研究,将对其临床应用具有良好的指导意义。
[1]任嫦娥,郭惠萍.姜黄素对肝癌HepG2和Bel-7404细胞增殖的抑制作用[J].中国生化药物杂志,2012,33(3):251.
[2]刘素标.姜黄素的作用研究进展[J].中医临床研究,2013,5(4):117.
[3]Iyer P,Zekri AR,Hung CW,et al.Concordance of DNA methylation pattern in plasma and tumor DNA of Egyptian hepatocellular carcinoma patients[J].Exp Mol Pathol,2010,88(1):107.
[4]覃勇,傅仲学,卢伟东,等.姜黄素逆转人结肠癌细胞株HCT-8/VCR多药耐药的研究[J].中国生化药物杂志,2011,32(3):173.
[5]李亚梅,廖端芳.姜黄素及其衍生物药理作用研究进展[J].实用中医内科杂志,2012,26(12):99.
[6]余俚瑶,张庆华.姜黄素抑制宫颈癌Hela细胞增殖的机制[J].肿瘤防治研究,2011,38(8):899.
[7]高苏亚,范涛等.姜黄中姜黄素的提取与分离工艺研究[J].应用化工,2011,40(2):203.
[8]韩光,张义春,于士勇.姜黄中姜黄素含量测定方法的比较[J].西北药学杂志,2005,20(1):15.
[9]黄谟婉,马英.姜黄素对Hela细胞增殖和凋亡的影响[J].中国生物制品学杂志,2008,21(12):1094.
[10]ZHAO Jing,ZHAO Yong,ZHANG Yan,et al.Anti-tumor effect of curcumin on human cervical carcinoma HeLa cells in vitro and in vivo[J].Chinese Journal of Cancer Resenrch,2007,19(1):32.
[11]赵春兰,王建,张会辰.宫颈癌及癌前病变筛查的现状和研究进展[J].河北医药,2012,34(2):259.
[12]陈黎萍,张燕.宫颈癌的危险因素分析及预防保健[J].肿瘤基础与临床,2011,24(2):183.
[13]刘培,周立军,苏艳芳,等.金龙胆草总皂苷诱导Hela细胞和SPC-A1细胞凋亡的研究[J].中国药房,2011,22(35):3288.
[14]白蒙,胡新荣.p53与宫颈癌的关系探讨[J].中国医药导报,2010,7(2):11.
[15]陈黎萍,张燕.宫颈癌的危险因素分析及预防保健[J].肿瘤基础与临床,2011,24(2):183.

