TTF-1启动子调控microRNA-7真核表达载体的构建
陈 超,赵娟娟,胡 艳,郭萌萌,陶弋婧,周 涯,秦娜琳,郑 静,徐 林
(1.遵义医学院 免疫学教研室暨贵州省免疫学研究生创新基地,贵州 遵义 563099;2.遵义医学院 医学物理学教研室,贵州 遵义 563099)
近年来研究显示,一类长度大约22nt的非编码小分子RNA-微小RNA(microRNA,miRNA)在肺癌发生中具有关键调控作用,且逐渐发展为肺癌临床诊断和基因治疗的重要靶标[1-4]。新近研究显示miRNAs家族成员miR-7在肺癌发生中具有重要作用,其低表达与肺癌的转移相关[5]。我们前期研究发现miR-7模拟物(mimics)可显著抑制人肺癌细胞的体外增殖[6]。此外,基于CMV启动子的miR-7的真核表达载体过表达miR-7可显著抑制人肺癌细胞体内外生长、侵袭和转移[7-9]。然而,miR-7为代表的miRNAs分子是否可作为临床肺癌基因治疗或诊断靶标仍待继续研究探讨。
甲状腺转录因子-1(thyroid transcription factor-1,TTF-1)基因是1989年civitarale等在甲状腺滤泡上皮细胞中发现的一种转录因子,其特征性表达于甲状腺滤泡上皮细胞和肺上皮细胞中[10]。研究发现TTF-1在肺癌组织中高表达,且其表达水平与肺癌预后密切相关,提示其可作为肺癌基因靶向表达的重要候选靶标[11-12]。因此本研究中,我们拟利用分子克隆技术,构建TTF-1启动子调控miR-7的真核表达载体,并初步探讨该真核载体过表达miR-7对人肺癌细胞体外生长的可能影响,以期为后续基于miR-7的临床肺癌诊断和基因治疗新靶标开发提供前期实验基础。
1 材料与方法
1.1 材料和仪器 PCR试剂,Premix Ex Taq Version2.0,限制性内切酶,快速连接酶均购自Takara公司;引物合成由上海英骏公司完成,PGL3-basic载体购自Promega公司。质粒抽提试剂盒购自天根生化科技有限公司;DNA凝胶回收试剂盒购自碧云天公司。人源性肺巨细胞癌95D细胞株,购于中国科学院上海生命科学研究院生物化学与细胞生物学研究所。DH5α大肠杆菌菌株由本实验室保存。SW-CJ-2FD型超净工作台(苏州净化设备厂);空气恒温摇床(上海新苗医疗器械制造公司);TD5A-WS台式低速离心机(湘仪仪器);IX-51倒置显微镜(OLYMPUS);低温台式高速离心机(Thermo公司);-80℃超低温冰箱(Thermo公司)。
1.2 PCR扩增miR-7基因 根据pri-miR-7序列设计引物。上游引物:5’-CGACGCGTAAGAGAGAAATGAGCCACTTGC-3’;下游引物:5’-CCCAAGCTTCCTGCCACAGTGGGGGATG-3’; 划痕为酶切位点。以人肺癌95D细胞基因组DNA为模板,PCR扩增miR-7序列,PCR条件:95 ℃ 5 min;95 ℃ 30 s;56 ℃ 30 s;72 ℃ 1 min;35个循环;72℃ 10 min。
1.3 PGL3-basic-miR-7载体的构建 将miR-7的PCR产物克隆入PGL3-basic载体中,连接产物经转化、挑克隆、摇菌后提取质粒,使用限制性内切酶Mul I酶和Hind Ⅲ酶做双酶切鉴定,酶切鉴定后测序,通过测序鉴定后得到正确的重组质粒PGL3-basic-miR-7。
1.4 PCR扩增TTF-1启动子基因 根据TTF-1启动子序列设计引物。上游引物:5’-CGGGGTACCTGTTTCGGCAACTAC-3’;下游引物:5’-CGACGCGTCCTTCTGGGTCCTT-3’;划痕为酶切位点。以人肺癌95D细胞基因组DNA为模板,PCR扩增TTF-1启动子序列,PCR条件:95 ℃ 5 min;95 ℃ 30 s;58 ℃ 30 s;72 ℃ 2 min20 s;35个循环;72 ℃ 10 min。
1.5 p-T-miR-7载体的构建 将TTF-1启动子的PCR产物克隆入PGL3-basic-miR-7载体中,连接产物经转化、挑克隆、摇菌后提取质粒,使用限制性内切酶Kpn I酶和Mul I酶做双酶切鉴定,酶切鉴定后测序,通过测序鉴定后得到正确的重组质粒p-T-miR-7。
1.6 Real-time PCR探针法分析各组细胞中miR-7表达情况。
1.6.1 引物设计 GAPDH 上游(5’-3’)GGTGAAGGTCGGAGTCAACG。下游(5’-3’) CAAAGTTGTCATGGATGGACC。miR-7逆转录GTCGTATCCAGTGCAGGGTCCGAGGTAT-TCGCACTGGATACGACACAACAA,下划线部分为茎环结构。
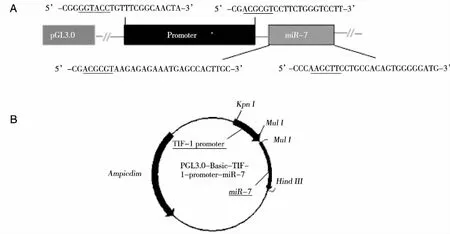
注:A:下划线部分为酶切位点。 图1 PGL3.0-Basic-TTF-1-promoter-miR-7真核表达载体
1.6.2 总RNA提取 以上各组细胞用0.2%胰酶消化,加入适量完全培养基终止消化,移至离心管中,1 200 rmp离心5 min,取出倒掉上清液,弹开管底的沉淀物。向离心管中加入适量的 RNAiso Plus(10 cm295D细胞加入1 mL RNAiso Plus),轻轻吹打,吸出至1.5 mL EP管,室温静置5 min,至完全融化。12 000g 4 ℃离心5 min,吸取上清液,移入新1.5 mL EP管中。向匀浆裂解液中加入氯仿(RNAiso Plus的1/5体积),剧烈振荡15s,待溶液充分乳化后,室温静置5 min,12 000g 4 ℃离心15 min。取出离心管,吸取上清液转移至另一新的离心管中,向上清中加入等体积的异丙醇,上下颠倒充分混匀后,室温下静置10 min。12 000 g 4 ℃离心10 min。小心弃去上清,缓慢地沿离心管壁加入75%的乙醇1 mL,轻微上下颠倒洗涤,12 000 g 4 ℃离心5 min后弃去乙醇。室温干燥沉淀2~5 min,加入适量的RNase-free水溶解沉淀。1.0%琼脂糖凝胶电泳分析RNA完整性。
1.6.3 Real-time PCR探针法检测miR-7表达 内参基因GAPDH逆转录反应体系及条件按试剂盒说明书操作,Real-time PCR反应体系及条件: 2×SYBR®Premix Ex TaqTM10 μL,ddH2O 8 μL,cDNA 1μL,PCR Forward Primer(10 μM) 0.5 μL,PCR Reverse Primer(10μM)0.5 μL;95℃预变性30 s,95 ℃ 15 s,60 ℃ 1 min,40个循环;84 ℃采集荧光信号,以排除引物二聚体的干扰。miR-7逆转录反应体系及条件按试剂盒说明书操作,Real-time PCR反应体系及条件:20×TaqMan®Small RNA Assay 1 μL,cDNA 1 μL,PCR Master Mix II 10 μL,ddH2O 8 μL;95 ℃预变性30 s,95 ℃ 15 s,60 ℃ 1 min,40个循环;60 ℃采集荧光信号[7]。
1.7 CCK-8实验检测细胞增殖情况 95D细胞以3×103个细胞/孔接种于96孔培养板,每孔培养基总量200 μL,分别将p-T-miR-7重组质粒和p-Cont质粒转染细胞,于37 ℃、5% CO2的条件下培养72 h;每孔加入10 μL CCK-8,继续培养3 h;使用酶标仪检测各孔吸光度(OD)值(波长450 nm)。
1.8 划痕实验检测95D细胞的体外迁移 收集95D细胞,按细胞密度1×105个细胞/孔接种于24孔板,培养12 h;分别转染p-T-miR-7质粒和p-Cont质粒,培养6 h;用1mL枪头沿板中线刮出2 mm刮痕,PBS洗涤3次,显微镜下观察刮痕内无细胞,加入培养基,继续培养48 h;光学显微镜下计算刮痕内细胞总数,并拍照。
1.9 克隆形成实验检测95D细胞的长期体外生长 分别转染p-T-miR-7质粒和p-Cont质粒,培养48 h;分别制成细胞悬液;将各转染组按200、800个细胞/孔接种于6孔板中;置37 ℃、5%CO2中培养10~15 d,中间根据培养基变化适时更换新鲜培养基,当出现肉眼可见克隆时,终止培养,倒掉孔里的培养基,PBS小心洗涤2次,空气干燥,4%多聚甲醛固定30 min,空气干燥,用1%结晶紫染液染色30 min,洗去染液,干燥后拍照。
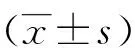
2 结果
2.1 PGL3-basic-miR-7真核表达载体的构建 以人肺癌95D细胞基因组DNA为模板,PCR扩增miR-7前体序列,琼脂糖凝胶电泳后在1302bp左右的位置出现目的条带(见图2A)。经Mul I酶和Hind Ⅲ酶双酶切纯化后,亚克隆入PGL3-basic载体中,连接产物经转化、挑克隆、摇菌后做菌液PCR鉴定(见图2B)。进一步提取质粒,利用Mul I酶和Hind Ⅲ酶做双酶切后进行琼脂糖凝胶电泳出现了1302bp和4818左右的两条带(见图2C)。并通过质粒测序结果(见图2D),证明PGL3-basic-miR-7载体构建成功。
注:A:PCR扩增miR-7片段;B:菌液PCR产物的琼脂糖凝胶电泳图;C:重组质粒的双酶切鉴定;D:重组质粒的测序鉴定。 图2 PGL3-basic-miR-7载体构建
2.2 p-T-miR-7真核表达载体的构建 以人肺癌95D细胞基因为模板,PCR扩增TTF-1启动子序列,琼脂糖凝胶电泳后在2300bp左右的位置出现目的条带(见图3A)。经Kpn I酶和Mul I酶双酶切纯化后,亚克隆入PGL3-basi-miR-7载体中,连接产物经转化、挑克隆、摇菌后做菌液PCR鉴定(见图3B)。进一步提取质粒,利用Kpn I酶和Mul I酶做双酶切后进行琼脂糖凝胶电泳出现了2300bp和6120bp左右的两条带(见图3C)。并通过质粒测序结果(见图3D),证明载体构建成功。
2.3 重组质粒p-T-miR-7瞬时转染人肺癌细胞后miR-7的表达水平 我们将p-T-miR-7重组质粒和p-Cont质粒分别体外瞬时转染人肺癌95D细胞。72 h后,观察细胞中miR-7成熟体的表达水平。结果显示,与对照组p-Cont转染组相比,p-T-miR-7转染组中miR-7成熟体的表达水平显著升高,差异具有统计学意义(P<0.05,见图4)。
2.4 瞬时转染p-T-miR-7抑制95D细胞体外增殖 我们进一步观察了人肺癌95D细胞体外生长的变化。光镜下观察发现,与p-Cont转染组相比,p-T-miR-7转染组95D细胞的生长明显受到抑制,细胞数量明显减少(见图5A、B、C、D,P<0.05);CCK-8检测结果表明,细胞的增殖能力明显下降,1.5μg和2.0μg重组质粒转染组的D值分别为0.85±0.02和0.83±0.02,与p-Cont组D值1.22±0.02相比,差异具有统计学意义(P<0.05,见图5E)。

注:A:PCR扩增TTF-1启动子片段;B:菌液PCR产物的琼脂糖凝胶电泳图;C:重组质粒的双酶切鉴定;D:重组质粒的测序鉴定。 图3 p-T-miR-7载体构建
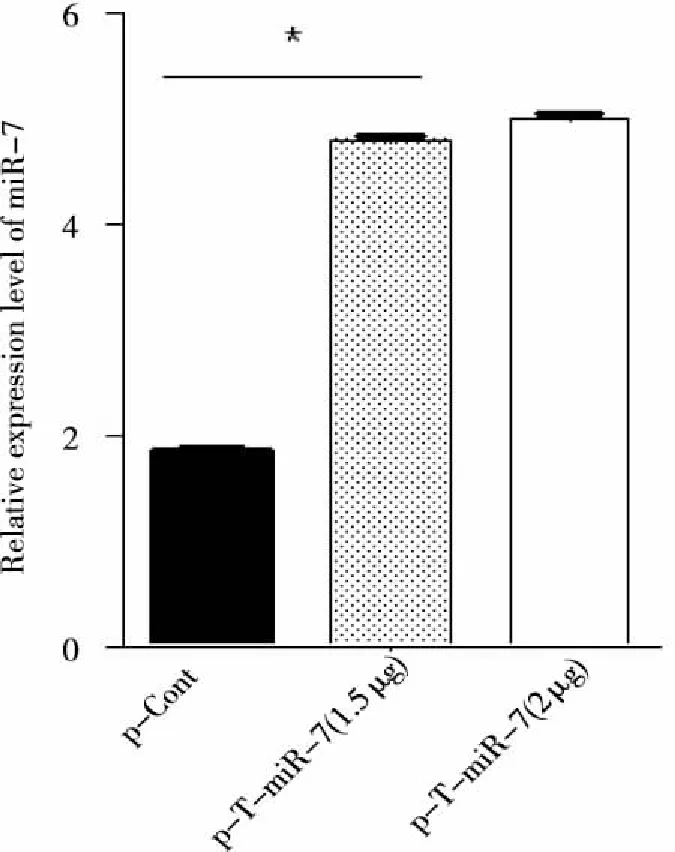
图4 Real-time PCR方法检测p-T-miR-7转染人肺癌95D细胞后miR-7的表达
2.5 瞬时转染p-miR-7抑制95D细胞的长期体外生长 我们进而利用克隆形成实验,观察了p-T-miR-7转染后对人肺癌细胞长期生长的作用。结果显示,在接种200 cells/well和800 cells/well条件下,p-T-miR-7转染组中95D细胞的克隆形成数较p-Cont转染组均明显降低(11±3 vs 30±3个,P<0.05;80±3 vs 160±4个,P<0.05)(见图6A~D)。这提示,p-T-miR-7转染组中95D细胞的长期生长能力也显著削弱。
2.6 瞬时转染p-T-miR-7抑制95D细胞的体外迁移 我们前期研究显示,miR-7模拟物(mimics)可显著抑制人肺癌细胞的体外迁移能力。为了进一步明确利用p-T-miR-7载体表达miR-7对人肺癌细胞的生物学特性的影响,我们又观察了95D细胞体外迁移的变化。划痕法结果显示:与p-Cont组相比,p-T-miR-7组细胞的体外迁移能力受到显著抑制(120±5,45±3,40±3,P<0.05),提示p-T-miR-7载体表达miR-7可抑制95D细胞体外迁移能力。

注:A:p-Cont组(2μg); B:p-T-miR-7组(1.5μg);C:p-T-miR-7组(2μg);D:A-C组的细胞计数比较(*P<0.05),E:CCK-8实验结果(*P<0.05)。 图5 瞬时转染p-T-p-miR-7对人肺癌95D细胞体外生长的影响(×100)
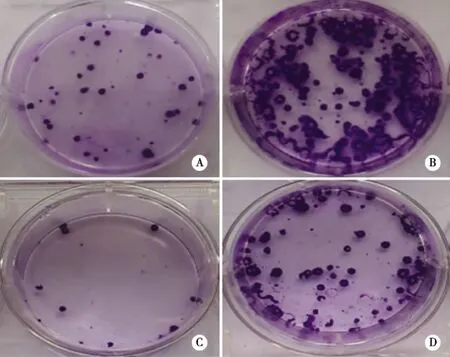
注:A、B:p-Cont转染组;C、D:p-T-miR-7转染组。A、C:200cells/well;B、D:800cells/well。 图6 转染p-T-miR-7抑制人肺癌95D细胞的克隆形成能力

注:A:p-Cont组(2μg);B:p-T-miR-7组(1.5μg);C:p-T-miR-7组(2μg);D:A~C组划痕部位的细胞计数比较(*P<0.05)。图7 p-T-miR-7转染抑制人肺癌95D细胞的体外迁移(×100)
3 讨论
现有的临床肺癌治疗的主要方法有外科手术治疗、化学治疗、放射治疗。但肺癌的发生、侵袭和转移过程十分复杂,涉及多因素、多水平的分子调控机制,因此现有的治疗方法的疗效仍十分有限[13-15]。所以新治疗策略的开发仍显得十分必要。肿瘤的基因治疗技术是近年来得到快速发展的一项生物学新技术,主要指将外源或内源基因导入肿瘤细胞以达到治疗肿瘤的目的。目前,已知与肺癌的发生、发展和转移密切相关的基因数目庞大且机制复杂,其中近年发现的一类小分子RNA-miRNAs与肺癌间的关系已成为该领域的研究热点和重点之一[16-17]。
越来越多的研究表明,miRNAs分子参与调控了生物体的生长发育过程并参与一系列的生命活动,如细胞的生长、侵袭、凋亡等等。如:我们在前期研究中发现miR-7在正常脑、胸腺、淋巴结等组织中均高表达,尤其以肺组织表达水平最高[18]。而在临床肺癌组织中,miR-7的表达水平则显著降低,且与肺癌细胞的转移密切相关[5]。同时,体外利用miR-7模拟物(mimics)可显著抑制人肺癌细胞的体外增殖[6]。而Xiong[19]等的研究发现,miR-7在非小细胞肺癌细胞中呈现低表达,而miR-7模拟物可以抑制细胞的增殖和迁移并诱导其凋亡。此外他们的研究还显示,miR-7的表达水平与Bcl-2呈负相关性。因此,该miRNA的缺失或表达水平下调,均可导致Bcl-2表达水平的升高,从而促进肺癌的发生。Lee等[20]的研究还提示,miR-7还可以增加肺癌细胞对化疗的敏感性。我们在近期的研究中利用分子生物学技术成功构建了基于CMV启动子的miR-7的真核表达载体,发现过表达miR-7可显著抑制人肺癌细胞体内外生长、侵袭和转移[7-9]。以上的研究表明:改变肿瘤细胞中特定miRNA分子的表达水平将为肺癌的基因治疗提供了新的策略和尝试。
在本研究中,我们构建了TTF-1启动子调控miR-7表达的真核表达载体,并观察其在体外的表达活性。我们以人肺巨细胞癌细胞系95D细胞基因组DNA为模板,利用PCR分别扩增TTF-1启动子序列和miR-7前体序列,纯化产物分别经Kpn I和Mul I双酶切与Mul I和HindⅢ双酶切,克隆入pGL3-basic-载体,分别经菌液PCR、双酶切鉴定以及测序验证,结果表明成功构建了真核表达载体PGL3-basic-TTF-1-promoter-miR-7(命名为p-T -miR-7)。此外,我们发现将p-T-miR-7瞬时转染人肺癌95D细胞可显著增加miR-7成熟体的表达水平,提示TTF-1启动子可有效启动miR-7在真核细胞中的表达。重要的是,CCK-8实验和克隆形成实验进一步显示,转染p-T-miR-7后,95D细胞的增殖和生长能力受到明显抑制。同时划痕法检测结果显示p-T-miR-7载体过表达miR-7后还可显著抑制95D细胞的体外迁移,与我们前期发现CMV启动过表达miR-7的结果是一致的[8-9]。这些结果提示基于TTF-1启动子调控的miR-7真核表达载体可有效表达miR-7成熟体,且具有显著的生物学效应。然而,TTF-1调控miR-7表达在人肺癌细胞中的确切靶向性仍待后续研究探讨。
总之,在本研究中我们成功构建TTF-1启动子调控的miR-7真核表达载体,这为后续开发基于miR-7靶向基因治疗肺癌的新策略提供了重要的前期实验基础。
[参考文献]
[1] Hayashita Y,Osada H,Tatematsu Y,et al.A polycistronic microRNA cluster, miR-17-92,is overexpressed in human lung cancers and enhances cell proliferation[J]. Cancer Res,2005,65(21): 9628-9632.
[2] Lu Y,Thomson J M,Wong H Y,et al.Transgenic over-expression of the microRNA miR-17-92 cluster promotes proliferation and inhibits differentiation of lung epithelial progenitor cells[J]. Dev Biol,2007,310(2):442-453.
[3] Ivanovska I,Ball A S,Diaz R L,et al.MicroRNAs in the miR-106b family regulate p21/CDKN1A and promote cell cycle progression[J].Mol Cell Biol,2008,28(7): 2167-2174.
[4] Zhang J G,Wang J J, Zhao F,et al.MicroRNA-21 (miR-21) represses tumor suppressor PTEN and promotes growth and invasion in non-small cell lung cancer (NSCLC)[J].Clin Chim Acta,2010,411(11-12):846-852.
[5] 徐林,任涛,秦安东,等.MiRNA-7对人肺癌95D细胞体外侵袭的作用[J].遵义医学院学报,2011,34(1):12-16.
[6] 徐林,任涛,周涯,等.微小 RNA-7对人肺癌95D细胞体外增殖的作用[J].肿瘤,2010,30(9):763-767.
[7] 宋永祥,李颖,秦安东,等.MiRNA-7真核表达载体的构建及鉴定[J].西安交通大学学报:医学版,2013,34(4):440-445.
[8] 胡燕,廖诊媛,陈超,等.过表达microRNA-7通过下调CGG结合蛋白1的表达抑制人肺癌细胞生长[J].细胞与分子免疫学杂志,2014,30(2):125-130.
[9] 朱顺飞,廖珍媛,胡燕,等.微小RNA-7过表达对人肺癌细胞体内外转移的影响[J].遵义医学院学报,2013,36(5):401-405.
[10] Civitareale D,Lonigro R,Sinclair A J,et al.A thyroid-specific nuclear protein essential for tissnespecific expression of the thyroglobulin promoter[J].Emboj,1989,8(9):2537-2542.
[11] Barletta J A,Perner S,Lafrate A J,et al.Clinical significance of TTF-1 protein expression and TTF-1 gene amplification in lung adenocarcinoma[J].J Cell Mol Med,2009,13(8B):1977-1986.
[12] Di Coreto C,Di Lauro V,Puglisi F,et al.Immunocytochemical expression of tissue-specific transcription factor-1 in lung carcinoma[J].J Clin Pathol,1997,50(1):30-32.
[13] Hardy D,Liu C C,Xia R,et al.Racial disparities and treatment trends in a large cohort of elderly black and white patient with nonsmall cell lung cancer[J].Cancer,2009,115(10):2199-2211.
[14] Pfeffer G P,Denissenko M F,Olivier M,et al.Tobeco smoke carcinogens.DNA damage and p53 mutations in smoking-associated cancers[J].Oncogene,2002,21(48):7435-7451.
[15] Halnsut P,Olivier M,Pfeffer G P.TP53 mutation spectrum in lung cancers and mutagenic signature of components 0f tobacco smoke:Lessons from the IARC TP53 mutation database [J].Mutagenesis,200l,16(6):551-553.
[16] Xu L,Wen Z,Zhou Y,et al.MicroRNA-7-regulated TLR9 signaling-enhanced growth and metastatic potential of human lung cancer cells by altering the phosphoinositide-3-kinase,regulatory subunit 3/Akt pathway[J].Mol Biol Cell,2013,24(1): 42-55.
[17] Lu Z,Ding L,Hong H,et al.Claudin-7 inhibits human lung cancer cell migration and invasion through ERK/MAPK signaling pathway[J].Exp Cell Res,2011,317(13):1935-1946.
[18] 郑静,李颖,秦安东,等.MiRNA-7在小鼠不同组织器官中表达的检测级其意义[J].遵义医学院学报,2012,35(2):91-97.
[19] Xiong S,Zheng Y,Jiang P,et al.MicroRNA-7 Inhibits the Growth of Human Non-Small Cell Lung Cancer A549 Cells through Targeting BCL-2[J].Int J Biol Sci,2011,7(6): 805-814.
[20] Lee K M,Choi E J,Kim I A.MicroRNA-7 increases radiosensiticity of human cancer cells with activated EGFR-associated signaling[J].Radiother Oncol,2011,101(1):171-176.

