反复腹腔注射脂多糖诱导大鼠阿尔茨海默病样神经炎症
李明刚,邓媛媛,石京山,龚其海
(遵义医学院 药理学教研室暨贵州省基础药理重点实验室,贵州 遵义 563099)
阿尔茨海默病(Alzheimer’s disease,AD)为临床常见病、多发病,占老年痴呆发病的60%~70%。AD的主要病理特征为老年斑、神经纤维缠结及神经元变性、缺失[1]。AD病因及发病机制迄今尚未完全明了,可能涉及到基因缺陷、代谢紊乱、氧化应激及环境毒素等多方面[2]。在上世纪90年代,有研究发现炎症参与了AD发病的病理生理学过程[3],这一观点在临床上也逐渐得到证实[4]。后来大量研究也报道了神经炎症在AD发病中的重要作用[5],同时也试图通过构建各种炎症动物模型模拟AD的神经炎症反应,旨在用于AD发病机制的深入研究及防治AD的新药研究。其中,较为成熟的有侧脑室植管、单侧或者双侧注射脂多糖(lipopolysaccharide,LPS)诱导AD样神经炎症动物模型等[6],但这些模型存在操作繁琐、模拟AD样神经炎症不够全面等缺点。因此,继续探索操作简单且能够较为全面模拟AD样神经炎症的动物模型具有重要意义。本研究对反复腹腔注射LPS建立AD样神经炎症的大鼠模型进行了探索。
1 材料与方法
1.1 实验动物 SPF级雄性Sprague-Dawley大鼠25只,体重210g±10 g,第三军医大学大坪医院实验动物中心提供,许可证号:SCXK(渝)2007-0005。
1.2 主要仪器设备及试剂 MT-200 Morris水迷宫:成都泰盟科技公司产品;全自动凝胶图象分析仪:美国BIO-RAD公司产品;脂多糖:购自美国Sigma公司;兔抗大鼠APP、β-分泌酶、Aβ1-40、TNF-α、IL-1β、COX-2抗体:购自英国Abcom公司;p-NF-κB-p65、NF-κB-p65、IκB-α、β-actin购自美国Cell Sinnaling公司;BCA蛋白浓度含量测定试剂ECL发光剂:购自江苏碧云天生物技术研究所。
1.3 动物分组及处理 25只大鼠随机分为2组,空白对照组(n=10)和模型组(n=15)。结合预实验研究,ip给予 LPS 0.5 mg/kg,每周1次, 连续13周,空白对照组注射等体积溶媒。实验过程监测大鼠体重并观察其一般情况。
1.4 Morris水迷宫检测 末次注射LPS后,次日采用Morris水迷宫检测大鼠的学习记忆能力,Morris水迷宫组成及检测方法参照本课题组既往方法[7],通过定位航行实验中的逃避潜伏期反映大鼠的学习记忆能力。
1.5 HE染色 水迷宫测试完毕后,每组随机抽取3只大鼠,经10%水合氯醛麻醉,断头取脑,常规石蜡包埋, 冠状切片, 厚度5 μm, 每隔2张取1张,HE染色,光学显微镜下观察海马CA1区神经元形态变化。
1.6 透射电镜 水迷宫测试完毕后,每组随机抽取3只大鼠用于透射电镜观察海马CA1区的超微结构,取材及操作按文献进行[8]。
1.7 Western blot 各组剩余大鼠海马均用于Western blot检测,取材方法及操作按本课题组既往方法进行[7-8]。简言之,BCA法测定蛋白浓度,SDS-PAGE电泳分离,转膜,5%脱脂奶粉封闭,IL-1β(1∶5000)、TNF-α(1∶2000)、COX-2(1∶1000)、IκB-α(1∶2000)、p-NF-κB-p65(1∶1000)、NF-κB-p65(1∶1000)、APP(1∶2000)、β-分泌酶(1∶2000)、Aβ1-40(1∶2000)及β-actin(1∶1000)过夜,洗膜,HRP标记的羊抗兔二抗(1∶5000)室温孵育90 min,洗膜,ECL发光,曝光后凝胶成像系统拍照分析。
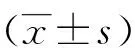
2 结果
2.1 反复腹腔注射LPS对大鼠一般情况及学习记忆的影响 实验过程中,每次腹腔注射LPS后,大鼠在第1、2天体重下降或不增,但至实验结束时,两组大鼠的体重并无差异,一般状态也未见差别。末次注射LPS后,次日采用Morris水迷宫检测了大鼠的学习记忆功能,结果发现在实验第1、2天两组大鼠的逃避潜伏期无差异,第3、4天模型组大鼠的逃避潜伏期较对照组明显延长(P<0.05),这表明反复腹腔注射LPS可诱导大鼠的学习记忆减退(见图1)。
注:资料以表示,n=10~15,与对照组比较,*P<0.05。 图1 反复腹腔注射LPS对大鼠学习记忆的影响
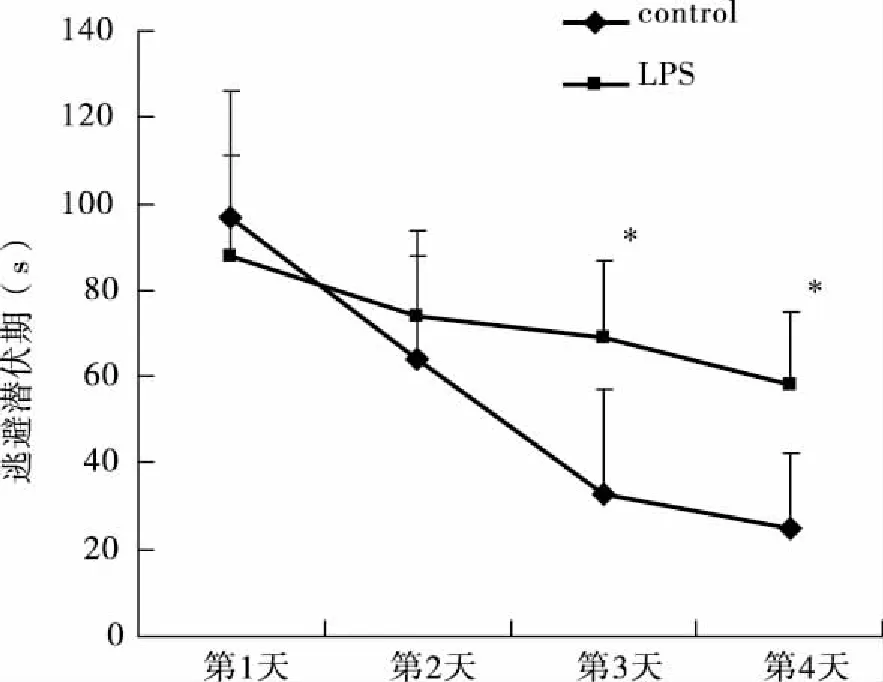
2.2 反复腹腔注射LPS对大鼠海马神经元形态的影响 HE染色观察了大鼠海马CA1区的神经元形态。对照组神经元形态正常,细胞量多,排列整齐,结构清晰,细胞膜完整,核仁清晰(见图2A)。而模型组神经细胞变性、坏死较多,结构混乱不清,细胞质呈空泡状、胞核出现不同程度的溶解(见图2B)。
注:A:对照组;B:LPS组。图2 反复腹腔注射LPS对大鼠海马神经元形态的影响(×100)
2.3 结果发现,对照组大鼠海马CA1区神经元可见细胞核和胞质,胞核较大,呈圆形或卵圆形,胞体内含较发达的粗面内质网、游离核糖体、高尔基复合体及神经丝等(见图3A)。然而,与对照组比较,模型组大鼠海马CA1区神经元胞核未见明显异常,部分细胞器肿胀,以内质网扩张为主,部分线粒体嵴扩张(见图3B)。

注:A.对照组;B.LPS组。→示内质网扩张,↑示线粒体嵴扩张。图3 反复腹腔注射LPS对大鼠海马神经元超微结构的影响
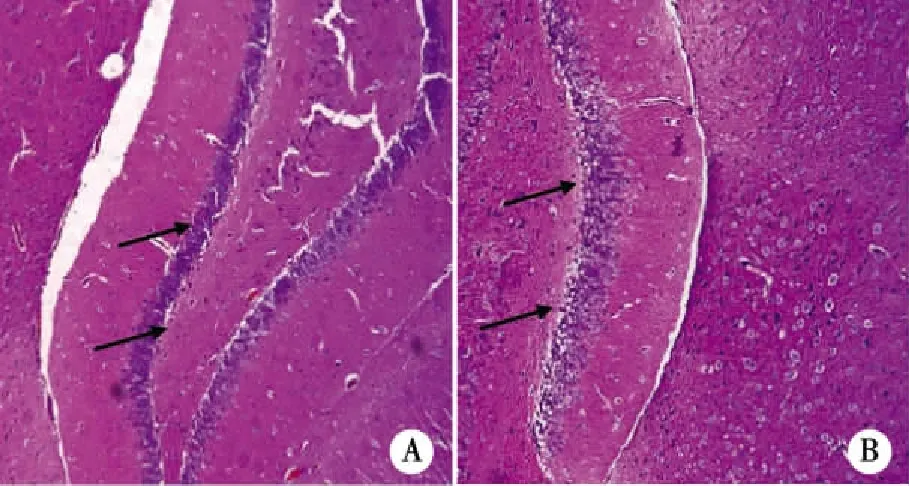
2.4 反复腹腔注射LPS对大鼠海马APP-Aβ代谢途径的影响 本研究采用Western blot检测了大鼠海马APP-Aβ代谢途径中的关键蛋白表达及终产物Aβ1-40含量。结果发现,反复腹腔注射LPS后大鼠海马APP及β-分泌酶表达较对照组明显增加,而且终产物Aβ1-40含量也较对照组明显增加(见图4)。
注:A: APP、β-分泌酶及Aβ1-40的代表性条带;B: APP表达的定量分析;C:β-分泌酶表达的定量分析;D: Aβ1-40含量的定量分析。资料以表示,n=3,**P < 0.01 control。图4 反复腹腔注射LPS对大鼠海马APP-Aβ代谢途径的影响
2.5 反复腹腔注射LPS对大鼠海马相关炎症因子表达的影响 本研究采用Western blot检测了大鼠海马TNF-α、IL-1β及COX-2等炎症因子的蛋白表达。结果发现,反复腹腔注射LPS后大鼠海马TNF-α、IL-1β及COX-2等炎症因子的蛋白表达均较对照组明显增加(见图5)。

注:A: TNF-α、IL-1β及COX-2蛋白表达的代表性条带;B:TNF-α表达的定量分析;C:大鼠海马IL-1β表达的定量分析;D: COX-2蛋白表达的定量分析。资料以表示,n=3. **P < 0.01 vs control。图5 反复腹腔注射LPS对大鼠海马相关炎症因子表达的影响
2.6 反复腹腔注射LPS对大鼠海马IκB-α含量及NF-κB p65磷酸化的影响 为进一步探索反复腹腔注射LPS诱导的TNF-α、IL-1β及COX-2等炎症因子产生的作用机制,采用Western blot检测了IκB-α含量及NF-κB p65磷酸化情况。结果发现,反复腹腔注射LPS后,IκB-α含量较对照组明显降低,而p-NF-κB p65水平较对照组明显增加(见图6)。
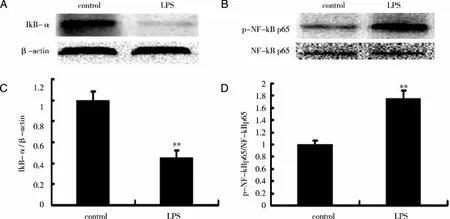
注:A:IκB-α含量的代表性条带;B: p-NF-κB p65水平的代表性条带;C: IκB-α含量的定量分析;D:p-NF-κB p65水平的定量分析。资料以表示,n=3. **P < 0.01 vs control。图6 反复腹腔注射LPS对大鼠海马IκB-α含量及NF-κB p65磷酸化的影响
3 讨论
AD的主要临床表现为认知功能减退,学习记忆首先受累。因此,一个成熟的AD动物模型首先必须能够模拟学习记忆功能的减退。在本研究中,反复腹腔注射LPS后,大鼠逃避潜伏期较对照组明显延长。逃避潜伏期主要反映大鼠的学习记忆功能,逃避潜伏期越长,表明大鼠的学习记忆能力越低下[8]。本研究表明,反复腹腔注射LPS可诱导大鼠的学习记忆减退,与急性侧脑室注射LPS诱导的大鼠学习记忆减退一致[8]。学习记忆中枢在海马。既往研究发现,大鼠侧脑室注射细菌内毒素LPS后,可出现大鼠海马神经元结构损伤及超微结构改变[8-9]。本研究发现反复腹腔注射LPS后,大鼠海马神经细胞变性、坏死较多,结构混乱不清晰,细胞质呈空泡状、胞核出现不同程度的溶解,而且CA1区神经元部分细胞器肿胀,以内质网扩张为主,部分线粒体嵴扩张。这提示反复腹腔注射LPS可诱导大鼠海马神经元形态及超微结构损伤,与大鼠侧脑室注射LPS所致的神经元损伤结果一致[8-9]。
AD的主要病理学特征之一为细胞外老年斑,主要由于Aβ1-40/42沉积所致。本研究发现,反复腹腔注射LPS后,大鼠海马APP及β-分泌酶表达明显增加,终产物Aβ1-40含量也明显增加。提示反复腹腔注射LPS可诱导大鼠海马的特征性病理生理学Aβ沉积改变。已有研究表明神经炎症在AD发病中的重要的作用[5]。本研究发现反复腹腔注射LPS后大鼠海马的炎症因子TNF-α、IL-1β及COX-2等蛋白表达明显增加,与大鼠侧脑室注射产生的炎性变化一致[8-9]。
已有研究认为TNF-α、IL-1β及COX-2等炎症因子的蛋白表达增加与NF-κB通路的激活有关,因此本研究检测了大鼠海马IκB-α含量及NF-κB p65磷酸化水平。NF-κB为一个转录因子蛋白家族,常以二聚体或异二聚体的形式存在,其中最常见的NF-κB二聚体由p65与 p50组成,主要调节先天性免疫反应[10]。IκB为NF-κB的抑制单位,其C末端特定的锚蛋白重复序列与NF-κB结合,并覆盖NLS阻止NF-κB向胞核内转移。细胞在静息状态中,NF-κB和IκB二者形成复合体,在胞浆中以无活性形式存在。当细胞受到胞外信号刺激后,IκB激酶复合体激活,IκB磷酸化,并将NF-κB暴露核定位位点。游离的NF-κB迅速移位至细胞核并与特异性κB序列结合,从而诱导相关基因转录,包括炎症相关因子TNF-α、IL-1β及COX-2等[10]。本研究发现,反复腹腔注射LPS后,IκB-α降解及p-NF-κB p65水平明显增加,从而导致炎症相关因子表达。
故可认为,反复腹腔注射LPS后,大鼠在行为学、形态学、病理生理学及分子生物学等多方面都产生了AD样神经炎症改变,该制模方法与既往方法比较,建模时间长,更能模拟AD这一慢性神经炎症过程。同时,腹腔注射不用开颅、不用埋管,操作简单。总之,反复腹腔注射脂多糖诱导大鼠AD样神经炎症,该模型操作简单、稳定,可用于大鼠AD样神经炎症的发生机制研究及抗AD药物评价。
[参考文献]
[1] Erten-Lyons D, Woltjer R L, Dodge H, et al.Factors associated with resistance to dementia despite high Alzheimer disease pathology[J]. Neurology, 2009,72(4):354-360.
[2] Ballard C, Gauthier S, Corbett A, et al. Alzheimer's disease[J]. Lancet,2011,377(9770):1019-1031.
[3] Brugg B, Dubreuil Y L, Huber G, et al.Inflammatory processes induce beta-amyloid precursor protein changes in mouse brain[J]. Proc Natl Acad Sci USA,1995, 92(7):3032-3035.
[4] Sala G, Galimberti G, Canevari C, et al. Peripheral cytokine release in Alzheimer patients: correlation with disease severity[J]. Neurobiol Aging,200,24(7):909-914.
[5] Ferreira S T, Clarke J R, Bomfim T R, et al. Inflammation, defective insulin signaling, and neuronal dysfunction in Alzheimer's disease[J]. Alzheimers Dement,2014,10(Suppl 1):76-83.
[6] Espinosa-Oliva A M, de Pablos R M, Herrera A J. Intracranial injection of LPS in rat as animal model of neuroinflammation[J]. Methods Mol Biol,2013,1041:295-305.
[7] Gong Q H, Wang Q, Pan L L, et al. S-propargyl-cysteine, a novel hydrogen sulfide-modulated agent, attenuates lipopolysaccharide-induced cognitive impairment: involvement of TNF signaling and NF-kB pathway in rats[J]. Brain Behav Immun,2011,25(1): 110-119.
[8] Gong Q H, Pan L L, Liu X H, et al. S-propargyl-cysteine (ZYZ-802), a sulphur-containing amino acid, attenuates beta-amyloid-induced cognitive deficits and pro-inflammatory response: involvement of ERK1/2 and NF-κB pathway in rats[J]. Amino Acids,2011,40(2):601-610.
[9] 龚其海,丁利静,王丽娜,等. 蛇床子素减轻脂多糖诱导的大鼠学习记忆减退[J].中国新药与临床杂志,2011,30(8):609-614.
[10] Ghosh S, Karin M. Missing pieces in the NF-kappaB puzzle[J]. Cell,2002,109 (Suppl):81-96.

