猪带绦虫TSOL18基因在长双歧杆菌中的表达
周必英,刘美辰,杨凤娇
(遵义医学院 寄生虫学教研室,贵州 遵义 563099)
猪囊尾蚴病(Cysticercosis cellulosae)是由猪带绦虫(Taeniasolium)的幼虫囊尾蚴寄生于人或猪等而引起的人畜共患寄生虫病,已成为全球性的公共卫生问题,在我国的感染率为0.14%~3.20%。药物及手术治疗都有其局限性,研制疫苗是防治该病的重要手段[1-3]。研究表明,猪带绦虫六钩蚴TSOL18基因具有良好的免疫原性和免疫保护性,是一种理想的疫苗候选抗原[4-7]。双歧杆菌(Bifidobacteria)是人和哺乳动物的肠道益生菌,也是一种基因工程受体菌。本研究拟在成功构建猪带绦虫大肠杆菌-双歧杆菌穿梭表达质粒pGEX-TSOL18的基础上[8],研究猪带绦虫TSOL18基因在长双歧杆菌中的表达情况,为猪囊尾蚴病的疫苗研制提供实验基础。
1 材料与方法
1.1 质粒和菌种 质粒pGEX-TSOL18由本课题组构建保存;长双歧杆菌(B.longum)购自美国菌种典藏中心。
1.2 主要试剂和仪器 质粒小量抽提试剂盒;T4DNA连接酶、DNA Marker、BamHI和EcoRI购自日本Takara公司;MRS培养基购自美国Difico公司;重组质粒pGEX-TSOL18和兔抗血清由本室制备[8],囊虫病猪血清采集自建的囊虫病猪感染模型,囊虫病患者血清由四川省疾病预防控制中心提供;其余试剂均为国产分析纯。核酸电泳装置购自北京六一仪器厂;PCR 仪购自美国 MJ-Research公司;厌氧发生器购自法国梅里埃公司。
1.3 重组质粒pGEX-TSOL18电转化B.longum将B.longum冻干粉用无菌水充分溶解后,涂布于MRS琼脂平板上,37 ℃厌氧培养24~72 h,使其充分活化;挑取活化的单菌落,接种于4 mLMRS液体培养基中,37 ℃厌氧培养至菌体OD600 nm值为0.5左右;按1∶25比例接种于MRS培养基中,37 ℃厌氧培养24~72 h;冰浴30 min,4 ℃10 000 r/min离心1 min,弃上清,沉淀用预冷的0.5 M蔗糖清洗2次,再用100 μL 0.5 M蔗糖缓冲液重悬。取100 μL与重组质粒pGEX-TSOL181 μg混匀,冰浴10~15 min后转移至1 mm的电击杯中,电击参数设置为:电压1.25 KV、场强12.5 KV/cm、电容25 μF、电阻200 Ω、转化时间5 ms;电击完毕后立即将混合液转入到900 μLMRS液体培养基的EP管中,37 ℃厌氧培养2 h;将菌液涂布于含100 μg/mL氨苄青霉素的MRS琼脂平板上,37 ℃厌氧培养24~72 h。挑取上述平板中单个菌落至1 mL含100 μg/mL氨苄青霉素的MRS培养基的EP管中,37 ℃厌氧培养24~72 h;将菌液4 ℃10 000 r/min离心5 min,弃上清,沉淀中加入250 μL 25%蔗糖溶液重溶菌体沉淀,37 ℃温浴30 min,期间每隔5 min振荡1次,使其充分反应;抽提质粒,进行酶切、PCR和测序鉴定。筛选阳性的转化菌株作为表达菌株进行诱导表达实验。
1.4 TSOL18基因在B.longum中的表达 选取电转化阳性的转化菌,接种于MRS液体培养基,37 ℃厌氧培养至OD值为0.6左右,取未诱导的菌液作对照,余下分别加入终浓度为0.1 mM、0.5 mM、1.0 mM IPTG37 ℃诱导表达48 h。分别将未诱导与诱导菌液离心收集菌体,重悬于预冷PBS缓冲液中。在冰浴中超声裂解20 min,4 ℃6 000 r/min离心15 min,留取诱导上清及诱导沉淀,用12%SDS-PAGE分析重组蛋白的表达情况。
1.5 Western blot鉴定 分别使用兔抗血清、囊虫病猪血清、囊虫病患者血清与重组蛋白杂交,鉴定表达的重组蛋白。
2 结果
2.1B.longum中重组质粒pGEX-TSOL18的酶切鉴定 从具有氨苄青霉素抗性的B.longum中抽提的重组质粒pGEX-TSOL18,经BamHⅠ和EcoRⅠ双酶切,用1%琼脂糖凝胶电泳,得到4944 bp的pGEX-1λT载体片段和393bp的TSOL18基因片段,与预期结果相符(见图1)。
2.2B.longum中重组质粒pGEX-TSOL18的PCR鉴定 以从具有氨苄青霉素抗性的B.longum中抽提的重组质粒pGEX-TSOL18为模板进行PCR扩增,可得到492bp的基因片段,除去载体序列99bp,TSOL18基因实际的长度为393bp,与预期结果相符(见图2)。测序结果表明,与预期序列100%匹配,提示重组质粒pGEX-TSOL18成功转入长双歧杆菌。
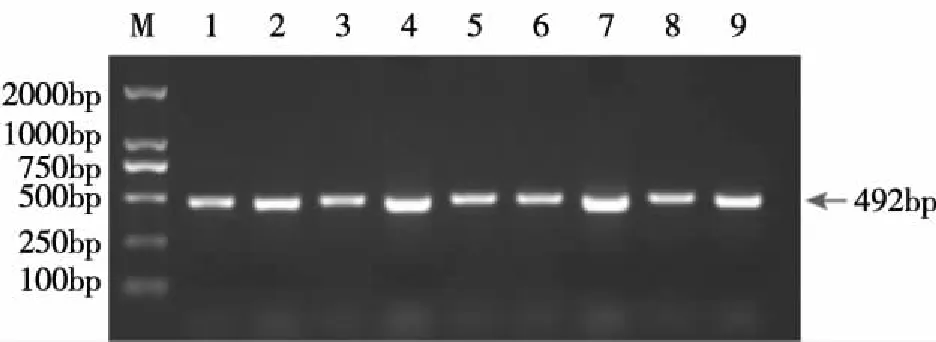
注:M:DNA分子质量标准;1~9:B.longum中重组质粒pGEX-TSOL18的PCR产物。图2 B.longum中重组质粒pGEX-TSOL18的PCR鉴定
2.3 TSOL18基因在B.longum中的表达 转化后的菌株菌体浓度达到OD值0.6左右时,分别经0.1mM,0.5 mM,1.0mM 浓度的IPTG诱导,重组蛋白大小理论值为41.01KD。其中GST标签蛋白26.3KD,经SDS-PAGE分析显示,在诱导48h后上清和沉淀中41KD处有明显的蛋白条带出现,且大小与理论的分子量41.01KD相吻合,初步判断重组蛋白有表达,但表达量极低(见图3)。

注:M:Marker;1:未诱导的菌液上清;2:0.1 mM IPTG诱导后48h上清;3:0.5 mM IPTG诱导后48h上清;4:1.0 mM IPTG诱导后48h上清;5:未诱导的菌液沉淀;6:0.1 mM IPTG诱导后48h沉淀;7:0.5 mM IPTG诱导后48h沉淀;8:1.0 mM IPTG诱导后48h沉淀。图3 37℃IPIG诱导48h表达鉴定
2.4 Western blot鉴定 如图4所示,重溶后的重组蛋白均能与兔抗血清、囊虫病猪血清、囊虫病患者血清特异性结合,在41KD处出现明显的反应带。

注:1:兔抗TSOL18血清;2:囊虫病猪血清;3:囊虫病患者血清;4:空白对照。图4 Western blot鉴定
3 讨论
18ku基因是Harrison等[9]和Lightowlers等[10]分别从羊绦虫(TO)和牛绦虫(TSA)六钩蚴cDNA文库中分离得到的阳性克隆,该基因在大肠杆菌中的表达产物18-GST融合蛋白可诱导羊和牛产生较好的免疫保护作用。鉴于带科绦虫具有较高的相似性,Gauci等[11-12]和骆学农等[13]受此启发,相继成功地克隆出猪带绦虫六钩蚴TSOL18基因,该基因序列与GenBank登录的TSOL18的同源性为99.5%,与TO18的同源性为 80.4%, 与TSA9 的同源性为77.2%,推导的氨基酸序列与其他带绦虫宿主保护性抗原具有很高的同源性和高度的保守性,其编码蛋白含有与宿主免疫内分泌密切相关的FnⅢ结构域,因此,推测TSOL18编码蛋白在六钩蚴入侵宿主时起重要作用,是预防猪囊尾蚴病的一种理想疫苗候选抗原。
双歧杆菌(Bb)因其具有独特的安全性和益生的作用,随着分子生物学和免疫学技术的发展,以其作为受体菌,在基因治疗、外源蛋白表达和疫苗研制等方面的研究受到了国内外学者的极大关注,已在细菌、病毒、肿瘤、寄生虫等领域迅速开展起来[14-17],为传染病、肿瘤和寄生虫病的免疫预防和免疫治疗带来了希望。为了将外源基因有效引入双歧杆菌,需构建大肠杆菌-双歧杆菌穿梭表达载体,本研究采用的穿梭表达载体pGEX-1λT同时含有双歧杆菌和大肠杆菌复制起点,外源基因既可在大肠杆菌中表达,又可在在双歧杆菌中表达。前期本课题组已成功构建了猪带绦虫重组质粒pGEX-TSOL18,并实现了在大肠杆菌中的成功表达[8],本研究在此基础上,将构建的重组质粒pGEX-TSOL18电穿孔转化B.longum,经IPTG 37℃诱导表达48 h,SDS-PAGE结果显示插入的外源基因TSOL18在B.longum中成功表达了相对分子质量约为41 KD的TSOL18/GST融合蛋白,除去载体表达的GST部分约26 KD,猪带绦虫TSOL18基因实际表达的蛋白约为15 KD,与预期结果相符。Western blot显示,TSOL18重组蛋白能被兔抗血清、囊虫病猪血清和囊虫病患者血清所识别。表明TSOL18基因在长双歧杆菌中也得到了正确表达,表达的重组蛋白具有特异的抗原性,为下一步猪囊尾蚴病疫苗的研制奠定了基础。
[参考文献]
[1] Ito A,Urbani C,Jiamin Q,et al.Control of echinococcosis and cysticercosis:a public health challenge to international cooperation in China[J].Acta Tropica,2003,86(1):3-17.
[2] 周必英,陈雅棠,李文桂.猪囊尾蚴病DNA疫苗研究现状[J].中国寄生虫学与寄生虫病杂志,2010,28(2):148-152.
[3] 李文桂,陈雅棠.猪带绦虫TSOL18疫苗的研制现状[J].国际医学寄生虫病杂志,2012,39(2):116-119.
[4] Cai X P,Yuan G L,Zheng Y D,et al.Effective production and purification of the Glycosylated TSOL18 antigen,which is protective against pig cysticercosis[J].Infect Immun,2008,76(2):767-770.
[5] Ding J,Zheng Y,Wang Y,et al.Immune responses to a recombinant attenuated Salmonellatyphimurium strain expressing aTaeniasoliumoncosphere antigen TSOL18[J].Comp Immunol Microbiol Infect Dis,2013,36(1):17-23.
[6] 骆学农,郑亚东,胡志敏,等.猪带绦虫45W-4BX和TSOL18的高效表达及免疫效果研究[J].畜牧兽医学报,2008,39(2):212-217.
[7] Flisser A,Gauci C G,Zoli A,et al.Induction of protection against porcine cysticercosis by vaccination with recombinant oncosphere antigens[J]. Infect Immun,2004,72(9): 5292-5297.
[8] 周必英,周泠,刘美辰,等.猪带绦虫TSOL18基因的表达、纯化和兔抗血清的制备[J].中国人兽共患病学报,2013,29(10):977-980,985.
[9] Harrison G B,Heath D D,Dempster R P,et al.Identification and cDNA cloning of two novel low molecular weight host-protective antigens fromTaeniaovisoncospheres[J].Int J Parasitol,1996,26(2):195-204.
[10] Lightowlers M W,Rolfe R,Gauci C G.Taeniasaginata:vaccination against cysticercosis in cattle with recombinant oncosphere antigens[J].Exp Parasitol,1996,84(3):330-338.
[11] Gauci C G,Lightowlers M W.Molecular cloning of genes encoding oncosphere proteins reveals conservation of modular protein structure in cestode antigens[J].Mol Biochem Parasitol,2003,127(2):193-198.
[12] Gauci C G,Ito A,Lightowlers M W.Conservation of the vaccine antigen gene,TSOL18,among genetically variant isolates ofTaeniasolium[J].Mol Biochem Parasitol,2006,146(1):101-104.
[13] 骆学农,郑亚东,吴旭刚,等.猪带绦虫六钩蚴TSO18基因的克隆和表达[J].中国人兽共患病杂志,2005,21(3):262-264.
[14] 王国富,高峰,吴利先.幽门螺杆菌重组Bb-hpaA-vacA疫苗的构建[J].中国人兽共患病学报,2012,28(2):131-134.
[15] 李世彬,李江,贺志良,等.人轮状病毒vp4全基因原核穿梭表达质粒的构建及鉴定[J].中国生物制品学杂志,2011,24(10):1126-1129.
[16] 安丽娜,李著华,岳扬,等.婴儿双歧杆菌介导的CD 和UPRT 联合5-FC 基因疗法对黑色素瘤的体外治疗实验研究[J].四川大学学报:医学版,2007,38(1):27-30.
[17] 向进平,李文桂.寄生虫重组双歧杆菌疫苗研究进展[J].国际医学寄生虫病杂志,2012,39(2):120-123.

