基因芯片对哮喘小鼠趋化因子及其受体差异表达的筛选与分析
岳 欢,李 燕,高 婧,江 涛,黄俊琼
(1.遵义医学院附属医院检验科/遵义医学院检验系,贵州 遵义 563099;2.四川省仁寿县疾病预防控制中心,四川 眉山 620500)
趋化因子是一类小分子可溶性蛋白,能使免疫细胞发生定向趋化和迁移,在炎症反应和免疫应答中具有重要作用。哮喘疾病中炎性细胞的激活和浸润,释放趋化因子,调控其受体的表达,从而诱导炎性细胞迁移至支气管粘膜下激活靶细胞释放相关细胞因子,导致粘液分泌、气道高反应性等症状的发生。我们用SABioscience芯片,同时测定84个编码趋化因子及其受体的关键基因在哮喘小鼠模型的表达情况,为进一步研究其功能奠定基础。
1 材料与方法
1.1 主要试剂 鸡卵白蛋白 (Ovalbumin, OVA)(Sigma公司);Trizol,SuperScript III Reverse Transcriptase(Invitrogen公司,美国);无RNA酶的糖原(Ambion公司);RNeasy®MinEluteTM纯化试剂盒(Qiagen公司);SABioscience趋化因子及其受体PCR芯片(PAMM-022Z,上海康成生物有限公司)。SPF级雌性C57BL/6小鼠,6~8周龄,体重18~22g,购于北京华阜康公司(SCXK(京)2009-0004),饲养于遵义医学院医学实验中心SPF级动物房。
1.2 方法
1.2.1 哮喘模型的建立 16只小鼠随机分为哮喘组和对照组,每组8只。哮喘组在第1、7、14 d经腹腔注射OVA+氢氧化铝凝胶混悬液0.2 mL致敏,第21 d开始用5%OVA雾化激发,连续雾化7 d,每天30 min。对照组用PBS代替OVA。于末次雾化后24 h内,腹腔注射10%水合氯醛麻醉,腹动脉放血后取右肺组织,置于4%多聚甲醛中固定48 h,取左肺组织放于液氮中快速冻存提取总RNA。
1.2.2 肺组织HE染色 肺组织于4%多聚甲醛中固定48h后,取出进行脱水,石蜡包埋,肺组织切片,HE染色。在显微镜下观察肺组织支气管黏膜嗜酸性粒细胞、淋巴细胞等炎症细胞的浸润情况。
1.2.3 肺组织RNA提取 取小鼠肺组织50~100mg,加入1mLTrizol,按常规方法提取总RNA,用RNeasy®MinEluteTM纯化试剂盒纯化RNA,使用NanoDrop®ND-1000测定RNA浓度和纯度。
1.2.4 cDNA合成和实时荧光定量PCR 用SuperScript III Reverse Transcriptase试剂盒进行RNA逆转录后,在105μLcDNA中加入2×SuperArray PCR master mix 1050 μL、945 μL灭菌双蒸水,混匀,每孔PCR反应管加入上述混匀液20 μL,进行2步法实时荧光定量PCR反应:95 ℃10 min;95 ℃15 s;60 ℃1 min。数据分析通过2-ΔΔCt计算实验组与对照组对应基因的表达差异。
2 结果
2.1 哮喘小鼠模型建立 哮喘组小鼠于第1次激发后5~8 min出现烦躁不安,呼吸加深加快(180~200次/min),雾化至15min表现为少动,点头呼吸,口鼻发绀。对照组小鼠未出现上述表现。
2.2 肺组织HE色 对照组小鼠肺组织HE染色可见肺组织、支气管完整,结构正常,少见炎性细胞浸润(见图1A)。哮喘组小鼠肺组织支气管黏膜上皮明显增厚,气道平滑肌增厚,气道管腔变狭窄,气道及血管周围淋巴细胞、嗜酸性粒细胞浸润,黏膜下层水肿、增宽,黏液栓堵塞明显(见图1B)。
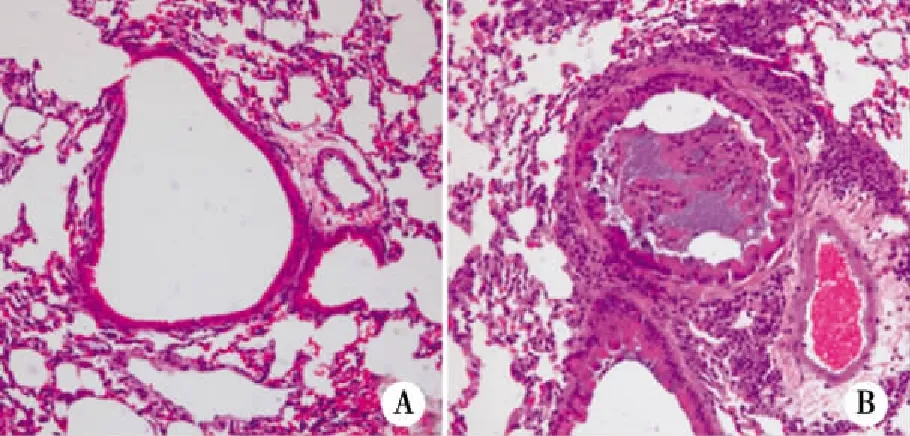
注:A.对照组;B.哮喘组。 图1 哮喘小鼠肺组织HE染色(×200)
2.3 基因芯片检测结果 基因芯片上96个反应孔进行实时荧光定量PCR反应,每张芯片自带有3个逆转录对照和3个PCR阳性对照孔。通过2-ΔΔCt计算实验组与对照组对应基因的表达差异。基因表达差异的筛选标准为:基因表达倍数≥2.0确定上调基因,基因表达倍数≤-2.0确定下调基因。结果为表达上调的趋化因子21个,表达下调的趋化因子4个(见表1);表达上调的趋化因子受体13个,其中部分受体其相应配体表达同时上调(见表2)。
表1哮喘小鼠肺组织趋化因子的表达
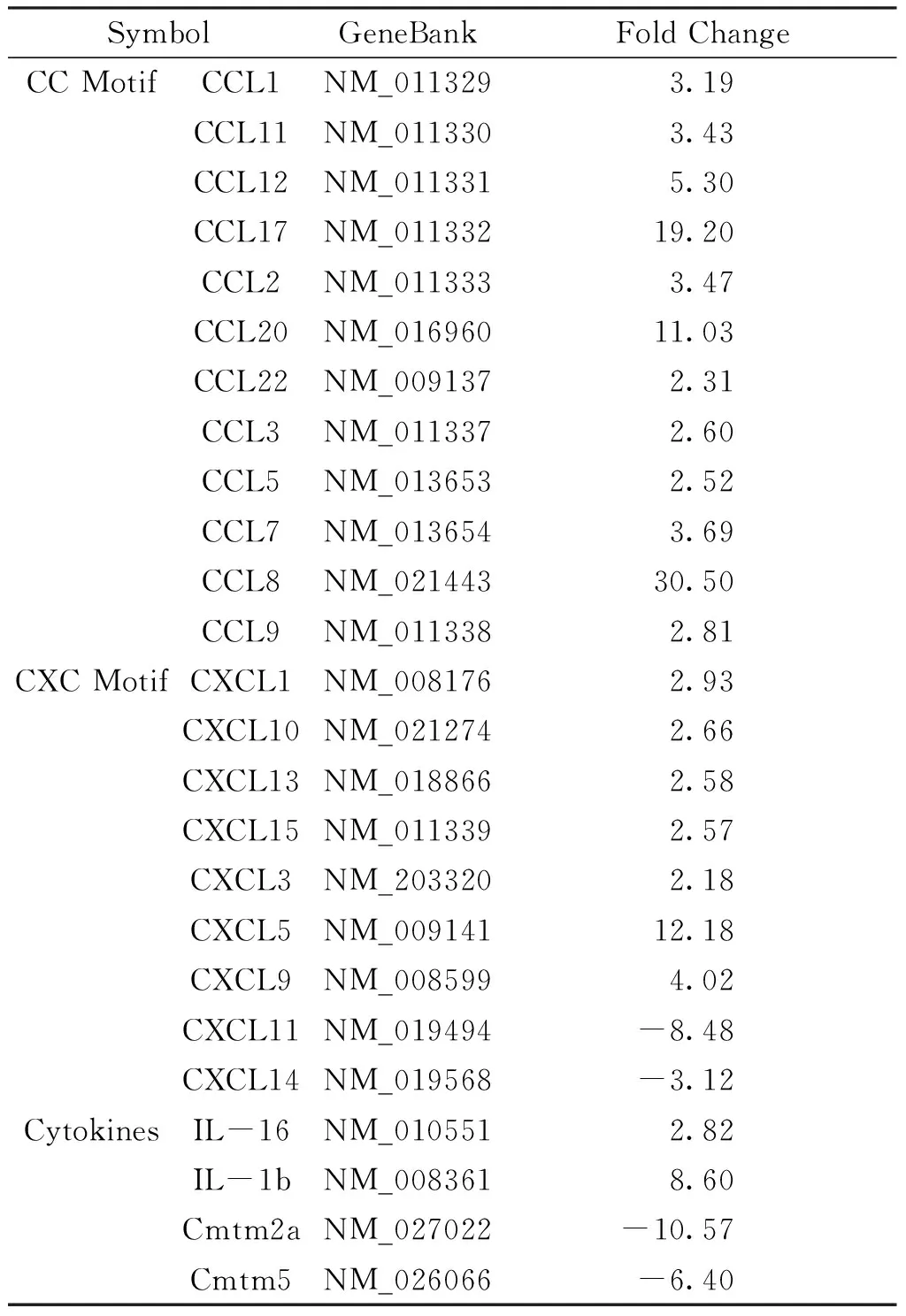
SymbolGeneBankFold ChangeCC Motif CCL1 NM_0113293.19CCL11NM_0113303.43CCL12NM_0113315.30CCL17NM_01133219.20CCL2NM_0113333.47CCL20NM_01696011.03CCL22NM_0091372.31CCL3NM_0113372.60CCL5NM_0136532.52CCL7NM_0136543.69CCL8NM_02144330.50CCL9NM_0113382.81CXC MotifCXCL1NM_0081762.93CXCL10NM_0212742.66CXCL13NM_0188662.58CXCL15NM_0113392.57CXCL3NM_2033202.18CXCL5NM_00914112.18CXCL9NM_0085994.02CXCL11NM_019494-8.48CXCL14NM_019568-3.12CytokinesIL-16NM_0105512.82IL-1bNM_0083618.60Cmtm2aNM_027022-10.57Cmtm5NM_026066-6.40
表2哮喘小鼠肺组织趋化因子受体的表达
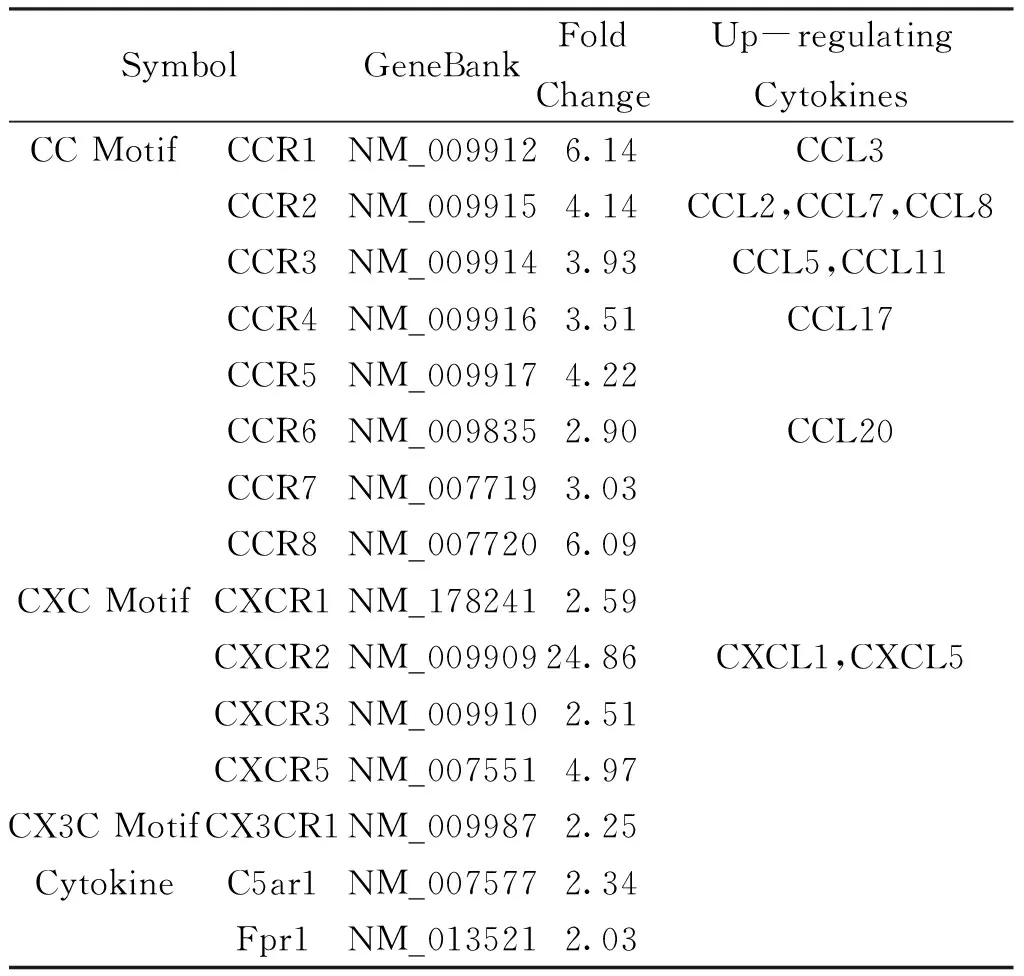
SymbolGeneBankFold ChangeUp-regulating CytokinesCC Motif CCR1NM_0099126.14CCL3CCR2NM_0099154.14CCL2,CCL7,CCL8CCR3NM_0099143.93CCL5,CCL11CCR4NM_0099163.51CCL17CCR5NM_0099174.22CCR6NM_0098352.90CCL20CCR7NM_0077193.03CCR8NM_0077206.09CXC MotifCXCR1NM_1782412.59CXCR2NM_00990924.86CXCL1,CXCL5CXCR3NM_0099102.51CXCR5NM_0075514.97CX3C MotifCX3CR1NM_0099872.25Cytokine C5ar1NM_0075772.34Fpr1NM_0135212.03
3 讨论
SABioscience趋化因子及其受体PCR芯片融合了实时荧光定量PCR和功能分类基因芯片的优点,可在一次实验中准确定量检测84个编码趋化因子及其受体的关键基因的mRNA水平。此芯片灵敏度高,样品使用量低,可以同时检测表达量差异较大基因,Ct值平均差异仅有0.25个循环,可检测超过2倍的基因表达量变化。与雄性小鼠对比,雌性小鼠对气道致敏反应更敏感,炎症性反应和炎性细胞浸润、Th2细胞因子分泌增多更明显[1]。本实验采用OVA致敏和激发雌性C57BL/6小鼠建立支气管哮喘小鼠模型,通过SABioscience基因芯片对哮喘小鼠趋化因子及其受体差异表达进行筛选和分析,为后续研究趋化因子在支气管哮喘中的作用及细胞因子对其表达水平的影响奠定基础。
支气管哮喘是一种变态反应性疾病,发病率逐年增加,尤其是儿童哮喘,已经成为儿童最常见的慢性呼吸系统疾病[2]。哮喘发生过程中,趋化因子可激活淋巴细胞、单核巨噬细胞、中性粒细胞等炎性细胞,并使炎性细胞迁移到炎症部位,在支气管哮喘气道炎症中发挥重要的作用。根据趋化因子的一级结构可将其分为CXC、CC、C及CX3C 4大类。本实验通过基因芯片检测发现,支气管哮喘小鼠肺组织表达增加2倍以上的趋化因子共有21个,其中CC类12个、CXC类9个。CCL5(RANTES)、CCL11(eotaxin)对嗜酸性粒细胞具有强大趋化作用,而CCL2(MCP-1)的趋化作用主要表现在单核巨噬细胞。本课题组前期实验结果也发现在OVA致敏哮喘小鼠肺组织中CCL2 mRNA表达明显高于正常小鼠。Schneider D等人用人鼻病毒(HRV)感染哮喘小鼠后,CCL2、CCL7、CCL20表达增加,CCL2抗体抑制剂能明显减弱HRV感染哮喘小鼠的气道炎症和气道高反应性,由支气管上皮和巨噬细胞产生的CCL2可能有助于加重气道炎症和气道高反应性[3]。哮喘小鼠肺组织CCL17主要表达于支气管上皮细胞,哮喘组CCL17蛋白的表达显著高于对照组,是由于正常小鼠气道上皮细胞分泌CCL17量很少,而哮喘小鼠气道上皮细胞和平滑肌细胞能分泌大量CCL17,与其受体CCR4特异性结合后发挥趋化作用,趋使Th2型细胞到炎症部位。此外通过变应原致敏和激发CCR4-/-小鼠后其气道高反应性明显减低,支气管周围嗜酸性粒细胞浸润减少也提示CCL17及其受体CCR4可能参与哮喘疾病的发生和发展[4]。INF-γ刺激嗜酸性粒细胞可分泌产生趋化因子CXCL9、CXCL10,也有研究称CXCL9、CXCL10在哮喘和哮喘急性发作的炎症情况下可能发挥重要作用[5]。Damian Tworek等人收集健康人和过敏原刺激者的鼻灌洗液,ELISA法检测受试者CXCL9、CXCL10水平远高于健康人,哮喘儿童BALF中CXCL9、CXCL10浓度远高于对照组[6]。
趋化因子通过与相应的趋化因子受体结合后发挥作用,本实验结果显示哮喘小鼠肺组织表达增加2倍以上的趋化因子受体共13个,其中与其相应的配体趋化因子同时增高的有10个。Mizutani N[7]等人在IL-17A、IL-33联合作用的小鼠气道高反应和IgE介导的炎症模型中,发现CXCL1、CXCL5及其受体CXCR2表达增加,而CXCR2抗体抑制剂作用或消耗肺巨噬细胞能减弱中性粒细胞浸润和气道高反应性。K Tremblay[8]等人用基因芯片研究CX3CR1与哮喘疾病之间的关联,发现哮喘疾病患者CX3CR1表达增高,推论CX3CR1可作为哮喘疾病治疗的新的备选基因,如携带5个单核苷酸多态性的CX3CR1常见等位基因则有潜在易感染哮喘风险,故有人提出降低CX3CR1活性、抑制CX3CR1介导的免疫应答,使哮喘小鼠的炎症反应减轻,将其作为哮喘气道炎症治疗的靶点[9]。另外,在实验中还发现表达下调的细胞因子及趋化因子有4个,其在哮喘中的意义有待进一步研究。
[参考文献]
[1] Takeda M, Tanabe M, Ito W,et al.Gender difference in allergic airway remodelling and immunoglobulin production in mouse model of asthma[J].Respirology, 2013, 18(5): 797-806.
[2] 张云梅, 蔡勇, 张贵萍, 等. 过敏原皮肤点刺试验对小儿支气管哮喘诊断价值[J]. 遵义医学院学报, 2011, 34(1): 82-83.
[3] Schneider D, Hong J Y, Bowman E R, et al. Macrophage/epithelial cell CCL2 contributes to rhinovirus-induced hyperresponsiveness and inflammation in a mouse model of allergic airways disease[J]. Am J Physiol Lung Cell Mol Physiol,2013,304(3): L162-169.
[4] 李燕, 郭宇, 史小玲, 等. HSP70/CD80 DNA疫苗通过调节趋化因子及受体对哮喘小鼠气道炎症的影响[J]. 中华微生物学和免疫学杂志, 2013, 33(2): 123-126.
[5] Dajotoy T, Andersson P, Bjartell A, et al. Human eosinophils produce the T cell-attracting chemokines MIG and IP-10 upon stimulation with IFN-gamma[J]. J Leukoc Biol, 2004, 76(3):685-691.
[6] Tworek D, Kuna P, Mlynarski W, et al. MIG(CXCL9), IP-10(CXCL10)and I-TAC (CXCL11) concentrations after nasal allergen challenge in patients with allergic rhinitis[J]. Arch Med Sci, 2013, 9(5): 849-853.
[7] Mizutani N, Nabe T, Yoshino S.IL-17A Promotes the Exacerbation of IL-33-Induced Airway Hyperresponsiveness by Enhancing Neutrophilic Inflammation via CXCR2 Signaling in Mice[J]. J Immunol, 2014, 192(4):1372-1384.
[8] Tremblay K, Lemire M, Provost V, et al. Association study between the CX3CR1 gene and asthma[J]. Genes Immun, 2006, 7(8): 632-639.
[9] Doggrell S A. CX3CR1 as a target for airways inflammation[J]. Expert Opin Ther Targets, 2011, 15(9): 1139-1142.

