Cu2+在黑水虻体内迁移及对其发育影响
夏 嫱,朱 伟,廖 业,喻国辉,方 旭,杜联峰
(1.遵义医学院 珠海校区,广东 珠海 519041; 2.珠海市农业科学研究中心, 广东 珠海 519075)
为了增加畜禽的免疫力,提高经济效益,允许在饲料中添加适量的铜(Cu)。但是,我国许多省份饲料中Cu含量超标[1-3],Cu2+利用率极低,90%以上由粪便排出[4],造成粪便中Cu2+的大量累积。研究表明,猪粪中Cu2+含量最高可达2341.0 mg·kg-1[3],平均含量为642.1 mg·kg-1[5]。
利用黑水虻(Black soldier fly,HermetiaillucensL.)幼虫进行粪便无害化处理是解决我国日益严重的畜禽粪便污染及资源短缺问题的一条新途径。研究表明,黑水虻幼虫集中取食粪便,不仅可以减少粪便堆积,还可减少粪便中沙门氏菌及寄生虫虫卵数量[6]。其副产品不仅是优质饲料还可生产生物柴油[7]。但是,饲料中过量添加Zn2+会使其在黑水虻体内累积[8],并对其生长发育产生影响[9],饲料中过量添加Cu2+是否会产生相同影响,从而影响其无害化处理粪便的能力。
本文将不同浓度Cu2+加入黑水虻幼虫饲料中对其进行胁迫,研究Cu2+在黑水虻体内的迁移及对其发育影响,期待通过该研究为黑水虻无害化处理粪便的应用提供可靠的实验依据。
1 材料与方法
1.1 黑水虻 珠海市农业科学研究中心提供。
1.2 仪器与试剂 无机试剂为广州试剂一厂生产分析纯。等离子体原子发射光谱仪由美国Thermo Jarrell Ash Corporation生产。
1.3 黑水虻幼虫饲养及Cu2+胁迫处理 将黑水虻卵放于10 cm× 7 cm饲养盒中孵化,孵化条件为T:27 ± 3 ℃;RH:80 ±8%;L∶D=14∶10。孵化后向初孵幼虫投入Tomberlind等[10]筛选的人工饲料饲养至4日龄。将4 日龄黑水虻幼虫分别接入含Cu2+为75、150、300、600、1 200 mg·kg-1处理浓度人工饲料中饲养(Cu2+来源为CuSO4·5H2O),每个浓度3个重复,以不添加Cu2+饲料饲养黑水虻为对照(记为:0 mg·kg-1)。
1.4 黑水虻各发育阶段虫体Cu2+含量检测 选取长势均一各处理浓度下6龄幼虫(已停止取食)、蛹、成虫各5头,去离子水洗去虫体表面饲料,吸水纸吸干虫体表面水分,断头处死后放入规格为30 mm × 50 mm 称量瓶,参照夏嫱等(2008)[11]方法进行处理及消化,以不添加Cu2+饲料饲养黑水虻为对照。Cu2+含量=C×50/W(单位:mg·kg-1),其中C表示等离子体原子发射谱仪测得的数值;W表示样品的干质量。
1.5 Cu2+胁迫对黑水虻幼虫、蛹及成虫发育的影响 选取4日龄黑水虻幼虫各100头分别放于口径为10 cm×7 cm的饲养盒中,以添加不同浓度Cu2+饲料饲喂,参照夏嫱等(2013)[9]方法计算幼虫存活率、幼虫发育历期、化蛹率、蛹期、羽化率及成虫寿命;待95%蛹羽化后,辨别其雌雄计算其雌雄性比。每个处理3个重复,以不添加Cu2+饲料饲养黑水虻为对照。
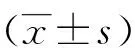
2 结果
2.1 黑水虻各发育阶段虫体Cu2+含量
注:图中不同小写字母表示Cu2+含量在各个处理间差异显著。图1 不同发育阶段虫体Cu2+含量
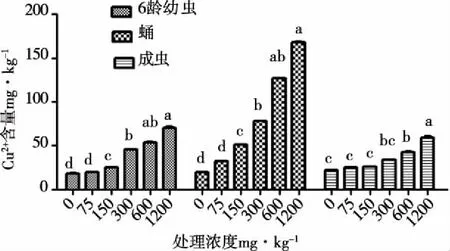
注:*表示P<0.05;**表示P<0.01(下同)。图2 Cu2+在不同发育阶段虫体内的迁移规律
如图1所示,黑水虻各发育阶段虫体Cu2+含量均随处理浓度增加而增加,至1200mg·kg-1时含量达到最高,且与对照及低浓度处理组相比差异显著(6龄幼虫:F=23.88,P<0.01;蛹:F=12.34,P<0.05;成虫:F=18.73,P<0.01);各发育阶段虫体Cu2+含量在75mg·kg-1处理浓度以下时均无显著差异(0 mg·kg-1:F=0.346,P>0.05;75 mg·kg-1:F=2.254,P>0.05),150mg·kg-1以上处理浓度蛹中Cu2+含量显著高于6龄幼虫及成虫(150mg·kg-1:F=11.03,P<0.01;300 mg·kg-1:F=5.594,P<0.05,600 mg·kg-1:F=6.916,P<0.01,1200 mg·kg-1:F=13.074,P<0.01),6龄幼虫与成虫相比Cu2+含量差异不显著,但6龄幼虫体内Cu2+含量略高于成虫体内Cu2+含量(见图2)。Cu2+在高浓度胁迫下各发育阶段的迁移规律为:蛹>6龄幼虫>成虫。
2.2 Cu2+对黑水虻发育的影响
2.2.1 Cu2+胁迫对黑水虻幼虫及蛹发育影响
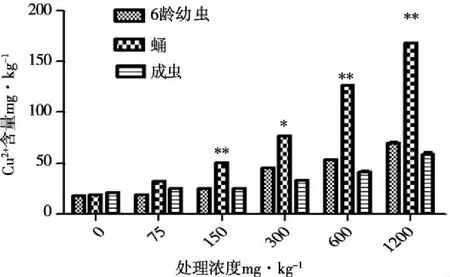
图3 Cu2+胁迫下黑水虻幼虫存活率、化蛹率及羽化率
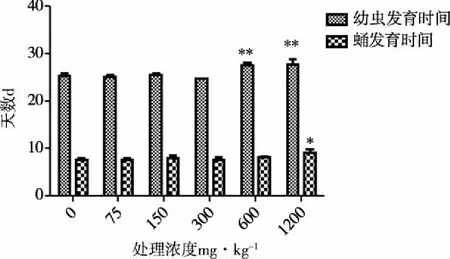
图4 Cu2+胁迫下黑水虻幼虫及蛹发育时间
由图3可知,不同浓度Cu2+胁迫对黑水虻幼虫存活率及化蛹率均无显著影响(幼虫存活率:F=0.836,P>0.05;化蛹率:F=2.566,P>0.05),但高浓度Cu2+胁迫可以显著影响蛹的羽化率,在600 mg·kg-1、1200 mg·kg-1处理浓度下与对照及其他处理组相比显著降低(F=4.616,P<0.05),1200 mg·kg-1处理浓度下羽化率仅为79.29±13.24%,但600 mm·kg-1及1 200 mg·kg-1处理组间差异不显著;处理浓度为600mg·kg-1以上时可显著延长幼虫发育所需时间(F=13.054,P<0.01),但两个高浓度处理组间差异不显著;蛹发育所需时间在1200mg·kg-1处理浓度下与对照及各处理组相比均显著延长(F=4.442,P<0.05)(见图4)。
2.2.2 Cu2+胁迫对黑水虻成虫发育影响 Cu2+胁迫对成虫寿命影响较小(见图5),各处理组与对照组相比均无显著差异(成虫寿命:F=0.717,P>0.05)。Cu2+胁迫对成虫雌雄性比亦无显著性影响(F=1.335,P>0.05)
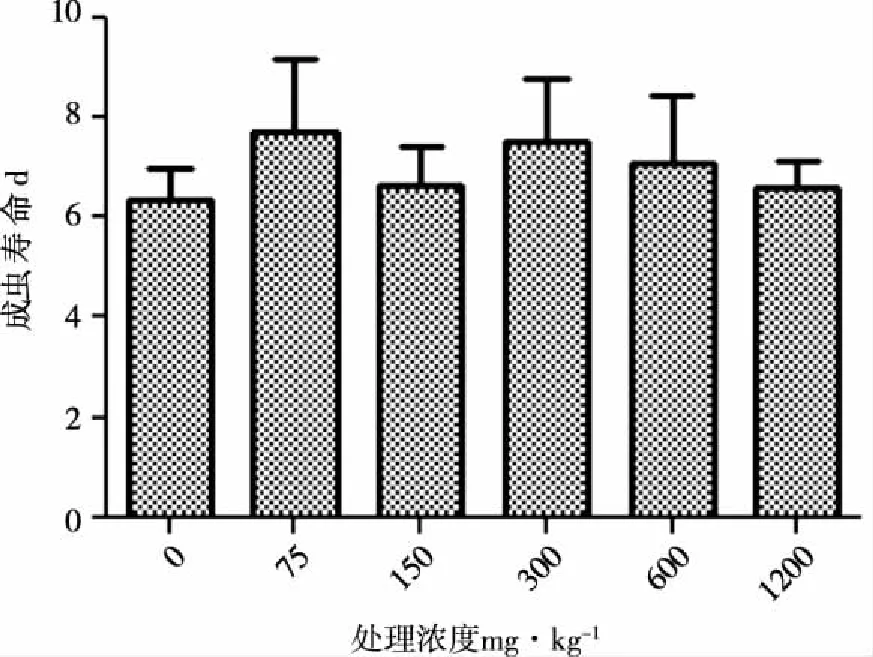
图5 Cu2+胁迫对成虫寿命影响
3 讨论
黑水虻幼虫取食含Cu2+饲料后,体内Cu2+含量与饲料中Cu2+浓度存在显著的剂量效应关系,随处理浓度增加Cu2+含量增高,过量的Cu2+可沿黑水虻不同发育阶段虫体进行迁移,Cu2+在蛹中累积量最多,与6龄幼虫及成虫体内Cu2+含量相比差异显著。这与有些昆虫体内重金属迁移规律略有不同,一般昆虫体内重金属迁移规律为幼虫大于蛹[12-13],这可能因为黑水虻生活习性与其他昆虫不同,黑水虻成虫期不进食[14],必需在蛹期积累大量脂肪并将其传给成虫,成虫才能完成生长发育及产卵活动。黑水虻发育至6龄幼虫时其中肠已基本退化且脂肪含量较少,发育至蛹期脂肪量才大幅度增加,因此,6龄幼虫Cu2+含量较蛹少,即使黑水虻为了有利于其交配和产卵羽化时蜕去一部分Cu2+[15],但是脂肪组织对重金属的累积量大于表皮[16],因此,蛹中Cu2+含量仍大于成虫。
重金属在昆虫体内大量累积可影响昆虫的生长发育,如增加幼虫的死亡率、降低化蛹率、羽化率及改变发育历期等[12,17-19]。Cu2+在黑水虻6龄幼虫体内累积量达到53.63±0.684 mg·kg-1时与对照相比可显著延长幼虫发育时间;蛹内Cu2+含量达到127.23±0.441 mg·kg-1时其羽化率与对照相比即有显著差异,Cu2+含量达到168.13±0.499 mg·kg-1即可显著延长其蛹期发育时间。幼虫存活率、化蛹率、成虫寿命及雌雄性比在各个处理浓度与对照相比均无显著差异,无差异的原因可能由于胁迫时间较短仅一个世代,短期胁迫可能忽略了Cu2+的毒性效应,Cu2+对黑水虻的影响还未完全体现出来,长时间胁迫是否会对其产生影响,是否会对黑水虻无害化处理粪便技术的应用产生影响,还需进一步研究。
[参考文献]
[1] 姚丽贤,黄连喜,蒋宗勇, 等. 动物饲料中砷、铜和锌调查及分析[J]. 环境科学, 2013, 34(2): 732-739.
[2] 姜萍, 盛杨, 郝秀珍, 等. 重金属在猪饲料一粪便一土壤一蔬菜中的分布特征研究[J]. 农业环境科学学报, 2010, 29(5): 942-947.
[3] 黄玉溢, 陈桂芬, 刘斌, 等. 广西集约化养殖猪饲料Cu和Zn含量及粪便Cu和Zn残留特性研究[J]. 安徽农业科学, 2012, 40(17): 9280-9281, 9284.
[4] 郑孝成, 钱仲仓, 杨泉灿. 规模化养猪场周边土壤重金属污染及防控[J]. 上海畜牧兽医通讯, 2013, (2): 58-59.
[5] Zang F S, Li Y X, Yang M, et al. Copper residue in animal manures and the potential pollution risk in northeast china[J].Journal of Resources and Ecology, 2011, 2(1):91-96.
[6] Cecilia L, Stefan D, Maria E M, et al. Faecal sludge management with the larvae of the black soldier fly (Hermetiaillucens) -From a hygiene aspect[J]. Science of the Total Environment, 2013, 458-460:312-318.
[7] Zheng L Y, Li Q, Zhang J B, et al. Double the biodiesel yield: Rearing black soldier fly larvae,Hermetiaillucens, on solid residual fraction of restaurant waste after grease extraction for biodiesel production [J]. Renewable Energy, 2012, 1(41):75-79.
[8] 夏嫱, 廖业, 朱伟, 等. Zn2+在不同世代黑水虻体内累积及分布规律[J]. 湖南科技大学学报, 2013, 28(2): 110-114.
[9] 夏嫱, 但家立, 朱伟, 等. Zn2+胁迫对黑水虻生长发育的影响[J]. 环境昆虫学报, 2013, 35(3): 294-299.
[10] Tomberiin J K, Sheppard D C, Joyce J A. Selected life- history traits of black soldier flies (Diptera: stratiomyidae) reared on three artificial diets [J]. Arthropod Biology, 2002, 95(3): 379-386.
[11] 夏嫱, 舒迎花, 胡新军, 等. 斜纹夜蛾幼虫不同组织对Zn2+积累作用的比较研究[J]. 中山大学学报, 2008, 47(3): 89-93.
[12] 孙虹霞,舒迎花,唐文成,等.重金属Ni 2+连续胁迫导致其在斜纹夜蛾体内积累并降低存活率[J].科学通报,2007,52(12):1413-1418.
[13] 吴国星, 朱家颖, 高熹, 等. 重金属镉与铜在棕尾别麻蝇体内的积累和排泄研究[J]. 环境昆虫学报, 2010, 32(3) : 347-352.
[14] Li Q, Zheng L Y, Qiu N, et al. Bioconversion of dairy manure by black soldier fly (Diptera: Stratiomyidae) for biodiesel and sugar production[J]. Waste Management, 2011, 31(6):1316-1320.
[15] Niu C Y, Jiang Y, Lei C L, et al. Effects of cadmium on housefly: influence on growth and development and metabolism during metamorphosis of housefly[J]. Entomologia Sinica, 2002, 9(1): 27-33.
[16] 孙虹霞, 夏嫱, 周强, 等.斜纹夜蛾幼虫对食物中重金属Ni2+的积累与排泄[J]. 昆虫学报, 2008, 51(6): 569-574.
[17] 高熹, 朱家颖, 吴国星, 等. 幼虫期染镉对棕尾别麻蝇繁殖力及生殖腺发育的影响[J]. 环境昆虫学报, 2011, 33(1) : 24-29.
[18] Laskowski R. Why short-term bioassays are not meaningful--Effects of a pesticied (Imidacloprid) and a metal (cadmium) on pea aphid (AcyrthosiphonpisumHarris) [J]. Ecotoxicology, 2001, 10(3): 177-183.
[19] Nursita A I, Balwant S, Lees E. The effect of cadmium, copper, lead, and zinc on the growth and reproduction ofPriosotomaminutaTullberg (Collembola) [J]. Ecotoxicol Environ Saf, 2005, 60(3):306-314.

