大黄素联合3′-叠氮-3′-脱氧胸腺核苷对人肝癌HepG2细胞增殖的协同抑制作用
原凌燕,陈 彻,刘 玉,楚慧媛
(甘肃中医学院,甘肃 兰州 730000)
大黄素(Emodin)是从大黄属、鼠李属、蓼属植物和番泻叶等中分离出来的主要成分,其化学名为1,3,8-三羟基-6甲基蒽醌,具有抗菌消炎、抗肿瘤、免疫抑制、保肝、促进胃肠平滑肌运动等作用[1-2],由于许多肿瘤细胞对化疗药已不敏感而对大黄素还存在一定的敏感度,这就为抗肿瘤治疗提供了新的前景 。但体外研究也显示较大剂量的大黄素能导致近曲小管的损伤,具有潜在的肾脏毒性。筛选适当抗肿瘤药物与大黄素联合是肿瘤治疗的策略之一。
3′-叠氮-3′-脱氧胸腺核苷(Azidothymidine,AZT)是一种端粒酶抑制剂,为胸苷类似物,是重要的艾滋病治疗药物。近年来,由于具有对端粒酶的竞争性抑制作用,AZT针对肿瘤的研究也引起了研究人员的广泛关注。实验证据显示AZT对多种肿瘤具有良好的抑制作用[3-5],但由于治疗时所需剂量较大,由此产生的毒副作用也严重限制了AZT在临床抗肿瘤领域的进一步应用。近期的研究发现,AZT是较为突出的抗肿瘤协同剂,在安全剂量范围与其它药物联合应用时对实体肿瘤具有明显的协同治疗作用[6]。
通过联合用药达到增效减毒目的是肿瘤研究中极富研究价值的课题。大黄素和AZT联合用药是否在人肝癌细胞HepG2细胞的增殖抑制和诱导凋亡方面存在协同作用,目前尚无相关报道。本研究旨在观察大黄素联合AZT对HepG2细胞的增殖抑制作用和对细胞凋亡的影响,为进一步探讨大黄素和AZT的临床抗肿瘤应用提供实验依据。
1 材料与方法
1.1 细胞 人肝癌细胞株HepG2,由甘肃中医学院分子生物学实验室保存。
1.2 主要试剂和药品 大黄素(纯度大于98%)购于甘肃鹏程生物科技发展有限公司, AZT、MTT、DMSO均购自美国Sigma公司, DMEM购自美国GibcoBRL公司,胎牛血清购于美国Hyclone公司, Annexin V-FITC/PI凋亡检测试剂盒购自南京凯基生物有限公司。
1.3 方法
1.3.1 MTT比色法观察对细胞生长的影响 大黄素用DMSO溶解(DMSO终浓度<0.1%),AZT在PBS溶解后用DMEM稀释到所需浓度。大黄素终浓度依次为1、2、4、8和16μmol/L,AZT终浓度依次为2.5、5、10、20和40 μmol/L。
MTT照以下步骤进行:培养HepG2细胞,取对数生长期的细胞用0.25%胰蛋白酶消化计数后,含10%胎牛血清的DMEM培养基将细胞悬浮,调整细胞密度为5×104/mL, 在96孔板中, 每孔加90 μL细胞悬液。实验设药物实验组(大黄素单用组、AZT单用组、大黄素/AZT联合用药组)和对照组。5% CO2培养箱中培养12 h后,药物实验组每孔依次加入10 μL上述所需浓度药液,使大黄素单用组大黄素终浓度依次为1、2、4、8和16 μmol/L;AZT单用组AZT终浓度依次为2.5、5、10、20和40 μmol/L;大黄素/AZT联合用药组大黄素/AZT终浓度依次为1/2.5、2/5、4/10、8/20和16/40 μmol/L。对照组加等量的DMEM培养液,每种剂量设6个复孔,重复3次,分别培养24、48、72 h后, 加入5 mg/mL的MTT 5 μL,作用4 h,吸去培养液, 加入100 μL DMSO,置摇床上低速振荡10 min,使结晶物充分溶解,全自动酶标仪570nm波长下检测各孔的吸光度值(OD值), 按公式计算细胞增殖抑制率(inhibition rate,IR),并以每个实验组与实验对照组比较,单药组与联合用药组分别比较。
IR(%)=(1-实验组OD值/对照组OD值)×100% 。
1.3.2 药物协同作用分析 CalcuSyn2.0软件(Biosoft,USA) 计算不同浓度的大黄素和AZT以固定比例组合(大黄素浓度∶AZT浓度=1∶2.5)的药物半数抑制浓度(IC50)和联合用药指数(combination index,CI)。CI<1表示协同, CI>1表示拮抗,CI=1表示相加。
1.3.3 Annexin V /PI双染法检测细胞凋亡 取指数生长期的HepG2,制成单细胞悬液,调整细胞密度为5×104/mL,在6孔板中,每孔加2.0 mL细胞悬液。5% CO2培养箱中培养12 h细胞贴壁后,药物试验组每孔分别加入大黄素:终浓度为4 μmol/L;AZT:终浓度10 μmol/L;大黄素+AZT:终浓度4 μmol/L大黄素+10 μmol/L AZT,对照组加等量的DMEM培养液,(加药时72 h组先加药,48 h组后加药,24 h后3个时间段的细胞可同时收集)。实验设药物实验组和对照组。对照组加等量的DMEM培养液,按照每孔5×105个细胞铺6孔板,贴壁过夜后每孔加入2.0 mL培养液在37 ℃、5% CO2培养箱分别培养24、48、72 h后离心收集细胞,用PBS洗涤2次,按试剂盒说明重悬细胞,分别加入5 μL 的Annexin V-FITC和PI,4 ℃避光30 min,上流式细胞仪检测。
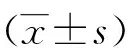
2 结果
2.1 大黄素、AZT及联合用药对HepG2细胞的增殖抑制作用 实验结果显示,不同浓度大黄素、AZT以及相应浓度的联合用药作用于HepG2细胞24、48、72 h后对照组细胞生长状态良好,细胞膜清晰,细胞核完整,细胞间结构紧密;给药组中,细胞的增殖缓慢并呈现不同程度的损伤,细胞逐渐变圆,附壁疏松,脱壁,细胞内出现空泡,细胞周围碎片增多,联合给药组细胞损伤表现较单药组更明显。大黄素、AZT及其联合对HepG2细胞的增殖抑制作用结果如图1所示,单药给药组中,随大黄素和AZT浓度的增加,细胞增殖抑制作用增强,呈剂量依赖性;随时间的延长,大黄素和AZT对HepG2细胞的增殖抑制作用增强,呈时间依赖性。大黄素和AZT联合作用HepG2细胞的增殖抑制作用结果显示,随合用药物浓度的增加和作用时间的延长,对肿瘤细胞的增殖抑制作用显著增强,呈时间和浓度依赖性。系列浓度的大黄素和AZT联合作用于HepG2细胞24、48、72 h,对HepG2细胞的增殖抑制率分别与相应浓度的AZT或大黄素单用作用HepG2细胞相同时间相比,对细胞的增殖抑制率均明显升高,差异有统计学意义(除大黄素/AZT 1.0/2.5 μM作用24 h,P<0.05外,其他浓度时间情况P<0.01)。
注:以系列浓度的大黄素、AZT及其联合作用于HepG2细胞24、48、72 h,对由MTT法得到的联合用药对HepG2细胞的增殖抑制率分别与大黄素或AZT单用加以比较,a:P<0.05, b: P<0.01。图1 大黄素、AZT及其联合对HepG2细胞的增殖抑制作用
2.2 大黄素和AZT作用HepG2细胞的联合作用指数(CI) 固定比率的大黄素和AZT联合作用于HepG2细胞24、48、72 h的IR和由此通过CalcuSyn 2.0软件计算所得的不同浓度和作用时间大黄素和AZT的联合作用指数(见表1),CI值均小于1,表明大黄素和AZT联合应用对人肝癌细胞株HepG2在3个作用时间和所考察的药物浓度的联合用药都表现为协同作用,而且在作用时间达到48 h以后,CI值均小于0.4,提示大黄素和AZT的联合随着作用HepG2细胞时间的增加,增殖抑制的协同效应逐渐加强。
2.3 大黄素和AZT及联合应用的剂量-抑制效应 利用试验所检测的浓度和IR数据,经由CalcuSyn 2.0软件推算和模拟出了大黄素和AZT以固定浓度比率(1∶2.5)作用HepG2细胞的剂量-抑制效应,表2展示了大黄素、AZT及其联合对HepG2细胞的半数抑制浓度IC50。结果发现大黄素或AZT单药作用HepG2细胞后24、48、72 h时,大黄素和AZT的 IC50分别远高于试验中所用最高浓度16、40 μmol/L;联合用药使大黄素和AZT 对HepG2细胞达到一定增殖抑制效果所需的浓度显著下降,联合作用72h的IC50为2.34 /5.86 μmol/L。
表1大黄素和AZT联合作用HepG2细胞不同时间的IR及联合作用指数
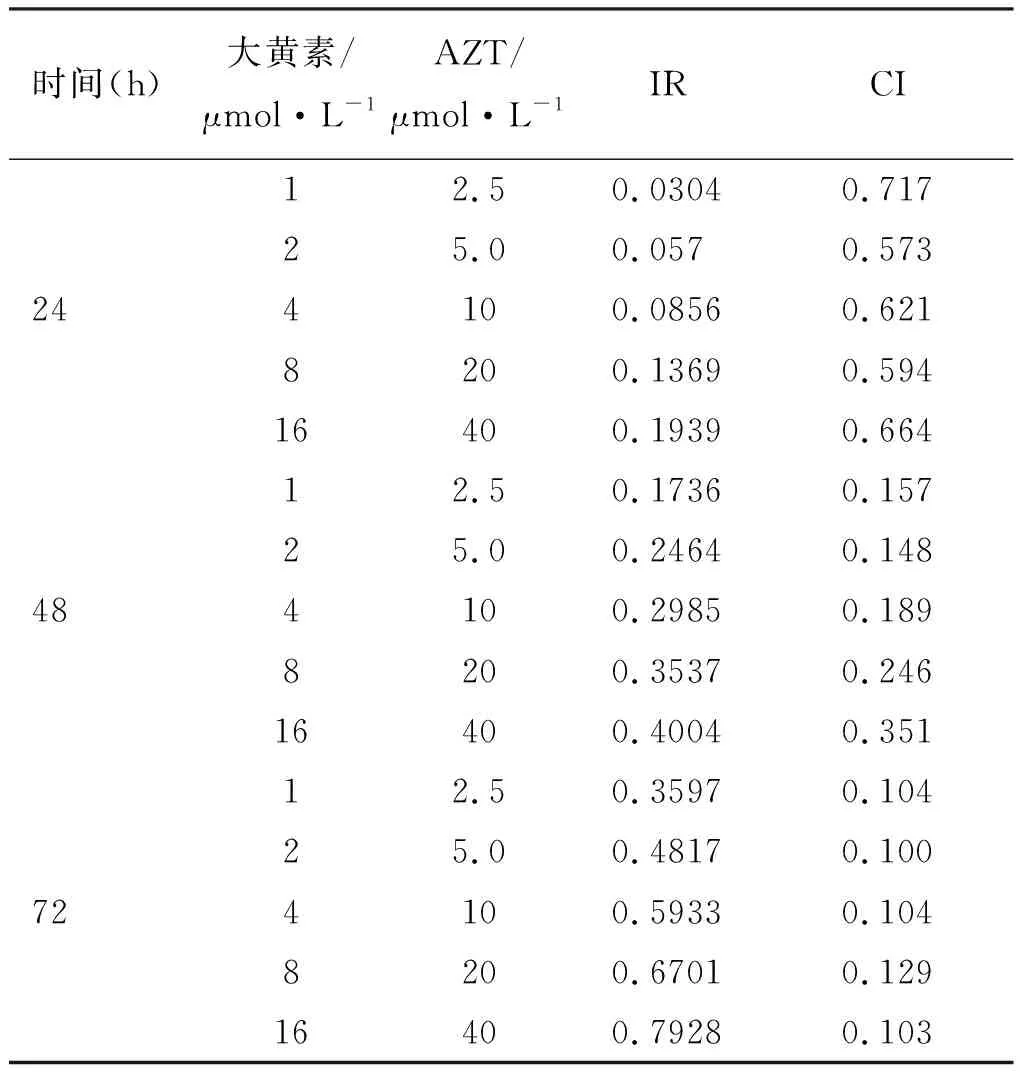
时间(h)大黄素/μmol·L-1AZT/μmol·L-1IRCI12.50.03040.71725.00.0570.573244100.08560.6218200.13690.59416400.19390.66412.50.17360.15725.00.24640.148484100.29850.1898200.35370.24616400.40040.35112.50.35970.10425.00.48170.100724100.59330.1048200.67010.12916400.79280.103
表2大黄素、AZT及其联合对HepG2细胞的半数抑制浓度

实验药物IC50 /μmol·-124h48h72h大黄素398.70312.15216.48AZT794.91316.8261.67大黄素+AZT105.68/264.2137.02/92.54072.34/5.86
2.4 Annexin V /PI双染法检测细胞凋亡 FCM检测结果显示,各组药物作用HepG2细胞24 h后,大黄素、AZT和二者联合给药组细胞凋亡率分别为1.87%、9.59%、23.10%,对照组正常生长的HepG2细胞仅为0.26%;随着作用时间增加,调亡率逐渐升高, 48h对照组、单药大黄素、单药AZT和联用药物组凋亡率分别为0.68%、3.43%、25.02%、40.43%;到72 h上述4组凋亡率差异更为明显,联合用药的凋亡率达到51.86%。图2所示为各组药物作用HepG2细胞72 h的凋亡比率。结果表明,大黄素与AZT联用较大黄素或AZT单用均有更显著的促凋亡作用。
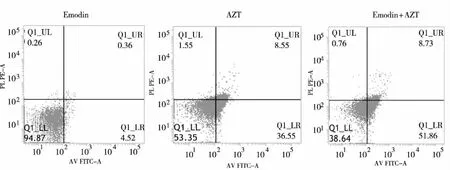
图2 药物作用HepG2细胞72 h 的凋亡比率
3 讨论
在肝癌的药物治疗中,细胞毒性药物的作用有限,这也是肝癌复发转移和耐药的难点所在[7]。由于中药具有通过多靶点、多途径、多环节发挥作用及不易产生耐药等优势,中药抗肿瘤的有效成分及作用机理研究已成为目前国内外研究的热点[8-9]。另外,根据抗肿瘤药不同的作用机制和肿瘤细胞增殖动力学进行合理联合用药,使其增效减毒及避免耐药是目前肿瘤治疗研究中的重要进展之一。而应用端粒酶抑制剂联合小分子中药单体成分如蒽醌类、喹啉类和小檗碱及其类似物等已经成为近年来抗肿瘤药物研究的重要方向之一。本研究考察了大黄素与AZT对HepG2细胞的增殖抑制作用,结果显示,大黄素或AZT单用对HepG2细胞增殖抑制作用均呈现明显的药物浓度和药物作用时间依赖性,两种药物联合对HepG2细胞的增殖抑制作用明显优于单独给药, 细胞凋亡检测结果也表明,大黄素与AZT联用较大黄素或AZT单用均有更显著的促凋亡作用,说明大黄素联合AZT对HepG2细胞的增殖抑制和凋亡诱导存在协同效应。
大黄素作为具有化疗辅助作用的中药单体成分,能抑制胰腺癌、前列腺癌、大肠癌等多种恶性肿瘤细胞生长。同时,大黄素能显著增强三氧化二砷[10]、5-氟尿嘧啶[11]、铂类[12]、紫杉醇[13]、吉西他滨[14]和姜黄素[15]等药物在多种肿瘤细胞中的药物敏感性,发挥协同作用。在我们研究的浓度范围,大黄素单独给药对HepG2细胞的增殖抑制和凋亡诱导作用均较单用AZT弱,但大黄素与AZT联合后,对HepG2细胞的增殖却表现出明显的协同抑制作用,通过Calcusyn2.0软件计算的两药协同作用指数,在所研究的药物浓度和作用时间均小于1,表明两药有较好的协同作用;而且药物协同作用随作用时间延长表现得更为显著,48和72 h均表现为强协同作用(0.6≤CI≤ 0.8为中度协同作用,0.4≤CI≤0.6为高度协同作用,0.2≤CI≤0.4为强协同作用)。研究中所发现的协同效应与有关的研究结果相似[16-18]。
该研究证明了体外大黄素和AZT联合用药时对HepG2的增殖抑制具有协同作用,与单独用药相比,联合用药时较低剂量就可以产生单用较大剂量药物时的增殖抑制和凋亡诱导效果,提示这两种药物可能作用于HepG2细胞不同增殖阶段或靶点而发挥增殖抑制作用。研究结果表明这两种药物的较低浓度的联合即具有减少毒副作用并显著提高治疗效果的双重作用,结果支持在HepG2的治疗研究和应用中,可选用低而无毒副作用的大黄素和AZT剂量(最高剂量均未达到IC50)的联合方案。通过大黄素联合端粒酶抑制剂治疗肝癌,借助联合用药的协同效应,则可以通过适当增加药物的剂量以增强疗效而将毒性反应控制在可以接受的范围之内,或在维持原疗效水平的同时减低毒性药物的用量。因此,大黄素与AZT联合应用于肝癌的治疗可能是一种相对比较安全的用药方案,本研究为探索新的肝癌治疗方法提供了一定的实验依据。两药联合抑制人肝癌HepG2细胞增殖的机制还有待研究,而且体外细胞研究的结果尚需通过进一步的体内试验验证。
[参考文献]
[1] Hazni H, Ahmad N, Hitotsuyanagi Y, et al. Phytochemical constituents from Cassia alata with inhibition against methicillin-resistant Staphylococcus aureus (MRSA) [J]. Planta Medica, 2008, 74(15): 1802-1805.
[2] 喻安永,潘勇,罗云霞,等. 大黄对多发伤兔急性肺损伤模型的保护作用[J]. 遵义医学院学报, 2013, 36(4): 294-297.
[3] 靳蕊蕊, 晁荣, 席亚明, 等. AZT 对白血病细胞株 KG-1a 细胞增殖和端粒酶活性的影响[J]. 中国实验血液学杂志, 2012,20 (2): 277-281.
[4] 何敏, 蒋玉艳, 朱淼, 等. AZT 对肝癌细胞端粒酶活性及相关蛋白表达的影响[J]. 癌症, 2006, 25(5): 543-548.
[5] 王伟, 刘俊平. 端粒酶与肿瘤[J]. 世界华人消化杂志, 2002, 10(6): 683-688.
[6] Sun Y, Guo T, Xi Y, et al. Effects of AZT and RNA-protein complex (FA-2-b-beta) extracted from Liang Jin mushroom on apoptosis of gastric cancer cells [J]. World J Gastroentero,2007,13(31):4185-4191.
[7] 孙越鹏,耿磊,李长福,等. SiRNA沉默HBx表达对HepG2.2.15细胞增殖和凋亡的影响[J]. 遵义医学院学报, 2013, 36(4): 301-305.
[8] 郭辰睿,李宁. 康艾注射液联合培美曲塞二线治疗非鳞状非小细胞肺癌54例疗效观察[J]. 遵义医学院学报, 2013, 36(6): 568-570.
[9] 邹品文,赵春景,李攀,等. 黄芪多糖抗S180肉瘤作用及其免疫调节的影响[J]. 遵义医学院学报, 2012, 35(1): 17-20.
[10] Yang J, Li H, Chen Y, et al. Anthraquinones sensitize tumor cells to arsenic cytotoxicity in vitro and in vivo via reactive oxygen species-mediated dual regulation of apoptosis.[J]. Free Radic Biol Med, 2004, 37(12): 2027-2041.
[11] 尚闯, 庞志刚, 刘超, 等. 大黄素与奥沙利铂联合应用对人肝癌细胞增殖及凋亡的影响[J]. 河南外科学杂志, 2012, 18(3): 78-78.
[12] Wang W, Sun Y, Huang X, et al. Emodin enhances sensitivity of gallbladder cancer cells to platinum drugs via glutathion depletion and MRP1 downregulation [J]. Biochem Pharmacol,2010, 79(8): 1134-1140.
[13] Li J, Liu P, Mao H, et al. Emodin sensitizes paclitaxel-resistant human ovarian cancer cells to paclitaxel-induced apoptosisinvitro[J]. Oncol Rep,2009,21(6):1605-1610.
[14] 曾勇, 刘岸, 童洪飞, 等. 大黄素联合吉西他滨对体外人胰腺癌细胞株 BxPC-3 生长及凋亡的影响[J]. 中国中西医结合杂志, 2011, 31(4): 552-554.
[15] 雷湘,李娟,陈科力,等.大黄素与姜黄素联用对肝癌细胞BEL-7402生长抑制的协同作用[J].中国医院药学杂志,2009, 29(12): 971-973.
[16] 方丽, 周进. 大黄素与顺铂联用抗人肝癌细胞株 HepG2 增殖和凋亡的研究[J]. 四川医学, 2008, 29(8): 963-964.
[17] 刘剑波, 高学岗, 连涛, 等. 大黄素在体外诱导人肝癌细胞 HepG2 发生凋亡的初步研究[J]. 癌症: 英文版, 2003, 22(12): 1280-1283.
[18] Chen C, Zhang Y, Wang Y, et al. Synergistic effect of 3’-Azido-3’-deoxythymidine and As2O3on human hepatoma cell lines HepG2 [J]. Anti-Cancer Drugs, 2011, 22(5): 435-441.

