人结直肠癌耐奥沙利铂细胞株的建立及特性
文坤明,傅仲学
(1.遵义医学院附属医院 胃肠外科,贵州 遵义 563099;2.重庆医科大学第一附属医院 胃肠外科,重庆 400016)
第3代铂类制剂奥沙利铂与5-FU和亚叶酸钙联合应用的FOLFOX化疗方案使得转移性结直肠癌的有效率超过50%,但仍有约40%的病例对FOLFOX方案无反应,出现耐药[1]。目前,通过建立耐药细胞株来研究肿瘤耐药的机制及其对抗或逆转耐药策略成为目前研究热点。在本实验中我们建立了一种结直肠癌耐奥沙利铂细胞株,检测了它的多药耐药特性及其可能机制。
1 材料与方法
1.1 材料 人结直肠癌细胞株SW480购自中国科学院上海细胞库;胎牛血清(FBS)购自美国HyClone公司;Leibovitz’L-15培养基购自北京迈晨公司;RNA提取试剂盒购自北京天根公司;逆转录试剂盒、SYBR TAQ Real time试剂盒购自大连宝生物公司;全蛋白提取试剂盒购自南京凯基生物有限公司;兔抗人Oct4、Survivin一抗购自美国Eptomics公司;鼠抗人P-pg一抗购自美国Santa-Cruz公司,鼠抗人β-actin一抗及山羊抗兔二抗购自北京中杉金桥公司;奥沙利铂购自美国Sigma公司;WST-1购自瑞士Roche公司。
1.2 耐药细胞株的建立方法 SW480细胞株在含10%FBS的L-15培养基中培养。为建立稳定的耐药细胞株,在该细胞的培养液中持续加入Oxa、并将其浓度由低至高逐渐提高。起始Oxa浓度为0.1 μmol/L,待存活细胞增殖、细胞融合度达80%左右后予传代,传3代后增加Oxa浓度(后同),经过提高其浓度为0.5 μmol/L及1.0 μmol/L后,最终达临床相关血药浓度2.0 μmol/L时,传5代以上后用于后续实验,所有实验至少重复3次。由SW480细胞株最终所建立的稳定的耐Oxa细胞株用“SW480/OxR”来表示。
1.3 细胞增殖活力检测 采用细胞增殖试剂WST-1检测细胞增殖能力。按照我们之前报道的方法[2],将耐药细胞及亲本细胞分别暴露于含2 μmol/L的Oxa及2 μg/L的5-FU培养液中(每组设5个复孔),分别在24、48、72 h后加入细胞增殖试剂WST-1,用酶标仪在570 nm波长下测定各组细胞平均吸光度值(A值),以该A值反映细胞增殖能力并鉴定SW480/OxR细胞的耐药性。
1.4 实时荧光定量PCR(RT-qPCR)检测mRNA表达 用细胞RNA提取试剂盒提取各组细胞的RNA,并将其逆转录成cDNA,SYBR Green染料法进行实时定量PCR反应,采用25 μL体系扩增,反应条件为:95 ℃预变性30 s,然后为95 ℃5 s、59 ℃30 s,共40个循环,最后65 ℃5 s、95 ℃5 min,进行熔解曲线检测。每次检测设立3个复孔,重复3次以上。采用2-ΔΔCt方法计算目的基因表达的相对水平,内参为GAPDH。相关引物序列(见表1)。
表1 RT-qPCR引物序列
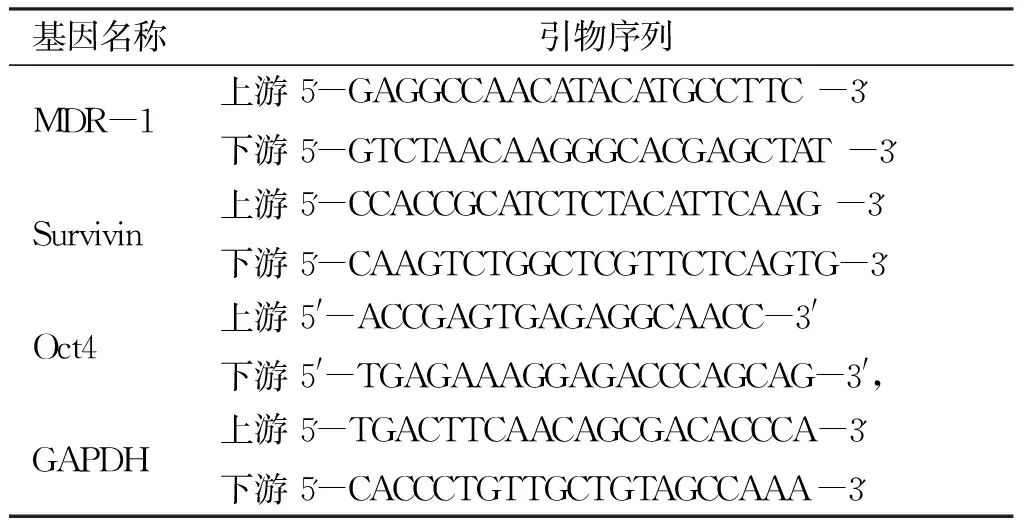
基因名称引物序列MDR-1上游 5'-GAGGCCAACATACATGCCTTC-3'下游 5'-GTCTAACAAGGGCACGAGCTAT-3'Survivin上游 5'-CCACCGCATCTCTACATTCAAG-3'下游 5'-CAAGTCTGGCTCGTTCTCAGTG-3'Oct4上游 5'-ACCGAGTGAGAGGCAACC-3'下游 5'-TGAGAAAGGAGACCCAGCAG-3',GAPDH上游 5'-TGACTTCAACAGCGACACCCA-3'下游 5'-CACCCTGTTGCTGTAGCCAAA-3'
1.5 流式细胞技术检测P-gp、Survivin蛋白表达 0.25%胰酶消化收集细胞,每个检测样本细胞数量约为0.5×106,2%多聚甲醛固定30 min,PBS洗涤后用含3%山羊血清蛋白液室温封闭1 h,PBS洗涤后按1∶50及1∶100稀释比例分别加入P-gp、Survivin一抗稀释液100 μL,4 ℃过夜孵育,用1 mLPBS洗涤2次以去除残留一抗,用100 μLPBS重悬细胞,分别加入FITC标记的抗鼠二抗(稀释比例为1∶50)及DyLight549标记的抗兔二抗(稀释比例为1∶200)室温避光孵育30 min,PBS洗涤后用100 μLPBS重悬细胞,送流式细胞仪检测。
1.6 Western blot检测Oct4蛋白水平 采用全蛋白提取试剂盒提取各组细胞蛋白,-80 ℃冻存备用。采用10 %的SDS-PAGE胶分离相应蛋白,采用湿法转膜45 min,5%脱脂奶粉封闭1 h后加入1∶1000稀释的兔抗人Oct4一抗,4 ℃孵育过夜,次日PBS洗膜后加入稀释比例为1∶5000的山羊抗兔二抗,室温孵育1 h,PBS洗膜后行ECL发光。选用β-actin蛋白为内参蛋白对照,采用Quantity-One软件对条带的吸光度值进行半定量分析,Oct4蛋白的相对量用Oct4蛋白条带的吸光度值/β-actin蛋白条带的吸光度值表示。
2 结果
2.1 耐药细胞及亲本细胞形态比较取指数生长期的细胞于倒置荧光显微镜下照相。由图1可见,聚集成团生长的SW480细胞间距较小,散在生长细胞形态似三角形,而SW480/OxR细胞之间距离增大,散在生长的细胞三角形减少,长条形细胞增多。
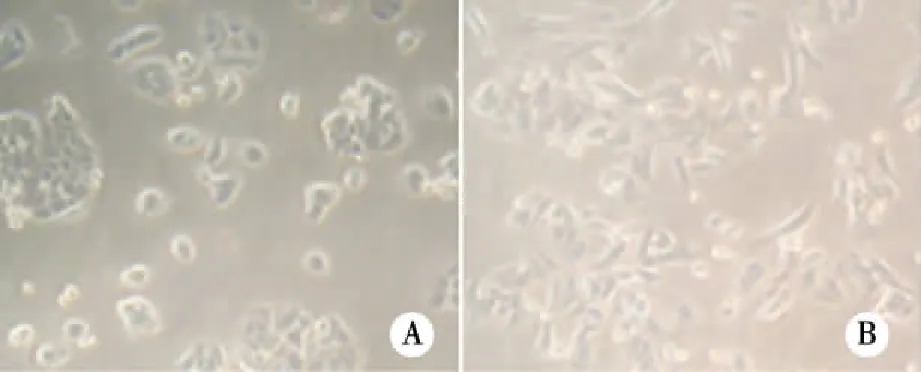
注:A:SW480;B:SW480/OxR。 图1 耐药细胞及亲本细胞镜下形态(×200)
2.2 化疗敏感性检测结果 采用细胞增殖试剂WST-1检测细胞增殖情况结果提示:①SW480细胞对Oxa及5-FU均敏感,与未用化疗药物处理的细胞比较,随着时间推移,加药后细胞数量均逐渐减少。到加入Oxa及5-FU后72 h时,SW480细胞存活细胞百分比分别为(48%±7%)及(52%±6%),与未加化疗药物的对照组(Con)比较,差异有统计学意义(P<0.01,见图2);②SW480/OxR细胞不仅与期望的结果一致,对Oxa耐药,还对5-FU也发生耐药,到加药后72 h时,仍有超过95%的细胞存活,与未加化疗药物的对照组(Con)比较,差异无统计学意义(P>0.05,见图3),提示SW480/OxR细胞具有多药耐药的特性。
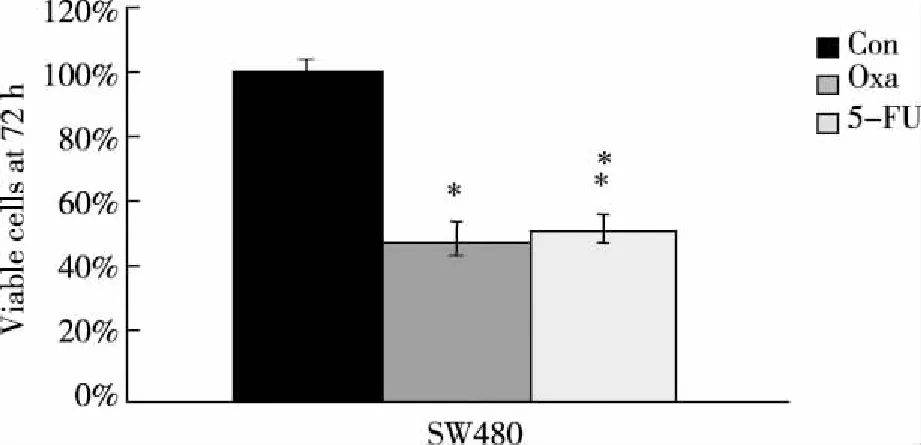
图2 SW480细胞加药72 h后存活细胞百分比

图3 SW480/OxR细胞加药72 h后存活细胞百分比
2.3 mRNA表达水平检测结果 实时荧光定量PCR(RT-qPCR)检测mRNA结果如图4所示,SW480/OxR细胞与SW480细胞比较,MDR-1mRNA增高约6倍(P<0.01),Survivin-mRNA增高约4倍(P<0.01),Oct4-mRNA增高约10倍(P<0.01)。
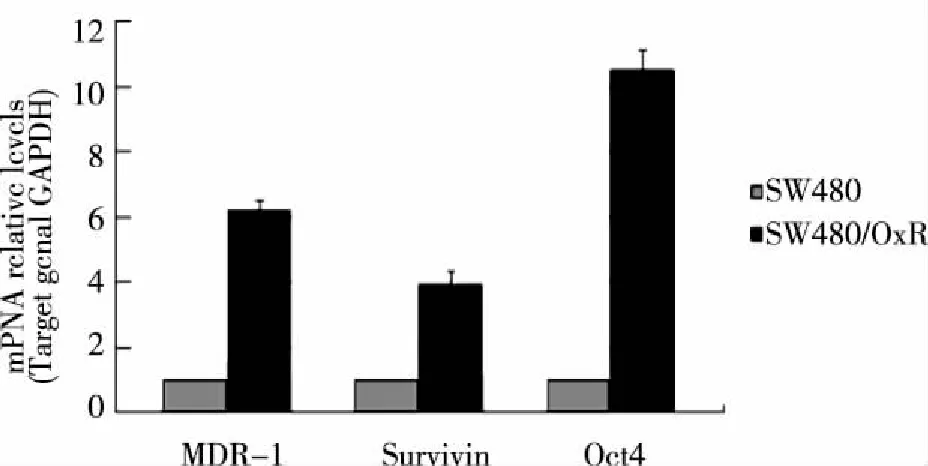
注:*:P<0.01。图4 RT-qPCR检测耐药细胞及亲本细胞MDR-1、Survivin及Oct4mRNA水平
2.4 P-gp+及Survivin+细胞比例 流式细胞技术间接法检测结果提示,SW480细胞P-gp+及Survivin+细胞百分率分别为(4.08%±1.62%)及(27.53±2.29%),而耐药SW480/OxR细胞两个蛋白阳性细胞百分率分别增加致(41.62%±4.76%)及(91.87%±5.89%),与亲本细胞比较,P<0.01。图5为其中一次检测结果。
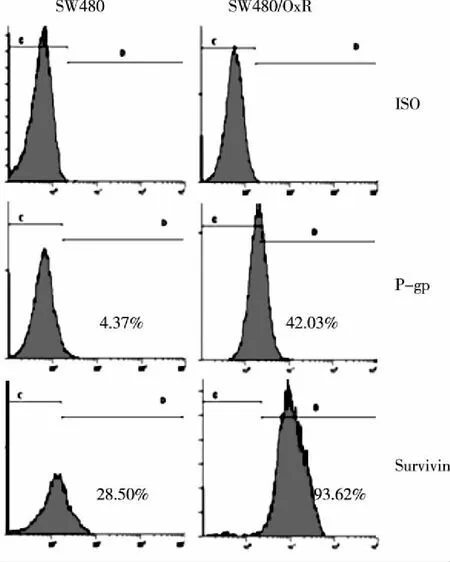
注:流式细胞技术检测耐药细胞与亲本细胞P-gp+及Survivin+细胞百分率(非RT-qPCR)。图5 RT-qPCR检测耐药细胞与亲本细胞P-gp+及Survivin+细胞百分率
2.5 Oct4蛋白表达情况 Western blot检测结果显示,SW480细胞表达Oct4蛋白的相对量为(0.05±0.012),而耐药细胞则增加至(0.27±0.038),二者差异具有统计学意义(P<0.01)。图6为其中一次检测结果。

注:A:SW480/OxR;B:SW480。图6 Western blot检测耐药细胞及亲本细胞Oct4蛋白表达
3 讨论
结直肠癌是发病率及死亡率均较高的恶性肿瘤[3],手术和化疗是其主要的治疗方法。但即使对结直肠癌患者实施了标准的手术及化疗,仍有近50%的患者出现复发及转移[4]。对化疗药物多药耐药(MDR)可能是结直肠癌治疗失败的主要原因之一,关于MDR的原因及机制研究是目前恶性肿瘤研究的热点。
耐药细胞株的建立为研究恶性肿瘤耐药特性、发生机制及寻找逆转策略提供了良好的研究对象[5-6]。我们按照文献[5]报道的方法,在人结直肠癌细胞株SW480(称之为亲本细胞)的培养基中逐渐提高化疗药物Oxa的浓度,成功建立了耐Oxa细胞株SW480/OxR(称之为耐药细胞)。在接下来的实验中,我们比较了耐药细胞与亲本细胞以下生物学特性的差异:①MDR特性;②部分耐药指标表达情况;③干细胞转录因子Oct4的表达情况,为我们后续的研究打下基础。
我们首先采用细胞增殖检测试剂WST-1检测耐药细胞与亲本细胞对化疗药物(Oxa及5-FU)的敏感性。结果提示,与未加化疗药物的对照组(Con)比较,亲本细胞(SW480)在加入临床血药浓度的化疗药物(Oxa及5-FU)后,随着时间推移,细胞数量逐渐减少,到加药后72 h时,只有约50%的存活细胞(P<0.01,见图2),说明这两种细胞对化疗药物Oxa及5-FU均敏感;而对于耐药细胞(SW480/OxR)即使到了加药后72 h,仍有超过95%的细胞存活(P>0.05,见图3),提示这两种耐Oxa细胞株不仅对Oxa耐药,而且对5-FU也出现了耐药,显示了多药耐药(MDR)的特性,与文献报道结果一致[7]。
P-gp由MDR-1基因编码,是ABC药物转运蛋白(ATP-binding cassette transporters, ABC transporters)超家族一员,肿瘤细胞高表达P-gp是肿瘤化疗治疗失败的主要障碍之一[6]。P-gp是一种跨膜糖蛋白,通过把进入细胞内的化疗药物泵出到胞外,从而降低胞内化疗药物的有效浓度[8]。细胞凋亡由凋亡因子与抗凋亡因子之间的平衡来调控,细胞凋亡失控与肿瘤发生及化疗耐药均有关[9]。凋亡抑制蛋白(Inhibitor of apoptosis protein,IAP)是一类重要的抗凋亡因子,Survivin是IAP家族中的重要成员。在神经母细胞瘤、直肠癌等多种恶性肿瘤中发现Survivin高表达提示患者分期晚、预后差[10]。最近有研究发现[11],雷帕霉素可诱导神经母细胞瘤细胞表达Survivin,后者可保护神经母细胞瘤细胞在雷帕霉素作用下不凋亡。我们采用RT-qPCR检测耐药基因MDR-1及凋亡抑制基因Survivin的mRNA结果提示:SW480/OxR细胞与SW480细胞比较,MDR-1mRNA增高约6倍,Survivin-mRNA增高约4倍。流式细胞技术检测相应蛋白阳性细胞百分比结果也呈相同趋势变化:SW480/OxR细胞与SW480细胞比较,P-gp+细胞比例由(4.08%±1.62%)增加到(41.62%±4.76%)(P<0.01),而Survivin+细胞比例则由(27.53%±2.29%)增加到(91.87%±5.89%)(P<0.01),提示P-gp和Survivin蛋白可能在结直肠癌耐药中起重要作用。
研究发现[12],Oct4基因是维持胚胎干细胞(Embryonic Stem Cell,ES)多能性及自我更新主要调节剂。Oct4在多能的ES细胞中高表达,在ES细胞分化时Oct4下调,敲出Oct4基因后使ES细胞分化[13]。因此,调节ES细胞多能性及自我更新赋予Oct4作为多能性的标志。近来,越来越多的报道显示Oct4在部分恶性实体肿瘤,如乳腺癌、肺癌[14]及结直肠癌[15]等中有异常表达,并且与肿瘤的预后有密切的相关性。Ong CW等[15]对1990~1999年在该院行外科手术治疗切除的501例结直肠癌患者的石蜡切片用免疫组化方法检测干细胞相关因子CD133、Oct-4及Sox-2,结果发现肿瘤CD133及Oct-4阳性表达与结直肠癌患者差的预后相关,并且发现CD133+肿瘤对5-FU化疗更容易耐药。Hu等[14]研究发现,几乎所有的鼠肺癌3LL细胞及人乳腺癌MCF7细胞均高表达Oct-4。他们把这两种高表达Oct-4的细胞称为肿瘤干细胞样细胞(Cancer stem cell-like cells,CSCLCs)。他们采用RNAi技术沉默这两种细胞的Oct-4基因,结果体外实验发现细胞凋亡明显增加,裸鼠成瘤实验中肿瘤生长明显受抑制。研究还发现,Oct4在前列腺癌[16]、肝癌[17]等恶性肿瘤中高表达与肿瘤耐药有关。以上研究说明Oct4在维持CSCLCs存活及恶性肿瘤耐药中起重要作用。我们采用RT-qPCR及Western blot技术检测了Oct4的mRNA及蛋白表达,结果二者在耐药细胞表达均明显高于其亲本细胞,见实验结果2.3及2.5。
综上所述,我们所建立的耐奥沙利铂细胞株具有多药耐药的特性,可能与高表达耐药蛋白P-gp、抗凋亡蛋白Survivin及干细胞转录因子Oct4有关。
[参考文献]
[1] Alberts S R,Horvath W L,Sternfeld W C,et al.Oxaliplatin,fluorouracil,and leucovorin for patients with unresectable liver-only metastases from colorectal cancer:a North Central Cancer Treatment Group phase II study[J].J Clin Oncol,2005,23(36):9243-9249.
[2] 文坤明,傅仲学,张贵海,等.结直肠癌耐药细胞株诱导上皮间质转化的研究[J].中华实验外科杂志,2012,29(10):2015-2018.
[3] Siegel R,Naishadham D,Jemal A.Cancer statistics,2012[J].CA Cancer J Clin,2012,62(1):10-29.
[4] Crea F,Nobili S,Paolicchi E,et al.Epigenetics and chemoresistance in colorectal cancer:an opportunity for treatment tailoring and novel therapeutic strategies[J].Drug Resist Updat,2011,14(6):280-296.
[5] Dallas N A,Xia L,Fan F,et al.Chemoresistant colorectal cancer cells,the cancer stem cell phenotype,and increased sensitivity to insulin-like growth factor-I receptor inhibition [J].Cancer Res,2009,69(5):1951-1957.
[6] Zhang X,Xiao W,Wang L,et al.Deactivation of signal transducer and activator of transcription 3 reverses chemotherapeutics resistance of leukemia cells via down-regulating P-gp [J].PLoS One,2011,6(6):e20965.
[7] Bose D,Zimmerman L J,Pierobon M,et al.Chemoresistant colorectal cancer cells and cancer stem cells mediate growth and survival of bystander cells [J].Br J Cancer,2011,105(11):1759-1767.
[8] Higgins C F.Multiple molecular mechanisms for multidrug resistance transporters [J].Nature,2007,446(7137):749-757.
[9] Altieri D C.Molecular circuits of apoptosis regulation and cell division control:the surviving paradigm[J].J Cell Biochem,2004,92(4):656-663.
[10] Sprenger T,Rödel F,Beissbarth T,et al.Failure of downregulation of survivin following neoadjuvant radiochemotherapy in rectal cancer is associated with distant metastases and shortened survival[J].Clin Cancer Res,2011,17(6):1623-1631.
[11] Samkari A,Cooper Z A,Holloway M P,et al.Rapamycin induces the anti-apoptotic protein survivin in neuroblastoma[J].Int J Biochem Mol Biol,2012,3(1):28-35.
[12] Boyer L A,Lee T I,Cole M F,et al.Core transcriptional regulatory circuitry in human embryonic stem cells[J].Cell,2005,122(6):947-956.
[13] Hay D C,Sutherland L,Clark J,et al.Oct-4 knockdown induces similar patterns of endoderm and trophoblast differentiation markers in human and mouse embryonic stem cells[J].Stem Cells,2004,22(2):225-235.
[14] Hu T,Liu S,Deborah R,et al.Octamer 4 Small Interfering RNA Results in Cancer Stem Cell-Like Cell Apoptosis [J].Cancer Res,2008,68 (16):6533-6540.
[15] Ong C W,Kim L G,Kong H H,et al.CD133 expression predicts for non-response to chemotherapy in colorectal cancer[J].Modern Pathology,2010,23(3):450-457.
[16] Linn D E,Yang X,Sun F,et al.A Role for OCT4 in Tumor Initiation of Drug-Resistant Prostate Cancer Cells [J].Genes Cancer,2010,1(9): 908-916.
[17] Wang X Q,Ongkeko W M,Chen L,et al.Octamer 4 (Oct4) mediates chemotherapeutic drug resistance in liver cancer cells through a potential Oct4-AKT-ATP-binding cassette G2 pathway [J].Hepatology,2010,52(2): 528-539.

