卵巢癌干细胞对5种化疗药物的耐药性及其机制
陈峻崧,杨 洁,邵家胜,洪晓武
(1.东南大学医学院 病原生物学与免疫学系,江苏 南京 210009;2.江苏先声药业有限公司,江苏 南京 210042;3.上海复旦大学附属公共卫生临床中心 内科学系,上海 201508;4.复旦大学基础医学院 免疫学系,上海 200032)
卵巢癌是发病率第3位的女性生殖器恶性肿瘤,占女性恶性肿瘤的5%。但因卵巢癌致死者,却占各类妇科肿瘤的首位[1-2];中国女性的卵巢癌发病率为3.8/10万,每年有1.2万人死于卵巢癌[3]。卵巢癌复发率高,五年生存率仅有15%~30%,主要原因是耐药而导致的复发[2,4]。卵巢癌干细胞(Ovarian Cancer Stem cells,OCSCs)常被描述为与卵巢癌发生、发展、转移、抗辐射、耐药和复发密切相关的肿瘤细胞[5-6],含量极低。OCSCs作为卵巢癌治疗中的重要靶细胞,OCSCs生物学特性的研究日益增多,在人上皮卵巢癌(Human Epithelial ovarian cancer,EOC)中分离的一部分表型为CD44+CD117+的细胞,被证实具有更高的顺铂和紫杉醇耐受性和在裸鼠中具有高致瘤性[7]。但是针对OCSCs的靶向抗肿瘤药物仍未被开发出,因此,深入了解OCSCs的耐药机制,寻找靶向消灭OCSCs的药物是治愈卵巢癌的关键。
1 资料与方法
1.1 人OCSCs分选收集对数生长期的人EOC HO8910细胞 用免疫磁珠分选(magnetic-activated cell sorting,MACS)Buffer(MACS- Runnning Buffer:PBS pH 7.2 + 2 mM EDTA +0.5% BSA)重悬细胞,白细胞计数板镜下计数,每107个细胞重悬于80 μL Buffer中;CD44磁珠抗体标记,每107个细胞加入20 μL的CD44磁珠单抗,混匀后4 ℃冰箱中孵育15 min;采用LS Columns柱,正性分选,过柱收集CD44+细胞后计数。再加入100 μLCD117磁珠单抗,混匀后在4 ℃冰箱中孵育45 min,再次过柱收集CD44+CD117+细胞,计数、放入培养瓶中,加入干细胞培养液,注意无菌操作。
1.2 人OCSCs的无血清培养与鉴定 CD44+CD117+细胞加入干细胞培养液在培养瓶中置37 °C、5%CO2饱和湿度条件下常规细胞培养。无血清干细胞培养液[7]为DMEM/F12培养基加入5 μg/mL牛胰岛素,20 ng/mL人重组表皮生长因子,10 ng/mL成纤维生长因子和0.4%牛血清白蛋白配制而成;流式细胞术(Flow Cytometer,FCM)检测分选的EOC CD44+CD117+细胞表面CD44和CD117分子表达,每100 μL含待测细胞的反应体系先后加入0.5 μg FITC 标记的CD44+单克隆抗体[8]和5 μL PE标记的CD117+单克隆抗体[9],4 ℃孵育30 min;用PBS洗涤3次,每次3 min,重悬于400 μL PBS中;FCM检测,设HO8910细胞为对照组,未加单抗的细胞为阴性对照。
1.3 MTT法检测细胞对化疗药物的耐受性 选取处于生长对数期的CD44+CD117+和HO8910细胞计数将细胞悬液接种于96孔板中,设3个复孔;在各细胞组中分别加入抗肿瘤药物,具体浓度见表1。将已加入药物的96孔板放入孵箱,在37 ℃、5%CO2及饱和湿度环境下,静止培养72 h;加入5 mg/mL MTT 及SDS三联液静置12 h;酶标仪490 nm波长测各孔的吸光度值,以空白对照孔调零,记录结果。
表1 5种抗肿瘤药物的浓度(μM)及分组情况
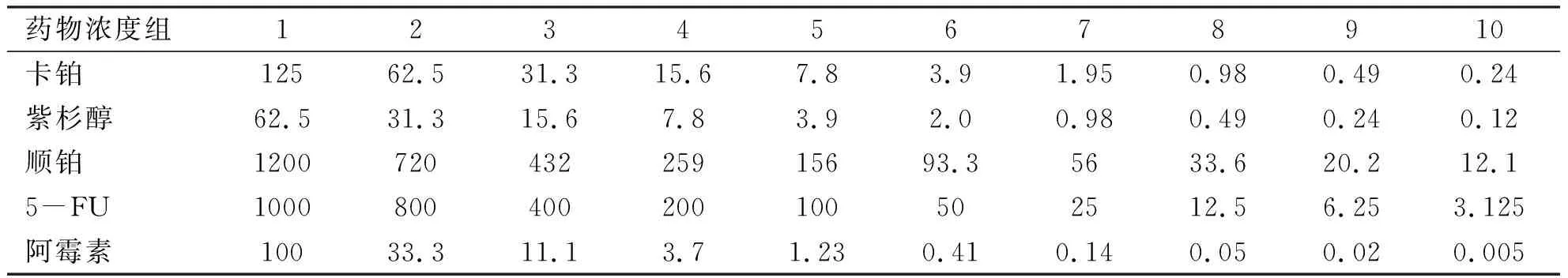
药物浓度组12345678910卡铂12562.531.315.67.83.91.950.980.490.24紫杉醇62.531.315.67.83.92.00.980.490.240.12顺铂120072043225915693.35633.620.212.15-FU1000800400200100502512.56.253.125阿霉素10033.311.13.71.230.410.140.050.020.005
1.4 实时荧光定量PCR(q-PCR)检测 检测卵巢癌细胞HO8910及其OCSCs(表达CD44+CD117+)的ABCG2、ABCB1、Nanog、MMP-2和MMP-9及β-actin基因表达。各引物序列(见表2),均由上海Invitrogen生物技术有限公司合成,纯度为PAGE级。使用TAKARA公司的PrimeScript®RT试剂盒,按照产品说明书的操作步骤,进行相关试剂的配比和实验,得到cDNA。以逆转录合成的样品的cDNA产物作为模板,采用SYBR®GreenI20 μL反应体系,配制PCR反应液进行qPCR扩增,每个样品设置3个复孔。以ddH2O为模板设阴性对照,电脑采集每个循环的ct值。比较各组间的差异有无显著性,P<0.05为有统计学意义。
1.5 统计学处理 以上实验重复3次,获取平均值所有数据均采用SPSS 17.0分析软件包进行统计处理,各组间差异采用方差分析(ANOVA),多样本均数之间两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
表2 ABCG2,ABCB1,Nanog,β-actin,MMP-2和MMP-9引物序列

基因Gene IDRT-PCR引物序列ABCG29429上游5’-GGCTTATACGGCCAGTTCCA-3’下游5’-GTCCGTTACATTGAATCCTGGAC-3’ABCB15243上游5’-CGAATGTCTGAGGACAAGCCAC-3’下游5’-CCATGAGGTCCTGGGCATG-3’Nanog71950上游5’-GGGCCTGAAGAAAACTATCCATCC-3’下游5’-TGCTATTCTTCGGCCAGTTGTTTT-3’β-actin69642上游5’-GGACTTCGAGCAAGAGATGG-3’下游5’-AGCACTGTGTTGGCGTACAG-3’MMP-24313上游5’-CGTTTGATGGCAAGGATGGAC-3’下游5’-GCCATCAGCGTTCCCACTTTAC-3’MMP-981687上游5’-CGCTGGGCTTAGATCATTCC-3’下游5’-GTGCCGGATGCCATTCAC-3’
2 结果
2.1 分选的EOC细胞表面CD44+CD117+表达情况 细胞分选前(见图1A),HO8910细胞表面CD44和CD117皆为阳性的CD44+CD117+细胞占1%±1.7%,而CD44和CD117皆为阴性的CD44-CD117-细胞占82.2%±3.7%;CD44+CD117-细胞占13.8%±2.1%,CD44-CD117+细胞占1.2%±0.6%。细胞分选后(见图1B),细胞表面CD44和CD117皆为阳性的CD44+CD117+细胞占84.2%±9.4%,而CD44和CD117皆为阴性的CD44-CD117-细胞占2%±0.5%;CD44+CD117-细胞占15.1%±3.3%,CD44-CD117+细胞占0.4%±0.2%。表明经过免疫磁珠分选后,原本仅占极少数的CD44+CD117+细胞1%±1.7%,获得了富集,比例大大上升84.2%±9.4%,P<0.01。
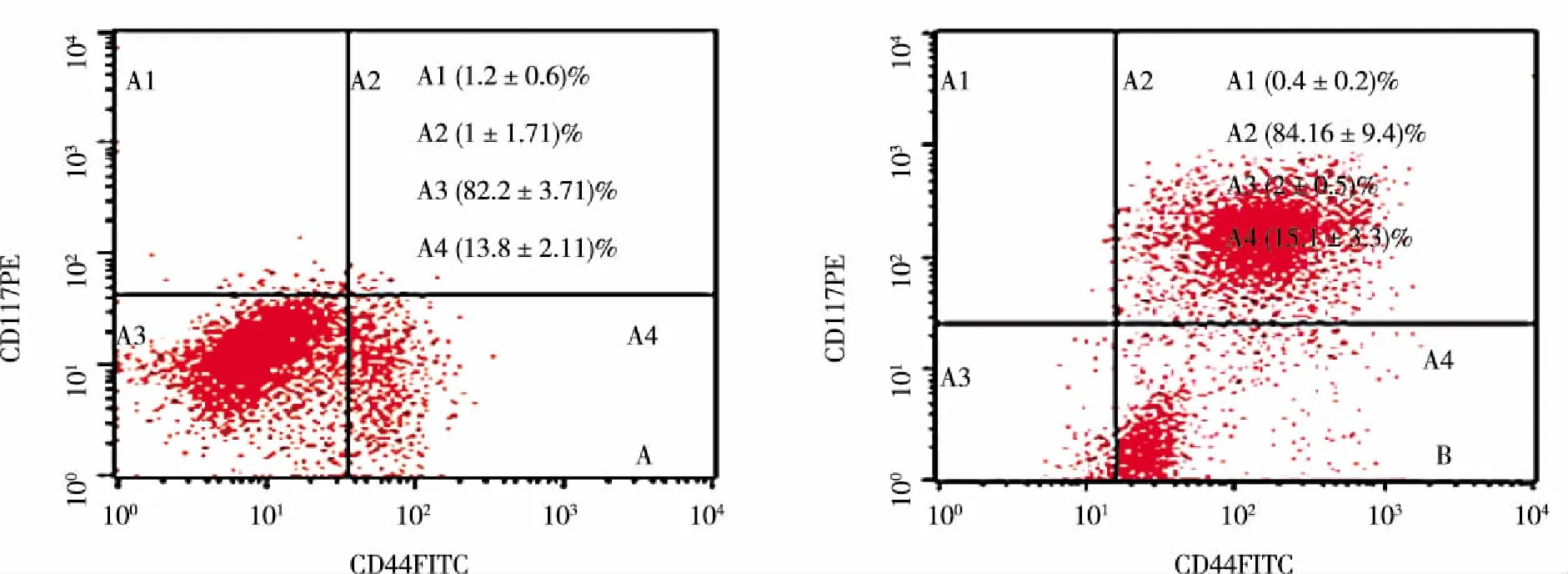
注:A:为免疫磁珠分选前HO8910细胞;B:为免疫磁珠分选后CD44+CD117+细胞。图1 EOCHO8910细胞免疫磁珠分选前后FCM检测表达CD44+CD117+细胞比例
2.2 细胞生长状态变化 人EOCHO8910细胞株在无血清干细胞培养基中培养1 d,细胞呈铺路石状,贴壁生长2 d后部分细胞脱落,悬浮于培养基中。7 d后,大部分细胞凋亡,大量的细胞碎片悬浮于培养基中(见图2A-C)。HO8910CD44+CD117+细胞在无血清干细胞培养基中培养7 d后,仍能够进行扩增,形成多个团状、腺泡状结构(见图2D-F)。对照组HO8910细胞在完全培养基中呈贴壁状生长(见图2G-I)。
2.3 细胞对化疗药物的耐药性 不同浓度的化疗药物作用下,各组细胞表现出剂量依赖性的细胞生长抑制率,细胞生长抑制率越低表示该细胞的耐药性就越强(见图3)。在中浓度梯度区间CD44+CD117+细胞比HO8910细胞显现出更强的耐药性(P<0.05)。5-FU药物组表现为:在高浓度梯度时(1~3用药组)CD44+CD117+细胞与HO8910细胞耐药性无差别(P>0.05),而在中低浓度梯度区间(4~10用药组)CD44+CD117+细胞明显比HO8910细胞更为耐药(P<0.05)。卡铂药物组中,CD44+CD117+细胞和HO8910细胞呈现剂量正相关性的细胞抑制率曲线,即随着药物作用浓度的升高,两组细胞生长抑制率液逐渐升高。除最高剂量(125 μM)外,CD44+CD117+细胞比HO8910细胞显现出更强的耐药性(P<0.05)。顺铂和紫杉醇用药组中两细胞组表现类似的耐药现象,即在高浓度梯度时(1~4用药组)CD44+CD117+细胞与HO8910细胞耐药性无差别(P>0.05),细胞抑制率都达到80%以上;而在中浓度梯度区间(5~8用药组)CD44+CD117+细胞明显比HO8910细胞更为耐药(P<0.05)。而低浓度梯度区间(9~10用药组),由于用药浓度较低,表现为各组细胞都有较强的生存能力,抑制率较低,CD44+CD117+细胞与HO8910细胞耐药能力无显著差别(P>0.05)。阿霉素组中,在高中浓度梯度时(1~4用药组)CD44+CD117+细胞与HO8910细胞耐药性无差别(P>0.05),都表现出较高的细胞生长抑制率(80%以上)。而在中低浓度梯度区间(5~10用药组)CD44+CD117+细胞明显比HO8910细胞更为耐药(P<0.05)。
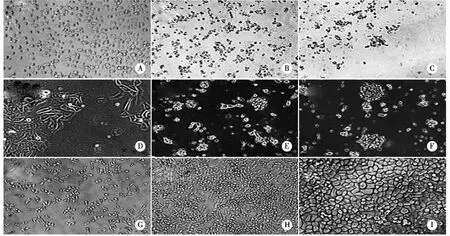
注:A-C为HO8910细胞在无血清干细胞培养基中,分别经过1、2、7 d后的生长情况;D-F为HO8910CD44+CD117+细胞在无血清干细胞培养基中,经过1、2 和7 d后的生长情况;G-I为HO8910细胞在完全培养基中,经过1、2、7 d后的生长情况(A-H:放大倍数×100,I:放大倍数×400)。图2 EOCHO8910细胞及其CD44+CD117+细胞体外培养生长状态
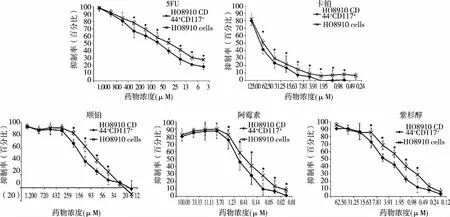
注:*P<0.05。图3 HO8910细胞及其CD44+CD117+细胞对5种化疗药物不同浓度药敏试验的结果
2.4 q-PCR检测相关基因表达 HO8910细胞及CD44+CD117+细胞经过总RNA提取,进行q-PCR对比研究。结果显示(见图4)CD44+CD117+细胞的ABCG2,ABCB1,Nanog,MMP-2和MMP-9基因mRNA表达水平都高于同样培养条件下的HO8910细胞(P<0.05),ABCG2基因mRNA表达水平,CD44+CD117+细胞是HO8910细胞11倍;与HO8910细胞相比,CD44+CD117+细胞ABCB1、Nanog、MMP-2和MMP-9基因mRNA表达水平分别是前者的7.6倍、2.5倍、5.5倍和6倍。
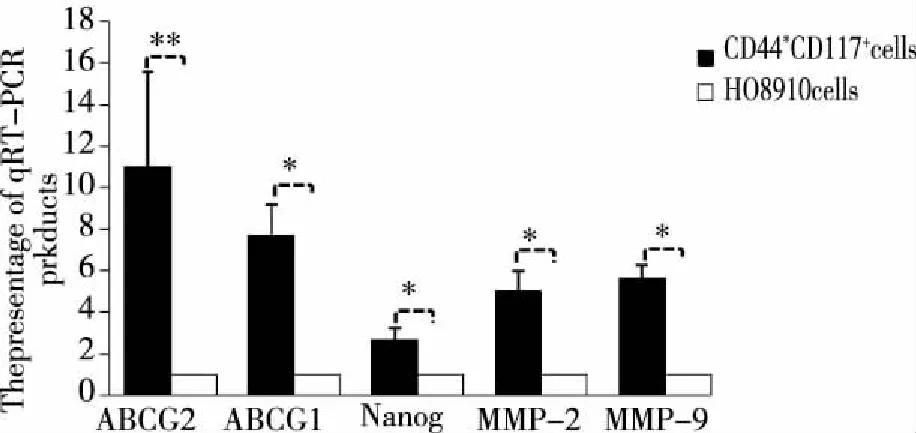
注:*P<0.05,**P<0.01。图4 q-PCR检测HO8910细胞及CD44+CD117+细胞的ABCG2,ABCB1,Nanog,MMP-2和MMP-9mRNA表达
2.5 肿瘤干细胞耐药作用机制(见图5)。
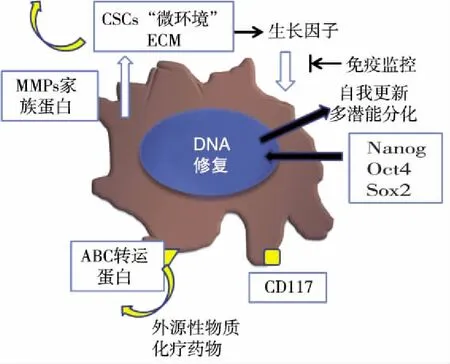
图5 肿瘤干细胞耐药作用机制及相关特征分子标记
3 讨论
研究显示,卵巢癌复发率高,5年生存率仅有15%~30%[1],主要原因可能是肿瘤干细胞引起的耐药、复发和转移所致[4]。因此,寻找靶向消灭肿瘤干细胞的药物或提高其对化疗药物的敏感性是治愈卵巢癌的关键[10]。由于肿瘤干细胞仅占肿瘤细胞中的极少部分0.04%~0.2%[11],较难获得,因此,首先要获得具有干细胞特性的一部分肿瘤细胞,经过培养、化疗药物耐药实验,深入了解其耐药作用机制,为肿瘤干细胞生物学特征研究、靶向抗肿瘤药物研发等奠定基础。
干细胞因子受体(stem cell factor receptor,SCFR),即CD117是一种跨膜的酪氨酸激酶受体,大小为145kD,在多种肿瘤中广泛存在的癌蛋白[12]。在卵巢癌细胞中,CD117+的细胞比例非常低,在0.5%~3%[13]。Zhang等[7]报道,在人卵巢癌组织中分离出一部分高表达CD44和CD117的肿瘤细胞,在体外培养形成独立的、具有自我更新能力的细胞球。这些CD44+CD117+细胞具有高致瘤性和体内重建卵巢癌等特性,仅用100个CD44+CD117+细胞即可使裸鼠致瘤。CD44+CD117+细胞具有肿瘤干细胞相关特征,可能是一种OCSCs。
目前肿瘤干细胞的分离方法通常通过细胞表面特异性标志筛选[7]、无血清培养富集[14]、SP细胞分选等[15]。本实验利用免疫磁珠分选方法,以磁珠直接标记的人CD44和CD117单克隆抗体,从人EOCHO8910细胞株中分选获得了比例为84.1%±9.4%的CD44+CD117+细胞。进而使用了目前临床上治疗卵巢癌的一线化疗药物,如紫杉醇、卡铂、顺铂、5-FU等5种化疗药物,比较CD44+CD117+细胞和EOCHO8910细胞的耐药性差异。结果显示从HO8910细胞分离的CD44+CD117+细胞,对卡铂、顺铂、紫杉醇和5-FU、阿霉素化疗药物的耐药性也明显强于HO8910细胞。说明CD44+CD117+细胞除了具有肿瘤干细胞相关表型外,还具有较强的化疗药物耐药性。卵巢癌一线化疗方案疾病控制率长可达到90%以上,但是肿瘤患者3年的复发率达到40%以上[1]。具有较强耐药性的CD44+CD117+细胞未被化疗药物完全杀灭可能是导致卵巢癌复发的原因之一。因此,针对CD44+CD117+细胞等具有肿瘤干细胞样特征的肿瘤细胞进行靶向治疗和特异性杀伤,是治愈卵巢癌的关键。
肿瘤干细胞表现出耐药性,可能是其表面或细胞外基质高表达一些受体或蛋白相关,如ABCG2,ABCB1。而肿瘤干细胞在肿瘤发生发展及侵袭转移与Nanog,MMP-2和MMP-9蛋白的表达密切相关(见图5)。在q-PCR试验中发现,在同等培养条件下OCSCs中ABCG2、ABCB1、Nanog、MMP-2和MMP-9mRNA基因明显高于HO8910细胞表达水平;已知ABCG2和ABCB1基因是一种ATP绑定的盒式转运体,能够主动将进入细胞内部的化疗药物和毒性物质泵出胞外,从而避免细胞被杀伤。因此其高表达与肿瘤干细胞耐药密切相关[16]。OCSCs中ABCG2和ABCB1基因表达升高,可能是其具有较高耐药性的机制之一,研究具有靶向ABCG2和ABCB1分子的抗肿瘤药物将可能是有效杀灭肿瘤干细胞的一个思路[17]。MMPs是一类锌依赖的蛋白家族,是水解细胞外基质(Extracellular matrix,ECM)的蛋白裂解酶,包括ECM及整合于质膜中的各种胶原酶和弹性蛋白酶等,在肿瘤发生发展及侵袭转移中起重要作用[18]。MMP-2和MMP-9作为MMPs蛋白家住中最为重要的成员,与肿瘤干细胞在体内的发生、发展和转移密切相关。OCSCS高表达MMP-2和MMP-9mRNA,也提示CD44+CD117+细胞可能具有高的侵袭性。Nanog基因主要与肿瘤干细胞保持未分化状态有关[19],在多种肿瘤干细胞中高表达[20],CD44+CD117+EOC细胞高表达Nanog基因,提示该群细胞的低分化状态,可能也是维持OCSCs未分化状态和高增殖能力的重要转录因子和分子机制之一。如何提高OCSCs对化疗药物的敏感性,提高药物的肿瘤干细胞杀伤效率,仍是需要不断探索的重要课题,分子靶向治疗是否在这一领域可发挥重要作用,还有待进一步研究证实。
[参考文献]
[1] Cannistra S A. Cancer of the ovary[J].N Eng J Med,2004,351(24):2519-2529.
[2] Attar R,Attar E. Use of hematopoietic stem cells in obstetrics and gynecology[J].Transfus Apher Sci,2008,38(3):245-251.
[3] 陈登宇,陈峻崧,王净,等.靶向上皮性卵巢癌SKOV3细胞ZEB1-shRNA重组体构建及功能研究[J].中国免疫学杂志,2012,28(7):611-615.
[4] McAuliffe S M,Morgan S L,Wyant G A,et al.Targeting Notch,a key pathway for ovarian cancer stem cells,sensitizes tumors to platinum therapy[J].Proc Natl Acad Sci USA,2012,109(43):2939-2948.
[5] Bapat S A.Human ovarian cancer stem cells[J].Reproduction,2010,140(1):33-41.
[6] Shostaks.Cancer Stem Cells - The Cutting Edge[M].Istedn:Zn Tech,2011:389-406
[7] Zhang S,Balch C,Chan M W,et al.Identification and characterization of ovarian cancer-initiating cells from primary human tumors[J].Cancer Res,2008,68(11):4311-4320.
[8] Maiti A,Maki G,Johnson P.TNF-alpha induction of CD44-mediated leukocyte adhesion by sulfation[J]. Science,1998,282(5390):941-943.
[9] Blair A,Sutherland H J.Primitive acute myeloid leukemia cells with long-term proliferative ability in vitro and in vivo lack surface expression of c-kit (CD117)[J].Exp Hematol,2000,28(6):660-671.
[10] Bapat S A,Mali A M,Koppikar C B,et al.Stem and Progenitor-Like Cells Contribute to the Aggressive Behavior of Human Epithelial Ovarian Cancer[J].Cancer Res,2005,65(8):3025-3029.
[11] Singh A,Settleman J.EMT,cancer stem cells and drug resistance:an emerging axis of evil in the war on cancer[J].Oncogene,2010,29(34):4741-4751.
[12] Luo L,Zeng J,Liang B,et al.Ovarian cancer cells with the CD117 phenotype are highly tumorigenic and are related to chemotherapy outcome[J].Exp Mol Pathol,2011,91(2):596-602.
[13] Choi Y P,Shim H S,Gao M Q,et al.Molecular portraits of intratumoral heterogeneity in human ovarian cancer[J].Cancer Lett,2011,307(1):62-71.
[14] Ma L,Lai D,Liu T,et al.Cancer stem-like cells can be isolated with drug selection in human ovarian cancer cell line SKOV3[J].Acta Biochim Biophys Sin , 2010,42(9):593-602.
[15] Dou J, Li Y,Zhao F,et al.Identification of tumor stem like cells in mouse myeloma cell lines [J].Cell Mol Biol ,2009,55 (Suppl):OL1151-1160.
[16] Woodward O M,Tukaye D N,Cui J,et al.Gout-causing Q141K mutation in ABCG2 leads to instability of the nucleotide-binding domain and can be corrected with small molecules[J].Proc Natl Acad Sci USA,2013,110(13):5223-5228.
[17] Yang C,Ximg F,Wang J,et al.Anti-ABCG2 Monoclonal Antibody in Combination with Paclitaxel-Nanoparticles Against Cancer Stem-like Cell Activity in Multiple Myeloma[J].Nanomedicine,2014,9(1):45-60.
[18] 郭静,王宇奇.基质金属蛋白酶及其组织抑制因子在胃癌中表达的研究[J].中外医学研究,2011,9(3):22-23.
[19] Jeter C R,Badeaux M,Choy G,et al.Functional evidence that the self-renewal gene nanog regulates human tumor development[J].Stem Cells,2009,27(5):993-1005.
[20] Jeter C R,Liu B,Liu X,et al.Nanog promotes cancer stem cell characteristics and prostate cancer resistance to androgen deprivation[J].Oncogene,2011,30(36):3833-3845.

