野西瓜多糖分离纯化及其质量浓度研究
毕明刚,于 蕾,于 淼,东 方,王 崴,刘光达,李海娇,周 贺
(1.哈尔滨商业大学生命科学与环境科学研究中心,哈尔滨150076;2.哈尔滨商业大学药物研究所博士后科研工作站,哈尔滨150076;3.国家教育部抗肿瘤天然药物工程研究中心,哈尔滨150076)
多糖具有疗效确切的抗肿瘤作用,部分多糖如 黄芪多糖、香菇多糖等也已应用于临床.但由于多糖构成组分众多且杂质较多,而其结构又高度复杂,导致目前对于多糖构效关系的研究并不十分深入和明确,也限制了多糖的应用.研究证实,植物多糖发挥生物活性主要物质基础在于其独特化学组分上[1-4],因此,研究除去杂质的多糖组分对深入研究多糖构效关系至关重要.野西瓜多糖为野西瓜(Capparis spinosa L.)果实中质量浓度较高的成分之一,本文研究野西瓜分离纯化过程及其质量浓度,为继续深入研究野西瓜多糖奠定基础.
1 实验材料与实验方法
1.1 实验材料
野西瓜粗多糖:哈尔滨商业大学生命科学与环境科学研究中心提供.
实验试剂:95%乙醇、无水乙醇、丙酮、石油醚、过氧化氢、氯化钡(天津市福晨化学试剂厂),正丁醇(天津市津宇细化工有限公司),氯仿(天津博迪化工股份有限公司),三氯乙酸(上海山浦化工有限公司),氨水(天津市东丽区天大化学试剂厂),苯酚(天津市光复精细化工研究所),浓硫酸(北京化工厂),氯化钠(天津市巴斯夫基化工有限公司),DEAE -52(Whatman公司)、Sephadex G -200(Pharmacia公司)、葡萄糖(曹阳第二试剂厂),硫酸钾(天津市天力化学试剂有限公司),明胶(天津市化学试剂三厂),葡萄糖醛酸(上海达瑞精细化学品有限公司)、咔唑(国药集团化学试剂有限公司)、试剂均为分析纯,木瓜蛋白酶(>5×105U/g,北京奥博星生物技术有限责任公司).
实验仪器:752型紫外可见分光光度计(上海光谱仪器有限公司),Waters高效液相色谱仪(Waters公司),BS-160A自动部分收集器(上海康华生化仪器制造厂),HL-2B数显恒流泵(上海康华生化仪器制造厂).
1.2 实验方法
1.2.1 野西瓜多糖分离纯化流程
称取10 g粗多糖溶于水中,以多糖质量分数1%的比例加入木瓜蛋白酶,放入60℃的恒温水浴锅中反应2 h,待木瓜蛋白酶与糖溶液充分反应后将其放入100℃的恒温水浴锅内灭活10 min,除去沉淀保留清液,然后向清液中加入Sevag液(氯仿∶正丁醇 =4∶1)剧烈震荡20 min,静置30 min,收集上清液.将收集到的上清液按上述步骤反复操作,直至水相和有机相之间没有白色的沉淀物出现,收集水相,即得到除去蛋白质的野西瓜多糖水溶液[5-6].
将除去蛋白的野西瓜多糖水溶液用氨水调节pH值至8~9,然后向糖液中缓慢地、边搅拌边加入H2O2至终体积分数为10%,将其放入60℃的恒温水浴锅内加热2 h.将处理过的糖液倒入透析袋中,流水透析72 h,蒸馏水透析24 h,浓缩后,向糖液中加入乙醇至终体积分数10%,24 h后,3 500 r/min离心10 min弃去上清液,离心后所得的沉淀用无水乙醇、丙酮、石油醚抽洗,待溶剂完全挥发完所得的干燥粉末状即为10%组分的多糖CSPSⅠ,向剩下的糖液中继续加入无水乙醇至终体积分数为20%进行醇沉,可得20%组分的多糖CSPSII,按上述操作向糖液中加入无水乙醇,分别调终体积分数至30%、40%、50%、60%、70%、80%,分别得到组分 CSPSШ、CSPSⅣ、CSPSⅤ、CSPSⅥ、CSPSⅦ、CSPSⅧ.
将除去蛋白及色素的CSPSⅠ进行DEAE-52柱层析,依次用 4 倍柱体积双蒸水、0.05、0.1、0.2、0.3、0.5、0.8 mol/L NaCl洗脱剂洗脱,自动收集器收集洗脱液,苯酚-硫酸法隔管检测,合并单一峰,流水透析3 d、蒸馏水透析2 d,至无Cl-后冷冻干燥.
1.2.2 纯度鉴定
取CSPSⅠC适量,以0.05 mol/L NaCl为洗脱剂,进行Sephadex G -200(1.6×80 cm)柱层析,自动部分收集器收集,苯酚-硫酸法隔管检测.
1.2.3 CSPSⅠC 糖质量浓度测定
1)葡萄糖标准曲线制备
分别吸取0.1 mg/mL葡萄糖标准溶液0.2、0.4、0.6、0.8、1.0、1.2、1.4 mL,分别加入到 20 mL试管中,依次添加蒸馏水补充体积至2.0 mL,各管再加入6%苯酚1.0 mL,混匀,迅速加入浓硫酸5 mL,静置5 min后,置于沸水中加热20 min,取出冷却至室温,490 nm处测定吸光度,以葡萄糖的质量浓度(μg/mL)为横坐标,吸光度值(A)为纵坐标,绘制标准曲线.
2)样品质量浓度测定
精密吸取0.1 mg/mL CSPSⅠC溶液 1 mL,置于20 mL试管中,加入蒸馏水至终体积2.0 mL,在加入6%苯酚1.0 mL,混匀,迅速加入浓硫酸5 mL,摇匀,静置5 min后,置于沸水中加热20 min,取出冷却至室温,490 nm处测定吸光度,依据回归方程计算多糖质量浓度[7].
1.2.4 CSPSⅠC糖醛酸质量浓度测定
1)标准曲线的制作
分别吸取0.1 mg/mL葡萄糖醛酸标准品溶液0.0、0.2、0.4、0.6、0.8、1.0 mL 于 10 mL 具塞试管中,各管加水至1 mL,分别在冰水浴中加入浓硫酸溶液5 mL,混匀后于沸水浴中加热20 min,取出后立即冷却至室温,加0.1%咔唑溶液0.2 mL,摇匀,在室温下保持2 h,在最佳测定波长下测定其吸光度.以糖醛酸质量浓度(μg/mL)为横坐标,以吸光度为纵坐标绘制标准曲线.
2)样品溶液中糖醛酸质量浓度的测定
精密吸取0.1 mg/mL CSPSⅠC溶液1 mL,以蒸馏水同法操作为参比,按上述标准曲线的测定方法,测定其吸光度值,计算糖醛酸的质量浓度[8].
1.2.5 CSPSⅠC硫酸基质量浓度测定
1)标准曲线的制备
分别取0.1 mg/mL硫酸钾标准品溶液0.0、0.2、0.4、0.6、0.8、1.0、1.2、1.4 mL,放入 8 支试管中,加水至2.0 mL,再加入8%三氯乙酸1.40 mL和0.5%氯化钡明胶溶液1.00 mL,混合.混合物静置20 min,在360 nm波长下测定浊度.记录吸光度值A1,再以0.5%明胶溶液1.00 mL代替氯化钡明胶溶液测定,记录吸光度值A2,以A1-A2为纵坐标,硫酸钾标准品的质量浓度(μg/mL)为横坐标,作标准曲线.
2)样品的测定
称取6mg CSPSⅠC置于安瓿中,加入1.0 mL 1 mol/L HCl,密封,100 ℃水解6 h.冷却后开启安瓿管,内容物于40℃减压旋转蒸干,残渣溶解于4.0 mL水中.取0.2 mL水解液放入试管中,加水至2.0 mL,加入三氯乙酸1.4 mL、氯化钡明胶溶液1.00 mL,混合静置20 min,360 nm 下测定浊度(A1).再取0.2 mL水解液置于试管中,加水至2.0 mL,加入三氯乙酸 1.4 mL,明胶 1.00 mL 混合,静置 20 min,360 nm 下测定浊度(A2)[9-10].
1.2.6 CSPSⅠC 相对分子质量测定
1)高效液相凝胶色谱法色谱条件
仪器:Waters 2695 Separation Module型HPLC主机;色谱柱:UltrahydrogelTMLinear(7.8×300 mm);流动相:双蒸水;检测器:Waters 2414示差检测器;进样量:20 μL;流速:0.8 mL/min;柱温:40℃
2)标准曲线的绘制
将标准葡聚糖 T10、T40、T70、T110、T500,葡萄糖(用于测定柱总体积Vt)和蓝色葡聚糖(用于测定柱空体积V0)各2 mg分别溶于1 mL双蒸水中,制成质量浓度为2 mg/mL,0.45 μm 滤膜过滤,按分子质量从小到大分别进样,记录洗脱峰的保留时间(RT).
根据经验公式,多糖分子质量MW与其在凝胶柱上的洗脱体积Ve、分配系数Kav存在如下关系:
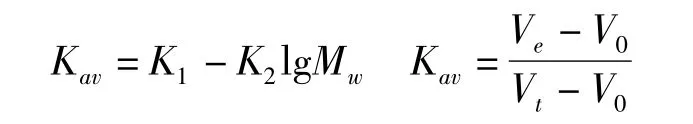
K1、K2为常数,以标准分子质量的对数值(lgMW)为纵坐标,以Kav为横坐标进行线性回归.
3)样品分子质量的测定
精确称取CSPSⅠC 2mg双蒸水定容到1 mL,制成2 mg/mL溶液,0.45 μm滤膜过滤,相同色谱条件下分析,记录保留时间(RT),经回归方程求得分子质量.
2 实验结果与分析
2.1.1 CSPS 分步醇沉结果
CSPS分步醇沉结果如表1所示,从表1中可以看出,10%醇沉部位多糖所占比例最大,质量为3.404 5 g,其次为20%醇沉部位,30% ~80%醇沉部位所占比率较小.说明CSPS中多糖分布很不均匀,10%醇沉部分应为高分子质量多糖.20% ~80% 醇沉部位应为小分子糖和杂质.因此,本文选取CSPSⅠ(10%醇沉部位)作为研究对象.
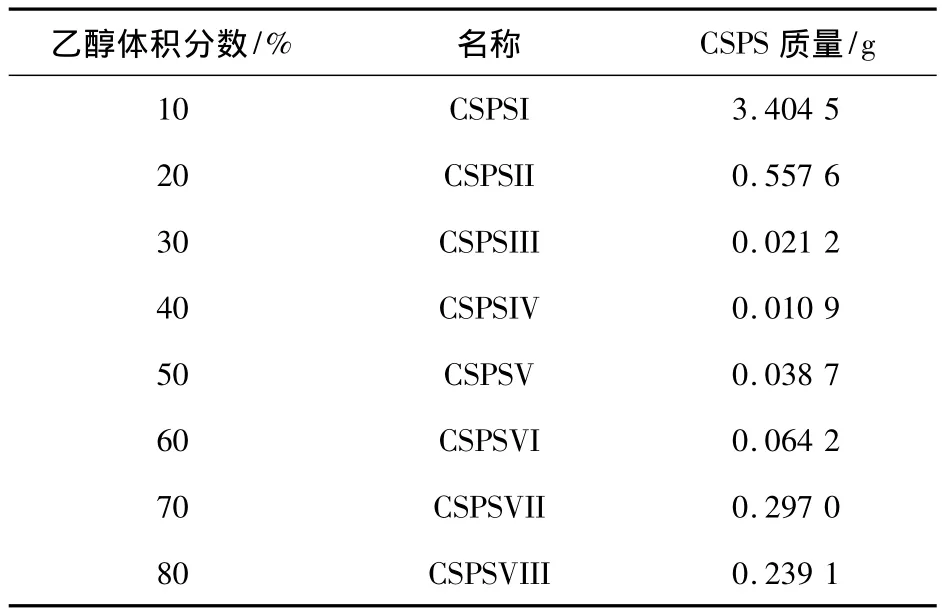
表1 CSPS不同醇沉部位多糖质量
2.1.2 CSPSⅠDEAE -52 柱层析结果
使用不同浓度 NaCl洗脱剂(蒸馏水、0.05、0.1、0.2、0.3、0.5、0.8 mol/L)对 CSPSⅠ进行 DEAE -52 柱层析.其中,0.1 mol/L NaCl洗脱所得组分CSPSⅠC糖质量浓度最高.CSPSⅠC洗脱曲线如图1所示.因此,本文选取CSPSⅠC作为研究对象,流水透析至无Cl-后浓缩、冻干即得CSPSⅠC.
2.1.3 CSPSⅠC 纯度检测结果
取溶于0.05 mol/LNaCl中的 CSPSⅠC进行Sephadex G-200柱层析,自动部分收集器收集,苯酚-硫酸法检测,绘制洗脱曲线,见图2.从图形可知CSPSⅠC经过Sephadex G-200柱层析后,峰型单一对称,纯度较好.
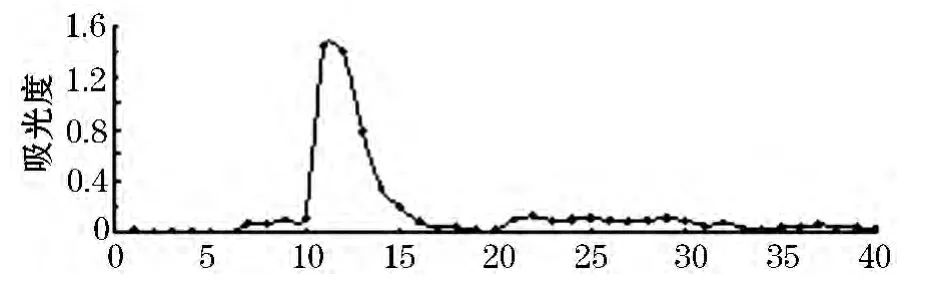
图1 0.1mol/L NaCl洗脱剂下CSPSⅠ洗脱曲线
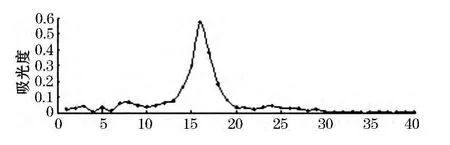
图2 CSPSⅠC Sephadex G-200柱层析
2.1.4 CSPSⅠC糖质量浓度测定结果
1)葡萄糖标准曲线
葡萄糖标准曲线见图3所示.其线性回归方程为 y=0.014 3x+0.007,相关系数 R2=0.999 4.糖质量浓度在0~70 μg/mL线性较好.
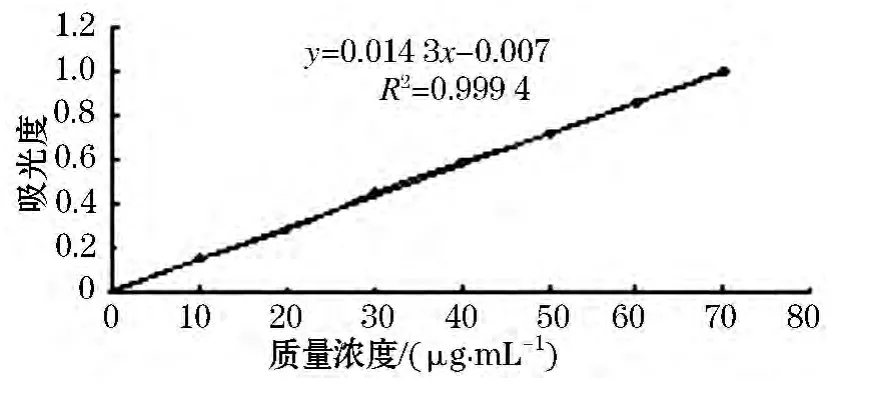
图3 葡萄糖标准曲线
2)糖质量浓度测定结果
CSPSⅠC中糖质量浓度结果如表2所示,CSPSⅠC平均糖质量浓度为82.83%,远高于野西瓜粗多糖38.60%的糖质量浓度,表明经除蛋白、色素和小分子后,所得的CSPSⅠC糖质量浓度较高.

表2 野西瓜粗多糖及CSPSⅠC糖质量浓度测定
3)CSPSⅠC糖质量浓度测定方法学考察
经方法学考察,稳定性较高,RSD=0.17%,精密度较好 RSD=0.17%,重复性较好,RSD=3.34%.
2.1.5 CSPSⅠC糖醛酸质量浓度测定结果
1)葡萄糖醛酸标准曲线
葡萄糖醛酸标准曲线如图4所示.其线性回归方程为 y=0.003 7x -0.003 3,相关系数 R2=0.999 7.糖质量浓度在0 ~100 μg/mL 线性较好.
2)CSPSⅠC中葡萄糖醛酸质量浓度测定结果
CSPSⅠC中葡萄糖醛酸质量浓度结果如表3所示,平行检测3次,经计算,CSPSⅠC平均糖质量浓度为23.59%.
3)CSPSⅠC葡萄糖醛酸质量浓度测定方法学考察
经方法学考察,稳定性较好(RSD=0.95%),精密度较好(RSD=0.60%),重复性较好(RSD=3.57%),表明该方法稳定可靠.
2.1.6 CSPSⅠC硫酸基质量浓度测定结果
1)硫酸基标准曲线
硫酸基标准曲线见图5所示.其线性回归方程为 y=0.004 7x -0.033 7,相关系数 R2=0.999 2.糖质量浓度在0~70 μg/mL线性较好.
2)硫酸基质量浓度测定结果
CSPSⅠC中硫酸基平行检测3次,质量浓度结果如表4所示,CSPSⅠC平均硫酸基糖质量浓度为16.22%.
3)CSPSⅠC硫酸基质量浓度测定方法学考察
经方法学考察,稳定性较高(RSD=1.02%),精密度较好(RSD=0.51%),重复性较好(RSD=1.54%),表明该方法稳定可靠.
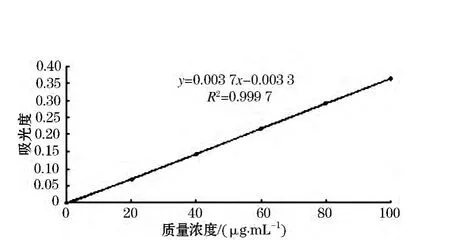
图4 葡萄糖醛酸标准曲线
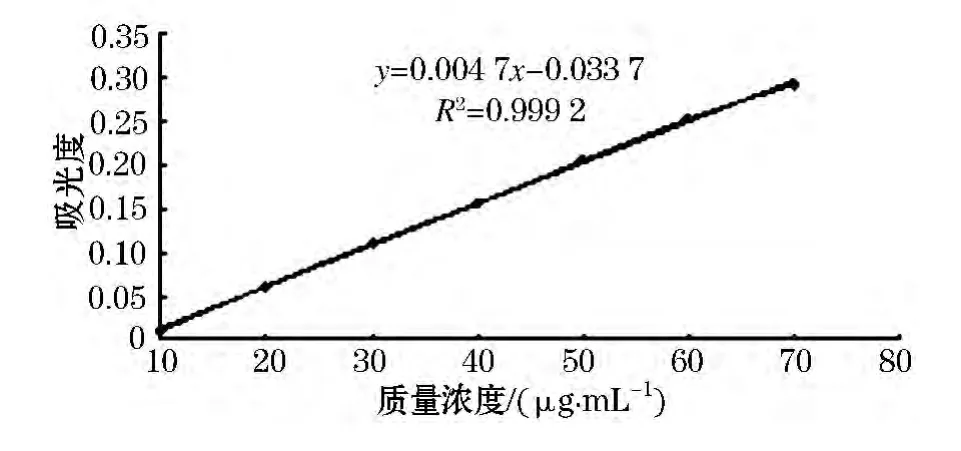
图5 硫酸基标准曲线
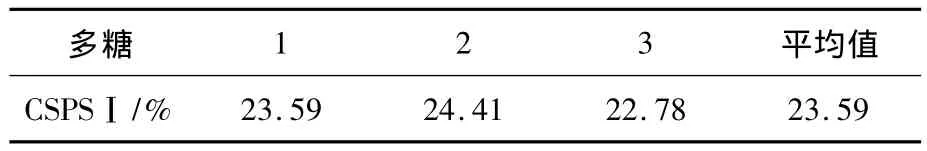
表3 CSPSⅠC葡萄糖醛酸质量分数
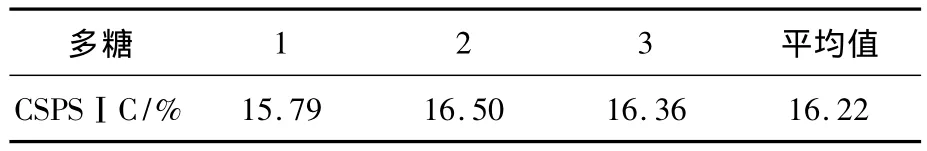
表4 CSPSⅠC硫酸基质量分数
2.1.7 CSPSⅠC相对分子质量测定结果
根据公式分别计算出的不同葡聚糖对应lgMW、Kav绘制标准曲线.如图6所示,其线性回归方程为 lgMW= -5.615 3Kav+7.957 3,相关系数 r=0.990.经计算,CSPSⅠC 相对分子质量为 6.23×107.
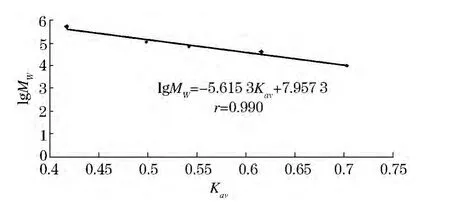
图6 分子质量测定标准曲线
3 结语
本文首先对野西瓜多糖进行了分离纯化,通过木瓜蛋白酶-Sevag联用法脱除多糖中蛋白,并通过双氧水及透析袋除去多糖色素和小分子杂质.采用分步醇沉法,得到10%醇沉部位多糖(CSPSⅠ)所占比例最大,以CSPSⅠ为DEAE-52柱层析对象,得到了糖质量浓度最高的组分CSPSⅠC,并通过纯度检测证实CSPSⅠC纯度较高.CSPSⅠC的糖质量分数、糖醛酸质量分数、硫酸基及相对分子质量测定结果分别为 82.83%、23.59%、16.22%、6.23×107,通过对野西瓜多糖分离纯化及质量浓度测定为继续深入研究野西瓜多糖奠定了基础.
[1]OKUTUCU B,ONAL S.Molecularly imprinted polymers for separation of various sugars from human urine[J].Talanta,2011,15(87):74-79.
[2]KUTKOWSKA J,TURSKA -SZEWCZUK A,JANCZAREK M,et al.Biological activity of(lipo)polysaccharides of the exopolysaccharide-deficient mutant Rt120 derived from Rhizobium leguminosarum bv.trifoliistrain TA1 [J].Biochemistry(Mosc).,2011,76(7):840-850.
[3]NARASAKI C T,MERTENS K,SAMUEL J E.Characterization of the GDP-D-Mannose Biosynthesis Pathway in Coxiella burnetii:The Initial Steps for GDP-β-D-Virenose Biosynthesis[J].PLoS One,2011;6(10):25514.
[4]DHEUR J,DENDANE N,DESMET R,et al.Polysaccharide microarrays:application to the identification of heparan sulphate mimetics[J].Methods Mol Biol.,2012,808:231 -240.
[5]王文平,郭祀远,李 琳,等.考马斯亮蓝法测定野木瓜多糖中蛋白质的质量浓度[J].食品研究与开发,2008,29(1):115-118.
[6]葛炳艳,杨 波.裙带菜多糖3种脱蛋白质方法的比较研究[J].食品与药品,2010,12(3):96-98.
[7]郁 玮,杨小明,刘伟民,等.苯酚-硫酸法测定无花果中多糖质量浓度的研究[J].食品科技,2009,34(10):256-260.
[8]孙平楠,周小玲,汪东风.一种水溶性茶多糖的单糖组成及糖醛酸质量浓度的测定[J].今日药学,2008,18(1):53-59.
[9]邱芳萍,张 玲,于 健.硫酸钡比浊法对鹿茸多糖中硫酸基质量浓度的测定[J].长春工业大学学报,2005,26(40):268-271.
[10]谢乐琼,于 蕾,于 娜,等.野西瓜正丁醇提取物中化学成分研究[J].哈尔滨商业大学学报:自然科学版,2011,27(5):659-661.

