重组中国明对虾溶菌酶包涵体的复性研究
张艳敏,李 成,武 瑶,梁雯靖,宋宛霖,姚 鹏,丛丽娜,刘志文
(大连工业大学 生物工程学院,辽宁 大连 116034)
0 引 言
对虾溶菌酶是一种能水解致病菌中黏多糖的碱性酶,可以与带负电荷的病毒蛋白直接作用形成复合物,抵御侵入机体的病毒和细菌,是对虾机体先天免疫系统中的重要防御因子[1]。与其他利用E.coli表达系统生产的重组蛋白一样,重组对虾溶菌酶在表达过程中也会形成不溶的、无生物活性的包涵体。目前,重组对虾溶菌酶包涵体的复性方法主要有稀释复性、透析复性、超滤复性等[2]。然而,关于重组蛋白复性后高回收率、高活性和高纯度的报道不多,特别是层析法复性包涵体蛋白的研究较少。亲和层析法复性包涵体蛋白不但可以实行纯化和复性同时进行,同时固相介质作为分子伴侣可以减少蛋白的错误折叠和聚合,并且可以实现大规模的工业生产[3]。因此,本实验运用稀释复性和亲和层析复性对重组对虾溶菌酶包涵体进行处理,并对2种方法复性的重组蛋白进行比较,以期为进一步深入研究对虾溶菌酶包涵体复性提供有益的借鉴。
1 材料与方法
1.1 菌 种
重组中国明对虾(Fenneropenaeuschinensis)溶菌酶基因工程菌pET30a(+)-FcLys/Rosetta(DE3),由本实验室构建并保藏。
1.2 方 法
1.2.1 裂解菌体
挑取pET30a(+)-FcLys/Rosetta(DE3)菌株,过夜活化后,按1%的接种量接种于含100μg/mL Kan的LB液体培养基中,37℃、160r/min培养至OD600达0.6~0.7(约3h),加入0.5mmol/L IPTG,低温(28℃)诱导培养4h。离心收集菌体并于-20℃冻管保存。
用含有1%Triton X-100的磷酸盐缓冲液(PBS)重悬冻融后的菌体,将其置于冰浴中超声破碎(功率300W;破碎/间隔1s/3s)5min左右。低温高速离心,使大多数包涵体沉淀与可溶性蛋白分离,收集沉淀,弃上清液。
1.2.2 洗涤包涵体
由于脂体及破碎的部分细胞膜及膜蛋白与包涵体沉淀粘连在一起,在溶解包涵体沉淀之前,一定要洗涤包涵体。在洗涤缓冲液(50mmol/L Tris-HCl,0.5mol/L NaCl,2%Triton X-100,2mmol/L EDTA,2mol/L 尿素,pH 8.0)中,超声洗涤包涵体沉淀(超声功率300W,破碎/间隔1s/3s)约 5min。低温高速离心(4 ℃,12 000r/min),弃上清,取沉淀。重复此步骤,将沉淀在洗涤缓冲液中再洗涤一次。
1.2.3 溶解包涵体
将洗涤后的包涵体加入到20mL溶解缓冲液 中 (50mmol/L Tris-HCl,8mol/L 尿 素,0.5mol/L NaCl,2mmol/Lβ-巯基乙醇),于摇床上25℃、100r/min震动溶解4h,然后经4℃、12 000r/min离心10min,取上清,即得FcLys包涵体溶解液。
1.2.4 包涵体的稀释复性
取一定量的包涵体溶解液,加入不含尿素的包涵体复性缓冲液 (50mmol/L Tris-HCl,0.5mol/L NaCl,2mmol/L β-巯基乙醇,1mmol/L谷胱甘肽,0.2mmol/L氧化性谷胱甘肽,1mmol/L CaCl2),将体系中尿素的浓度稀释到4mol/L,将该反应置于4℃静止8h。再加入复性缓冲液将体系的尿素浓度降至3mol/L,并于4℃静止8h。最后再加入复性缓冲液将尿素浓度降至2mol/L,同样置于4℃静止8h。将该复性液放入透析袋中依次在不含尿素的复性缓冲液中和PBS中透析处理。
1.2.5 包涵体的亲和层析复性
将5倍柱体积的结合缓冲液(20mmol/L Na3PO4,0.5mol/L NaCl,20mmol/L 咪唑,pH 8.0)以1mL/min的体积流量通过1mL的Ni2+亲和层析柱来平衡柱子。将包涵体溶解液经0.45μm滤膜过滤除去大分子杂质,以体积流量0.5mL/min经过被结合缓冲液结合过的柱子。再分别用含4、3、2mol/L尿素的复性缓冲液依次通过Ni2+柱,以体积流量0.5mL/min各流经柱子4h,使重组蛋白在Ni2+柱上复性。用洗脱缓冲液(500mmol/L 咪唑,50mmol/L Tris-Hcl,300mmol/L NaCl)以体积流量1mL/min将目的蛋白从亲和层析柱上洗脱下来。将收集到样品在PBS中透析处理。
1.2.6 亲和层析复性的条件优化
1.2.6.1 蛋白上样量对复性的影响
分别取0.1、0.2、0.4、0.6mL包涵体变性溶液上样,复性缓冲液体积流量为0.5mL/min,复性后用0.5mol/L咪唑缓冲液进行洗脱,洗脱液在PBS缓冲液中透析,Bradford法测蛋白浓度。
1.2.6.2 复性液pH对复性的影响
取200μL变性蛋白溶液上样,复性缓冲液体积流量为0.5mL/min。复性液pH选为6.5、7.0、7.5、8.0、8.5、9.0。复性后按照“1.2.6.1”方法进行洗脱、透析、测蛋白浓度。
1.2.6.3 温度对复性的影响
取200μL变性蛋白溶液上样,复性缓冲液体积流量为0.5mL/min,复性温度选在10、25℃。复性后按“1.2.6.1”方法进行洗脱、透析、测蛋白浓度。
1.2.7 分析方法
蛋白浓度根据Bradford法进行测定[4]。通过Bandscan 5.0软件分析蛋白纯度。
1.2.8 复性蛋白的生物活性检测
取本实验室保存的革兰阳性菌溶壁微球菌(M.lysodeikticus)、金黄色葡萄球菌(S.aureus)和革兰阴性菌副溶血弧菌(Vibrioparahaemolyticus)、铜绿假单胞菌(Pseudomonasaeruginosa)作为指示菌,用透析液PBS作为对照,采用琼脂平板扩散法[5]检测复性重组蛋白FcLys的抑菌活性。在制备好的琼脂平板上放置牛津杯,牛津杯中加入0.2mL透析后的重组蛋白FcLys,将平板放在培养箱中30℃培养24h,实验重复3次,测量抑菌圈直径,结果取平均值。
2 结果与讨论
2.1 包涵体的收集和洗涤
发酵完成后,菌体经离心、沉淀被超声破碎,再次离心,经SDS-PAGE电泳检测,上清液中无明显的重组FcLys蛋白(图1Line 3),重组FcLys蛋白主要以包涵体形式存在于沉淀中(图1Line 4)。本实验采用 Triton X-100、EDTA 和尿素联合洗涤法,经2次洗涤,有效地去除了包涵体中的杂质,如脂类、脂多糖、核酸、杂蛋白等,提高了目的蛋白纯度,有利于之后的复性过程。同时,随着洗涤次数的增加,目的蛋白的损失量也越来越多,因此要根据实际情况确定适宜的洗涤次数。
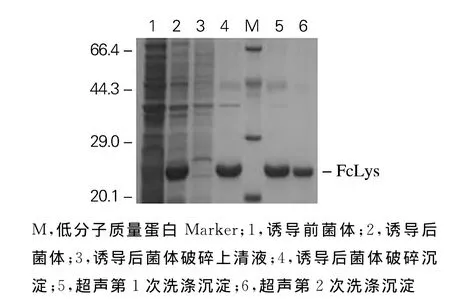
图1 重组FcLys蛋白的表达及洗涤Fig.1 Expression and washing of recombinant FcLys
2.2 复性方法比较
通过稀释复性和亲和层析复性对包涵体进行处理,得到复性成功的重组蛋白FcLys,电泳检测如图2(Line 2,Line 3)。根据Bradford法来测定蛋白浓度从而得出蛋白回收率,通过Bandscan软件来分析蛋白纯度。由表1可知,亲和层析复性得到的FcLys蛋白在蛋白纯度和蛋白回收率方面明显优于稀释复性。

图2 复性后重组FcLys蛋白SDS-PAGE检测Fig.2 Identification of recombinant FcLys by SDS-PAGE

表1 FcLys蛋白2种复性方法的比较Tab.1 Comparison of two methods of FcLys protein refolding
2.3 复性包涵体蛋白的生物活性检测
通过表2可知,经稀释复性和亲和层析复性得到的重组蛋白FcLys对革兰阳性菌溶壁微球菌和金黄色葡萄球菌均有抑菌效果,对革兰阴性菌则无抑菌效果。而作为对照的透析液PBS对所有指示菌均没有抑菌效果。亲和层析复性得到的重组蛋白对金黄色葡萄球菌的活性要比稀释复性得到的重组蛋白的活性高26.3%,并且对溶壁微球菌的抑菌活性,前者比后者高25%。
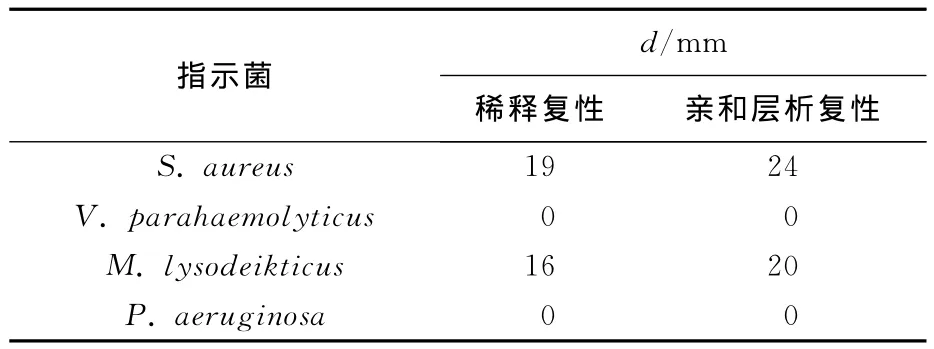
表2 重组FcLys蛋白抑菌活性检测Tab.2 Antimicrobial activities of the recombinant FcLys
2.4 亲和层析复性影响蛋白回收率的因素
2.4.1 蛋白上样量对复性的影响
当上样量为0.1、0.2、0.4、0.6mL时,蛋白的回收效率分别为36.2%、22%、16%和12%。由此可见,随着上样量的增加,复性蛋白回收率降低。因在亲和层析柱上的蛋白,在复性过程中会形成聚集体,随着蛋白浓度增加,聚集机会增大,导致复性效率会降低。蛋白上样量越低,越有利于复性,但浓度过低,不利于蛋白的回收,并影响产量,应用中要根据实际情况选择合适的上样量。
2.4.2 复性液pH对复性的影响
如图3,包涵体复性的最适pH为8.0左右。偏中性条件下,重组蛋白中半胱氨酸侧链上的巯基较稳定,不利于二硫键形成。实验表明,弱碱环境有利于包涵体复性,但过高的pH又会加快二硫键的形成,导致错配,形成沉淀,降低回收效率。
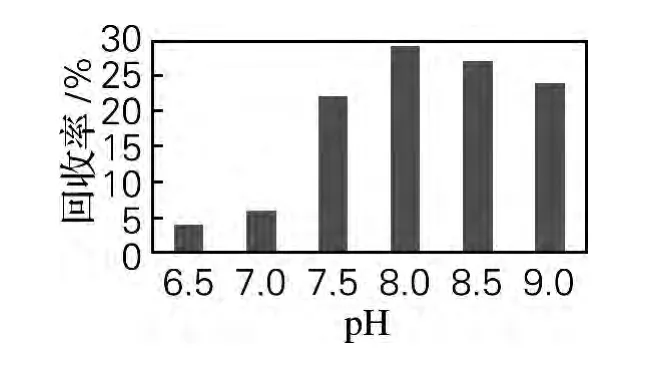
图3 pH对蛋白回收率的影响Fig.3 Effect of pH on the yield of the recombinant FcLys refolding
2.4.3 温度对复性的影响
在10℃复性时,蛋白回收率为24.5%,在25℃复性时,蛋白回收率为33.6%。说明温度越高,复性效率就越好。因为蛋白和固相介质结合,即使温度升高,分子运动也受到限制,不会像稀释复性那样易形成聚集体,提高温度,加快了复性速度,从而提高复性效率。但温度不能超过酶的最适温度,否则酶会发生不可逆变性,从而失去活性。
3 结 论
中国明对虾溶菌酶在大肠杆菌表达系统中,主要以包涵体形式表达。经含有8mol/L尿素的溶解缓冲液处理后,FcLys包涵体变性溶解。通过比较稀释复性法和亲和层析复性法对包涵体复性产率的影响,结果发现,亲和层析复性明显优于稀释复性,具有更高的蛋白复性产率,并且得到的可溶性蛋白回收率也要高于许多相关虾类文献报道(表3)。在亲和层析复性实验中,通过优化了上样量、pH和温度3种因素发现,较低浓度的蛋白复性液在pH 8.0的缓冲体系下,降低上样量并提高环境温度,会有效提高复性效率。亲和层析复性得到高纯度、可溶的重组对虾溶菌酶蛋白对革兰氏阳性菌金黄色葡萄球菌和溶壁微球菌均具有高效的抑菌活性。这些结果为进一步研究对虾溶菌酶的性质和功能奠定了基础。

表3 相关对虾溶菌酶包涵体研究的比较Tab.3 Comparison of inclusion body of shrimp lysozymes
[1]GRINDE B,JOLLES J,JOLLES P.Purification and characterization of two lysozyme from rainbow trout[J].European Journal of Biochemistry,1988,173(2):167-273.
[2]赵喜红,何小维,李文美,等.大肠杆菌表达包涵体蛋白体外复性研究进展[J].食品工业科技,2010,31(6):379-383.
[3]郭立安,耿信竽.蛋白的色谱复性及同时纯化[J].生物工程学报,2000,16(6):661-666.
[4]BRADFORD M M.A rapid and sensitive for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry,1976,72(1):248-254.
[5]SUPUNGUL P,RIMPHANITCHAYAKIT V,AO-KI T,et al.Molecular characterization and expression analysis of a c-type and two novel muramidasedeficient i-type lysozymes fromPenaeusmonodon[J].Fish and Shellfish Immunology,2010,28(3):490-498.
[6]卜兴江,杜欣军,周文杰,等.中国对虾溶菌酶基因克隆,重组表达与性质分析[J].生物工程学报,2008,25(5):723-732.
[7]杨杰,丛丽娜,夏涛,等.日本对虾c型溶菌酶的高效重组表达及产物分析[J].生物技术通报,2012(6):99-105.
[8]郑清梅,叶星,白俊杰,等.斑节对虾溶菌酶基因克隆及序列分析[J].水生生物学报,2004,28(4):413-417.
[9]张海波,谭洪新,王兴强,等.凡纳滨对虾溶菌酶基因在大肠杆菌中的表达和活性检测[J].海洋科学,2009,33(1):48-53.

