镉胁迫对不同镉富集能力海水养殖贝类抗氧化能力的影响
——以扇贝和菲律宾蛤仔为例
赵艳芳,吴继法,翟毓秀,宁劲松,盛晓风,丁海燕,尚德荣,*
1. 中国水产科学研究院黄海水产研究所,青岛266071 2. 青岛市黄岛区海洋与渔业局,青岛 266400
镉胁迫对不同镉富集能力海水养殖贝类抗氧化能力的影响
——以扇贝和菲律宾蛤仔为例
赵艳芳1,吴继法2,翟毓秀1,宁劲松1,盛晓风1,丁海燕1,尚德荣1,*
1. 中国水产科学研究院黄海水产研究所,青岛266071 2. 青岛市黄岛区海洋与渔业局,青岛 266400
为研究具有不同镉(Cd)富集能力的扇贝和菲律宾蛤仔在相同镉胁迫环境下的抗氧化能力反应的差异,将2种贝类于0.05 mg·L-1Cd环境中暴露10 d,分别于第0天、2天、4天、6天、8天、10天分别取样检测内脏团中SOD、CAT、GPx、GST酶活性和GSH含量,同时分析内脏团中Cd的含量。结果表明,对于Cd胁迫组,扇贝和菲律宾蛤仔内脏团中SOD和CAT酶活反应相似,均呈先被诱导后被抑制的规律,且2种贝类的SOD和CAT活性差异较小。2种贝类内脏团中GSH含量、GST和GPx活性变化差异较大:扇贝内脏团中GSH含量显著降低(p<0.05),GST和GPx活性均在第2天和第4天时处于显著诱导状态(p<0.05),从第6天时处于抑制状态,而菲律宾蛤仔内脏团中GSH含量、GST和GPx活性在Cd暴露期间无显著变化,且2种贝类间比较,扇贝内脏团中GSH含量和GST活性在整个实验期间始终显著高于菲律宾蛤仔(p<0.05),GPx活性从第4天开始高于菲律宾蛤仔;对于无镉污染的对照组,扇贝和菲律宾蛤仔内脏团中SOD、CAT和GPx活性无显著差异,但扇贝内脏团中GSH含量和GST活性显著高于菲律宾蛤仔,其中前者GSH含量约为后者的22倍。研究同时表明在相同镉环境下扇贝内脏团对Cd的富集浓度和富集速率均远高于菲律宾蛤仔。本研究明确了2种贝类在相同镉环境下的抗氧化反应的差异,推断出扇贝内脏团中高含量的GSH以及较高的GST和GPx活性可能在扇贝高富集、高耐受Cd方面起重要作用。
镉;扇贝;菲律宾蛤仔;抗氧化能力;镉富集能力
镉(cadmium, Cd)是一种易在生物体内蓄积且难代谢的有害元素,被美国毒物管理委员会(ATSDR)列为第6位危及人类健康的有毒物质。镉广泛存在于自然环境中,也可通过食物链传递,对消费者的身体健康造成威胁。大洋中镉的浓度很低(0.01~0.25 μg·L-1),近岸海域镉的浓度可达5.38 μg·L-1[1]。双壳贝类能够从环境中富集高浓度的镉。但是不同贝类具有不同的富集能力,如扇贝对镉的富集能力约是蛤仔的10倍甚至更高[2],而且扇贝在正常环境中也能积累高浓度的镉[3-5]。相同环境中双壳贝类对重金属的富集能力不同可能是由于其对镉具有不同的富集能力和解毒策略。目前已有研究指出,扇贝能够富集高浓度的镉,可能是由于扇贝对镉具有较高的消化吸收率、同化利用率和释放速率[6-8],以及具有有效的解毒策略包括溶酶体的区隔化作用、与磷酸盐颗粒的共沉淀及与金属硫蛋白(metallothioneins, MT)结合等[3]。
重金属镉对水生生物的毒性作用机制之一是造成生物体内的过氧化胁迫,在长期进化中,需氧生物发展了防御过氧化损害的酶系统,在生理状态下,由代谢产生的活性氧可为抗氧化防御系统所控制,机体抗氧化防御系统中的一些成分会改变,从而使机体免受氧化伤害[9]。由自由基介导的生物体内的氧化损伤是镉离子毒性效应的主要体现。其过氧化胁迫主要有2种方式:直接诱导生物体内产生活性氧(ROS)、自由基代谢物;间接降低生物体清除氧自由基的能力。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)、谷胱甘肽S-转移酶(GST)等抗氧化物酶能够清除ROS和多种自由基,在生物体解毒机制中发挥着至关重要的作用[10-11]。因此,笔者推测2种具有不同镉富集能力的贝类的抗氧化反应肯定存在重要差异。本实验试图通过比较研究扇贝和菲律宾蛤仔在相同镉胁迫环境下的抗氧化反应差异,从抗氧化能力角度解释2种贝类对镉的蓄积和耐受能力差异。本研究选择的抗氧化反应指标包括SOD、CAT、GPx、GST活性以及谷胱甘肽(GSH)含量。
1 材料与方法(Materials and methods)
1.1 实验材料
扇贝(Chlamys farreri)和菲律宾蛤仔(Ruditapes philippinarum)于2012年10月取自青岛一贝类养殖厂。扇贝平均壳高(5.8±0.34) cm,壳长(5.5±0.26) cm,菲律宾蛤仔平均壳高(2.1±0.26) cm,壳长(3.0±0.28) cm,在60 L玻璃缸中用自然海水暂养1周,保持水体连续充气,每日换水1次,水温(20.0±1.0) ℃,pH=8.0,自然光照。
1.2 实验设计
镉胁迫实验养殖容器为无毒白色塑料周转箱565 mm×420 mm×300 mm,将每个实验容器中加入30 L自然海水,根据实验生物个体大小差异,分别随机放入扇贝和菲律宾蛤仔各30和150只。
CdCl2(CdCl2·2.5H2O)为分析纯,购自国药集团化学试剂有限公司。首先将其配制成1 g·L-1母液,再稀释至实验所需浓度。镉的实验浓度为0.05 mg·L-1。取样时间分别为0、2、4、6、8和10 d。各处理组每个实验容器分别取栉孔扇贝6只个体,菲律宾蛤仔30只个体。空白对照组为在不添加镉离子的正常自然海水,实验期间不投饵,每天定时换水,实验养殖条件同暂养条件,并每天检查贝的存活情况。
1.3 样品制备
随机从Cd胁迫处理组和空白对照组中取出活贝进行解剖。迅速取出内脏团,用滤纸吸净表面水分,称取5.000 g组织即刻放入-80 ℃冰箱冷冻保存。
1.4 指标测定方法
SOD、CAT、GPX、GST活性和GSH含量测定采用南京建成生物工程研究所试剂盒方法测定。蛋白质含量测定采用南京建成生物工程研究所试剂盒测定方法-考马斯亮蓝法(Bradford法)测定。
1.5 镉含量分析
称取2.000 g内脏团试样于100 mL玻璃消化管中,加入混合酸(V(硝酸)∶V(高氯酸)= 4∶1)浸泡过夜后,用控温消化炉消化,同时做试剂空白对照。试样中Cd含量采用石墨炉原子吸收(Perkin Elmer, AA600)测定。
1.6 数据处理
试验结果用平均值±标准差(Mean±SD)表示,实验数据用Duncan' s多重比较法将各处理组进行比较,并利用SPSS 16.0统计分析软件,采用单因素方差分析(One-Way ANOVA)进行统计,当p<0.05时,认为差异显著。
2 结果(Results)
2.1 扇贝和菲律宾蛤仔内脏团中Cd含量
在0.05 mg·L-1Cd胁迫下,扇贝和菲律宾蛤仔内脏团中Cd含量变化趋势见表1。从表中可见,2种贝类内脏团均对Cd有显著富集作用。对于空白对照组,扇贝内脏团中Cd含量为6.89 μg·g-1(湿重),约为菲律宾蛤仔内脏团中含量的43倍。在Cd暴露实验期间内,2种贝类内脏团中Cd的含量一直呈上升趋势,并且镉含量相对于暴露时间呈强正相关关系(扇贝组:R2=0.9868,p<0.01;菲律宾蛤仔组:R2=0.9663,p<0.01)。暴露2、4、6、8和10 d后,扇贝内脏团对Cd的富集速率分别为1.46、1.74、1.52、1.42、1.49 μg·(g·d)-1,菲律宾蛤仔内脏团对Cd的富集速率分别为0.037、0.059、0.12、0.17、0.19 μg·(g·d)-1。因此,在相同Cd浓度环境下,扇贝内脏团对Cd的富集速率远大于菲律宾蛤仔。
2.2 Cd对扇贝和菲律宾蛤仔SOD活性的影响
2种贝类内脏团SOD的活性变化趋势相似,均呈先诱导后抑制的规律,并且在胁迫4 d后达到最高。另外,空白对照组中,2种贝类内脏团SOD的活性相似(p>0.05)。第4天和第8天,扇贝中SOD活性显著高于菲律宾蛤仔(p<0.05),其余时间点2种贝类内脏团的SOD活性均相似(p>0.05)。
2.3 Cd对扇贝和菲律宾蛤仔CAT活性的影响
Cd胁迫下扇贝和菲律宾蛤仔CAT活性的变化见图2,可知2种贝类的CAT活性变化趋势相同,且与SOD活性变化规律相似(见图1),均呈先诱导后抑制的趋势,胁迫4 d后CAT活性达到最高。空白对照组中,2种贝类内脏团CAT的活性无显著差异(P>0.05),且均是在第4天和第8天,扇贝中CAT活性显著高于菲律宾蛤仔(p<0.05),其余取样时间点2种贝类的CAT活性相似(p>0.05)。

表1 扇贝和菲律宾蛤仔内脏团中Cd含量Table 1 Cd contents in visceral mass of Chlamys farreri and Ruditapes philippinarum
注:Cd含量单位为μg·g-1(湿重)。
Note: the unit of Cd content is μg·g-1, wet weight.
2.4 Cd对扇贝和菲律宾蛤仔GST活性的影响
Cd胁迫对2种贝类内脏团中GST活性的影响见图3,从图中可见,扇贝内脏团中GST活性在暴露4 d内处于显著诱导状态,第4天时达到最高为629.5 U·mg-1prot,约是空白对照组的2倍,随后逐渐被抑制,10 d后,降至空白对照组水平(p>0.05)。而对于菲律宾蛤仔,在整个实验期间,GST活性变化较小。

图1 Cd胁迫对扇贝和菲律宾蛤仔内脏团SOD活性的影响注:图中不同小写字母表示p<0.05差异显著。Fig. 1 SOD activity in the visceral mass of C. farreri and R. philippinarum under 0.05 mg·L-1 cadmium exposureNote: the different small letters indicate a significant difference at p<0.05.

图2 Cd胁迫对扇贝和菲律宾蛤仔内 脏团CAT活性的影响注:图中不同小写字母表示p<0.05差异显著。Fig. 2 CAT activity in visceral mass of C. farreri and R. philippinarum under 0.05 mg·L-1 cadmium exposureNote: the different small letters indicate a significant difference at p<0.05.
另外在整个暴露实验期间,扇贝内脏团中GST的活性均显著性高于菲律宾蛤仔(P<0.05)。扇贝空白对照组的GST活性(303 U·mg-1prot)约为菲律宾蛤仔对照组(157 U·mg-1prot)的2倍。
2.5 Cd对扇贝和菲律宾蛤仔GPx活性的影响 0.05 mg·L-1Cd胁迫下,扇贝内脏团GPx活性的活性变化规律(见图4)与GST的活性变化规律相似,在第2天和第4天时处于显著诱导状态(p<0.05),第4天时活性达到最高值为100 U·mg-1prot,约为空白对照组(30.2 U·mg-1prot)的3倍多。对于菲律宾蛤仔,整个暴露实验期间,GPx活性变化较小,未达到差异显著水平(p>0.05)。另外,不同于GST活性,空白对照组2种贝类内脏团GPx活性无显著差异(p>0.05)。

图3 Cd胁迫对扇贝和菲律宾蛤仔内脏团GST活性的影响注:图中不同小写字母表示p<0.05差异显著。Fig. 3 GST activity in visceral mass of C. farreri and R. philippinarum under 0.05 mg·L-1 cadmium exposureNote: the different small letters indicate a significant difference at p<0.05.

图4 Cd胁迫对扇贝和菲律宾蛤仔 内脏团GPx活性的影响注:图中不同小写字母表示p<0.05差异显著。Fig. 4 GPx activity in visceral mass of C. farreri and R. philippinarum under 0.05 mg·L-1 cadmium exposureNote: the different small letters indicate a significant difference at p<0.05.
2.6 Cd对扇贝和菲律宾蛤仔GSH含量的影响
图5显示了Cd胁迫下,扇贝和菲律宾蛤仔内脏团GSH含量的变化。从图中可见,2种贝类GSH含量变化存在很大差异。首先,对于空白对照组,扇贝内脏团中GSH含量为78 nmol·mg-1prot,而菲律宾蛤仔内脏团中GSH含量为3.5 nmol·mg-1prot,前者约为后者的22倍。且在暴露实验期间,扇贝内脏团中的GSH含量始终显著高于菲律宾蛤仔(p<0.05)。0.05 mg·L-1Cd胁迫下,扇贝中GSH含量急剧下降,2 d后降至24.5 nmol·mg-1prot,且6 d后降至最低点。而对于菲律宾蛤仔,空白对照组和Cd暴露组在实验期间内脏团中GSH含量无显著变化(p>0.05)。2.7 扇贝和菲律宾蛤仔抗氧化能力比较
为了更清楚地表明扇贝和菲律宾蛤仔2种贝类,在相同浓度Cd胁迫下的抗氧化能力反应差异,将扇贝空白组的4种抗氧化酶(SOD、CAT、GST、GPx)酶活性和GSH含量定义为100%,比较扇贝Cd处理组不同时间点、菲律宾蛤仔空白和Cd处理组不同时间点的抗氧化酶活性和GSH含量的相对变化。结果见表2,从表中可见,对于SOD和CAT,扇贝和菲律宾蛤仔的酶活性高低和变化规律均相似;对于GST,相对于扇贝空白组,菲律宾蛤仔空白组仅占52%,并且在Cd胁迫下,菲律宾蛤仔的GST活性
最高升至73%,至暴露结束后,降至空白组水平(53%),而扇贝在Cd胁迫下,GST活性于暴露4 d时升高了2倍(207.6%),约为菲律宾蛤仔(73.3%)的3倍;对于GPx,在Cd胁迫4 d时,扇贝处理组最高为菲律宾蛤仔的2倍;对于GSH含量,相对于扇贝空白组,菲律宾蛤仔空白组的GSH含量仅占4.5%,在Cd胁迫下,扇贝内脏团中GSH含量急剧下降,胁迫2 d时即下降至空白组31.3%,胁迫6 d时,含量约占空白组的13.8%,而菲律宾蛤仔于Cd胁迫10 d后,GSH含量最高,占扇贝空白对照组的5.0%。

图5 Cd胁迫对扇贝和菲律宾蛤仔内脏团GSH含量的影响注:图中不同小写字母表示P<0.05差异显著。Fig. 5 GSH content in visceral mass of C. farreri and R. philippinarum under 0.05 mg·L-1 cadmium exposureNote: the different small letters indicate a significant difference at p<0.05.
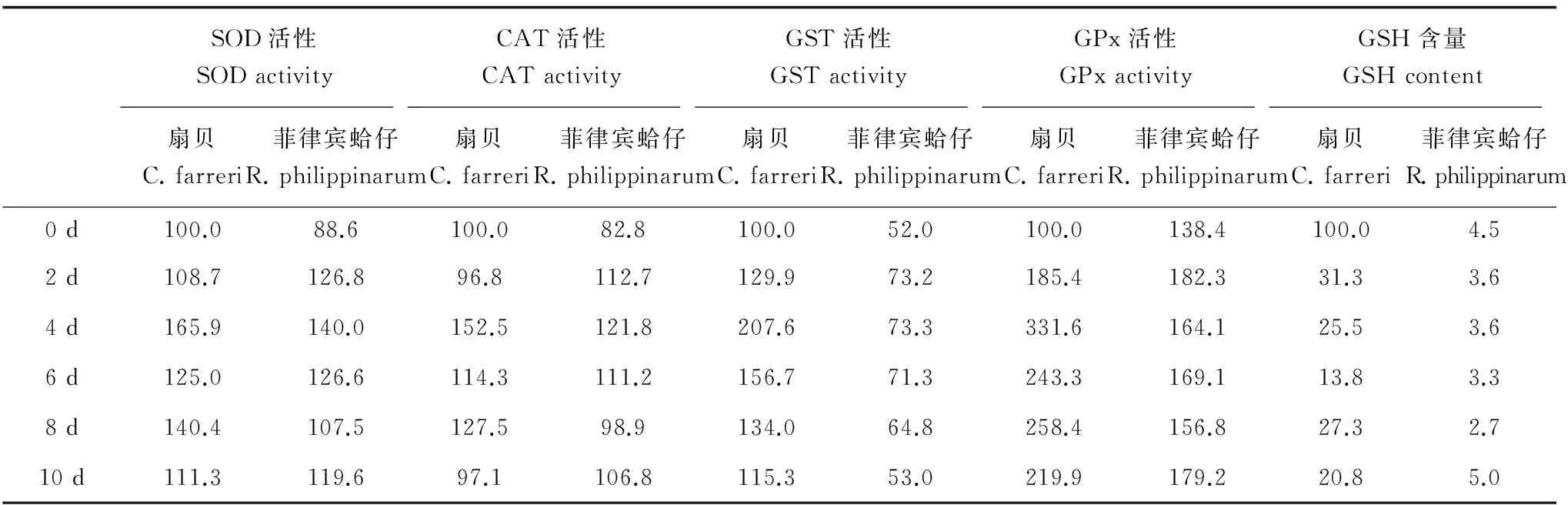
表2 扇贝和菲律宾蛤仔4种抗氧化酶活性和GSH含量随暴露时间的相对变化(%)Table 2 Comparative changes in activities of four antioxidant enzymes and GSH content for both C. farreri and R. philippinarum with the extension of exposure time (%)
3 讨论(Discussion)
海水水质标准GB 3097—1997的渔业标准中,Cd≤0.005 mg·L-1,已有研究表明0.005 mg·L-1Cd胁迫下,贝类组织中抗氧化酶在实验期间与对照组相比无显著变化,当镉浓度为标准浓度的10倍时,贝类产生抗氧化反应[12]。本研究目的是试图通过比较2种贝类对镉的抗氧化能力差异,来解释2种贝类对镉蓄积和耐受能力的差异,因此选择0.05 mg·L-1Cd为胁迫实验浓度。
实验分析了空白对照组2种贝类中Cd的蓄积量,结果显示扇贝整贝中Cd含量为9.7 mg·kg-1,约为菲律宾蛤仔整贝中Cd含量(0.27 mg·kg-1)的35倍(数据未展示),再次证明了扇贝在相同无镉污染的正常环境中能够在体内积累高浓度的镉,含量约为蛤仔的几十倍[2-5]。扇贝内脏团中Cd含量为6.89 mg·kg-1,菲律宾蛤仔内脏团中Cd含量为0.16 mg·kg-1,因此,内脏团是扇贝和菲律宾蛤仔富集镉的主要组织。0.05 mg·L-1Cd胁迫10 d,2种贝类内脏团中的镉均没有达到饱和,内脏团中镉含量与暴露时间呈显著正相关关系。这可能是由于在慢性镉暴露初期,镉进入贝类体内后首先进入内脏团,与MT、GSH、Cys等巯基化合物结合[13],使其毒性降低,并蓄积在内脏团内,同时导致内脏团内SOD、CAT、GST、GPX等抗氧化系统指标发生变化。
3.1 扇贝和菲律宾蛤仔在相同Cd环境下抗氧化反应相同之处
在0.05 mg·L-1Cd胁迫下,2种贝类内脏团中SOD和CAT活性变化趋势相似,均呈先诱导后抑制的变化规律。已有研究表明,Cd2+能够诱导机体产生大量的自由基和活性氧(ROS),引起脂质、蛋白质和DNA的氧化变性,诱发组织损伤[14]。SOD是生物体内唯一一种以自由基为底物的抗氧化酶,它可将超氧阴离子自由基歧化为H2O2和O2,以达到清除体内活性氧自由基的作用,避免细胞受到氧自由基的损害[15-16]。CAT是机体抗氧化体系中又一关键非特异抗氧化酶,能够清除SOD催化活性氧自由基所产生的H2O2,使其转化为对机体无毒的H2O和O2,它们的作用都是使机体免受氧自由基的攻击[17]。本实验中,0.05 mg·L-1Cd胁迫下,扇贝和菲律宾蛤仔内脏团中SOD活性均先升高后降低,在暴露4 d后,SOD活性达到最高值,显示其被显著诱导,之后呈下降的趋势,但是相对于空白组仍然被显著诱导。随着SOD活性增加,CAT活性也有增加的趋势,并在暴露4 d后达到最大值,之后逐渐降低。这说明,扇贝与菲律宾蛤仔在Cd的胁迫下,机体会产生适应性诱导效应,当较少的镉离子进入机体并诱导其产生活性氧自由基时,SOD的活性升高以清除氧自由基,从而促使机体内H2O2含量升高。H2O2的升高诱导了机体内CAT的基因表达及活力,提高了H2O2的分解速率。但是如果暴露时间增加,扇贝和菲律宾蛤仔体内镉离子含量升高,大量的不能被及时清除的氧自由基被诱发产生,SOD、CAT的合成途径被阻碍或者其亚单位间的装配发生了改变,从而导致其活力开始下降,这种低浓度时的“毒物兴奋效应”与在真鲷、长江华溪蟹、褶纹冠蚌、尖紫蛤、泥蚶等生物中观察到的结果类似[12,18-21]。另外,在无镉污染的正常环境中,扇贝和菲律宾蛤仔内脏团中2种酶的活性无显著差异,本研究结果可以推断出SOD、CAT酶可能不是影响2种贝类具有不同积累和耐受镉能力差异的主要因素。
3.2 扇贝和菲律宾蛤仔在相同Cd环境下抗氧化反应不同之处
在0.05 mg·L-1Cd环境下,扇贝和菲律宾蛤仔内脏团中的GSH含量、GST和GPx活性变化存在一定差异。在整个实验期间,扇贝内脏团中GSH含量和GST酶活均显著高于菲律宾蛤仔(p<0.05)。而且在无镉污染的正常环境下,扇贝内脏团中的GSH含量和GST酶活性显著高于菲律宾蛤仔(p<0.05)。其中差异最大的是GSH含量,前者约为后者的22倍。GSH是细胞内含巯基最丰富的物质,参与物质代谢和转运过程,对各种外源(如重金属)和内源性物质(如活性氧)对细胞的损害都有保护作用[22]。GSH可在GST的催化下与细胞内的有害物质结合,生成无毒或毒性小的GSH硫结合物,具有消除体内脂质过氧化物和解毒的双重作用。有研究表明生物体由于污染的暴露产生适应性诱导反应而使GSH含量升高,也可以由于污染的毒性作用产生中毒反应而使GSH含量降低[23]。如比萨茶蜗牛(Theba pisana)受到以Cu2+为主要成分的农药刺激后,消化腺中的GSH含量出现了明显下降,并且刺激的Cu2+浓度越高,GSH含量下降越明显[24]。在镉胁迫下,扇贝内脏团中GSH含量先下降后上升,暴露开始GSH含量下降说明大量的GSH与Cd结合,以降低Cd对生物体的毒性,随着暴露时间的延长,GSH含量逐渐升高,说明扇贝产生可适应性诱导效应。而GST酶活性则呈现与GSH相反的变化趋势,这是由于GSH是GST的自然底物,Cd胁迫初期,大量GST酶被激活,催化GSH与Cd2+及过氧化物结合,使生物体内还原性的GSH消耗增加。而对于菲律宾蛤仔,Cd暴露组的蛤仔内脏团中GSH含量、GST酶活性无论是与空白对照组比较,还是不同暴露时间点之间比较,变化均较小,且均显著低于扇贝。
GPx也是生物体普遍存在的一种抗氧化物酶。在GST的催化下,GPx作为亲电子集团的结合靶位点,可以降低内、外源毒物对机体产生的毒性作用,也可以分解过氧化氢和过氧化物,清除细胞内脂质和有机过氧化反应的产物,阻断脂质过氧化连锁反应,达到保护细胞膜机构和功能完整的作用,与CAT酶在细胞内具有相似的作用[25]。本实验也证明了扇贝中GPx活性变化趋势与CAT变化趋势相似,均于4 d后活性达到最高,约为空白对照组的3倍,并且显著高于菲律宾蛤仔。Cd2+还可以与GPx分子中的Se形成Cd-Se复合物,破坏GPx活性中心Se代半胱氨酸的机构,一方面降低了镉离子对机体的毒性影响,达到解除重金属镉毒性的目的;另一方面使GPx分子活性中心的Se代半胱氨酸结构被破坏而使GPx活性降低[26]。因此,随着暴露镉时间的增加,扇贝中GPx活性逐渐降低。但是菲律宾蛤仔内脏团中GPx活性在Cd暴露期间变化不显著,并且空白对照组中2种贝类GPx活性无显著差异。
生物体对逆境反应存在的差异与抗氧化系统的整体活力相关。重金属污染地区的贝类、鱼、沙蚕等的抗氧化能力远远强于未污染地区的个体[27-29],重金属污染地区的植物的抗氧化反应强于非污染地区的植物[30]。如砷/镉超富集植物比非砷/镉超富集植物具有更强的抗氧化能力,且较强的抗氧化能力在超富集植物解毒、蓄积重金属的机制中起关键作用[31-33]。本研究结果明确显示,在相同Cd暴露环境下,扇贝的抗氧化能力比菲律宾蛤仔强,主要表现在扇贝内脏团具有较高的GSH含量、GST活性和GPx活性,且扇贝对镉的富集量和富集速率远高于菲律宾蛤仔。因此可以推断扇贝中较高的GSH含量、GST和GPx活性可能使扇贝具有较高的Cd解毒能力,也可能是其具有高富集Cd能力的一个主要原因。
[1] Ferreira A C, Costa A C S, Korn M G A. Preliminary evaluation of the cadmium concentration in seawater of the Salvador city, Brazil [J]. Microchemical Journal, 2004, 78(1): 77-83
[2] Pigeot J, Miramand P, Guyot T, et al. Cadmium pathways in an exploited intertidal ecosystem with chronic cadmium inputs (Marennes-Oleron, Atlantic coast, France) [J]. Marine Ecology Progress Series, 2006, 307: 101-114
[3] Bustamante P, Miramand P. Subcellular and body distributions of 17 trace elements in the variegated scallop Chlamys varia from the French coast of the Bay of Biscay [J]. Science of the Total Environment, 2005, 337(1-3): 59-73
[4] Bustamante P, Miramand P. Interspecific and geographical variations of trace element concentrations in Pectinidae from European waters [J]. Chemosphere, 2004, 57(10): 1355-1362
[5] Pan K, Wang W X. The subcellular fate of cadmium and zinc in the scallop Chlamys nobilis during waterborne and dietary metal exposure [J]. Aquatic Toxicology, 2008, 90(4): 253-260
[6] Metian M, Warnau M, Oberhänsli F, et al. Interspecific comparison of Cd bioaccumulation in European Pectinidae (Chlamys varia and Pecten maximus) [J]. Journal of Experimental Marine and Ecology, 2007, 353(1): 58-67
[7] Wang W X, Rainbow P S. Comparative approaches to understand metal bioaccumulation in aquatic animals [J]. Comparative Biochemistry and Physiology - Part C, 2008, 148(4): 315-323
[8] Ng T Y T, Wang W X. Detoxification and effects of Ag, Cd and Zn pre-exposure on metal uptake kinetics in the clam Ruditapes philippinarum [J]. Marine Ecology Progress Series, 2004, 268: 161-172
[9] 刘慧, 王晓蓉, 张景飞, 等. 铜及其EDTA配合物对彭泽鲫鱼肝脏抗氧化系统的影响[J]. 环境化学, 2004, 23(3): 263-267
Liu H, Wang X R, Zhang J F, et al. Effects of copper and complex (Cu-EDTA) on the antioxidant system of Carassius auratos liver [J]. Environmental Chemistry, 2004, 23(3): 263-267 (in Chinese)
[10] Zikic R V, Stajn A S, Saicic Z S, et al. The activities of superoxide dismutase, catalase and ascorbic acid content in the liver of goldfish (Carassius auratus gibelio Bloch) exposed to cadmium [J]. Physiological Research, 1996, 45(6): 479-481
[11] Almeidaa J A, DinizbY S, Marquesa S F G, et al. The use of the oxidative stress responses as biomarkers in Nile tilapia (Oreochromis niloticus) exposed to in vivo cadmium contamination [J]. Environment International, 2002, 27(8): 673-679
[12] 邓思平, 赵云涛, 朱春华, 等. 镉对尖紫蛤抗氧化酶活性及脂质过氧化的影响[J]. 水生生物学报, 2012, 36(4): 689-695
Deng S P, Zhao Y T, Zhu C H, et al. Effect of cadmium on the antioxidant enzyme activity and lipid perosidation in Sanguinolaria acuta [J]. Acta Hydrobiologica Sinica, 2012, 36(4): 689-695 (in Chinese)
[13] 赵艳芳, 尚德荣, 宁劲松, 等. 体积排阻高效液相色谱-电感耦合等离子体质谱法测定海产贝类中镉的形态[J]. 分析化学, 2012, 40(5): 681-686
Zhao Y F, Shang D R, Ning J C, et al. Speciation analysis of cadmium in marine bivalves by size exclusion chromatography-high performance liquid chromatography-inductively coupled plasma mass spectrometry [J]. Chinese Journal of Analytical Chemistry, 2012, 40(5): 681 -686 (in Chinese)
[14] Hegedus A, Erdei S, Horvath G. Comparative studies of H2O2detoxifying enzymes in green and greening barley seedlings under cadmium stress [J]. Plant Science, 2001, 160(6): l085-l093
[15] Pastor A, Medina J, Delramo J. Determination of lead in treated crayfish Procambarus clarkia: Accumulation in different tissues [J]. Bulletin of Environmental Contamination and Toxicology, 1988, 41(3): 412-418
[16] Papadimitriou E, Loumbourdis N S. Exposure of the frog Rana ridibunda to copper impact on two biomarkers, lipid peroxidation, and glutathione [J] . Bulletin of Environmental Contamination and Toxicology, 2002, 69(6): 885-891
[17] Sarkar S, Yadav P, Trivedi R. Cadmium induced lipid peroxidation and the status of the antioxidant system in rat tissues [J]. Journal of Trace Elements in Medicine and Biology, 1995, 9(3): 144-149
[18] Mourente G, Diaz-Salvago E, Bell J G. Increased activities of hepatic antioxidant defense enzymes in juvenile gilthead sea bream (Sparus aurata L.) fed dietary oxidized oil: Attenuation by dietary vitamin E [J]. Aquaculture, 2002, 214 (1-4): 343-361
[19] 李琰, 吴丹, 文春根, 等. 镉对褶纹冠蚌抗氧化因子的影响[J]. 农业环境科学学报, 2012, 31(11): 2108-2113
Li Y, Wu D, Wen C G, et al. Effects of cadmium on the antioxidant factors of Cristaria plicata [J]. Journal of Agro-Environment Science, 2012, 31(11): 2108-2113 (in Chinese)
[20] 金芬芬, 徐团, 秦圣娟, 等. 镉对长江华溪蟹肝胰腺线粒体抗氧化酶活力和脂质过氧化水平的影响[J]. 水生生物学报, 2011, 35(6): 1019-1024
Jin F F, Xu T, Qin S J, et al. Effects of cadmium on hepatopancreas mitochondrial antioxidant enzyme activity and lipid peroxidation level in freshwater carb Sinopotamon yangtsekiense [J]. Acta Hydrobilogica Sinica, 2011, 35(6): 1019-1024 (in Chinese)
[21] 孙彬, 葛奇伟, 陆慧贤, 等. 镉对泥蚶抗氧化酶系统的影响[J]. 生态科学, 2011, 30(4): 383-388
Sun B, Ge Q W, Lu H X, et al. Effects of cadmium exposure on antioxidant enzyme system of Tegillarca granosa [J]. Ecological Science, 2011, 30(4): 383-388 (in Chinese)
[22] 惠天朝, 王家刚, 朱荫湄. 镉对罗非鱼肝组织中GSH代谢的影响[J]. 浙江大学学报: 农业与生命科学版, 2001, 27(5): 575-578
Hui T C, Wang J G, Zhu Y M. Effects of Cd on hepatic GSH metabolism in Tilapia nilotica [J]. Journal of Zhejiang University: Agriculture and Life Science, 2001, 27(5): 575-578 (in Chinese)
[23] Stebbing A R. Hormesis-the stimulation of growth by low levels of inhibitors [J]. Science of the Total Environment, 1982, 22(3): 213-234
[24] EI-Gendy K S, Radwan M A, Gad A F. In vivo evaluation of oxidative stress biomarkers in the land snail, Theba pisana exposed to copper based pesticides [J]. Chemosphere, 2009, 77(3): 339-344
[25] 闫博, 王兰, 李涌泉, 等. 镉对长江华溪蟹肝胰腺抗氧化酶活性的影响[J]. 动物学报, 2007, 53(6): 1121-1128
Yan B, Wang L, Li Y Q, et al. Effects of cadmium on hepatopancreatic antioxidant enzyme activity in a freshwater crab Sinopotamon yangtsekiense [J]. Acta Zoologica Sinica, 2007, 53(6): 1121-1128 (in Chinese)
[26] Iszard M B, Liu J, Klaassen C D. Effect of several metallothionein inducers on oxidative stress defense mechanisms in rats [J]. Toxicology, 1995, 104(1-3): 25-33
[27] Yildirim N C, Benzer F, Danabas D. Evaluation of environmental pollution at Munzur river of Tunceli applying oxidative stress biomarkers in Capoeta trutta (Heckel, 1843) [J]. The Journal of Animal and Plant Sciences, 2011, 21(1): 66-71
[28] Box A A, Sureda F, Galgani A, et al. Assessment of environmental pollution at Balearic Islands applying oxidative stress biomarkers in the mussel Mytilus galloprovincialis [J]. Comparative Biochemistry and Physiology Part C: Toxicology and Pharmacology, 2007, 146(4): 531-539
[29] Geracitano L A, Bocchetti R, Monserrat J M, et al. Oxidative stress responses in two population of Laeonereis acuta (Polychaeta, Nereididae) after acute and chronic exposure to copper [J]. Marine Environmental Research, 2004, 58(1): 1-17
[30] Kandziora C M, Nadgorska S A, Barczyk G. A comparative study of heavy metal accumulation and antioxidant responses in Vaccinium myrtillus L. leaves in polluted and non-polluted areas [J]. Environmental Science and Pollution Research, 2013, 20(7): 4920-4932
[31] Srivastava M, Ma L Q, Singh N, et al. Antioxidant responses of hyper-accumulator and sensitive fern species to arsenic [J]. Journal of Experimental Botany, 2005, 56(415): 1335-1342
[32] 谢飞, 王宏镔, 王海娟, 等. 砷胁迫对不同砷富集能力植物叶片抗氧化酶活性的影响[J]. 农业环境科学学报, 2009, 28(7): 1379-1385
Xie F, Wang H B, Wang H J, et al. Effects of arsenic stress on activities of antioxidant enzymes in the fronds of plants with different abilities to accumulate arsenic [J]. Journal of Agro-Environment Science, 2009, 28(7): 1379-1385 (in Chinese)
[33] 张军, 束文圣. 植物对重金属镉的耐受机制[J]. 植物生理与分子生物学学报, 2006, 32(1): 1-8
Zhang J, Shu W S. Mechanisms of heavy metal cadmium tolerance in plants [J]. Journal of Plant Physiology and Molecular Biology, 2006, 32(1): 1-8 (in Chinese)
◆
EffectsofCadmiumStressontheAntioxidantResponsesinTwoBiovalveswithDifferentAccumulationAbilitiesforCadmium:ACaseStudyontheScallopChlamysfarreriandtheClamRuditapesphilippinarum
Zhao Yanfang1, Wu Jifa2, Zhai Yuxiu1, Ning Jinsong1, Sheng Xiaofeng1, Ding Haiyan1, Shang Derong1,*
1. Yellow Sea Fishery Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China 2. Ocean and Fishery Bureau of Huangdao District of Qingdao City, Qingdao 266400, China
8 March 2013accepted25 June 2013
In order to find out the difference in the antioxidant responses in two bivalves (the scallop Chlamys farreri and the clam Ruditapes philippinarum) which have different abilities for accumulating cadmium (Cd), two bivalves were exposed to 0.05 mg L-1Cd for 2, 4, 6, 8 and 10 days. The activities of SOD, CAT, GPx and GST, the content of GSH and the concentration of cadmium in the visceral mass of two bivalves were analyzed. Results showed that for the treated groups, the activities of SOD and CAT in the two bivalves displayed similar response variability, which were induced firstly and then were inhibited during the period of 10 days. In addition, the activities of SOD and CAT were similar in two bivalves. However, GSH content, GST and GPx activities had great differences in two bivalves. The GSH content in C. farreri significantly decreased (p<0.05), while the GST and GPx activities were significantly induced on the second and fourth day (p<0.05), and were inhibited from the sixth day. In contrast, the GST and GPx activities, and GSH content in R. philippinarum had no significant changes. In addition, GSH content and GST activity in C. farreri were significantly higher than those of R. philippinarum during the 10-day exposure. The GPx activity in C. farreri was also higher (p<0.05) than that of R. philippinarum from the fourth day. For the control groups, the activities of SOD, CAT and GPx had no significant differences between C. farreri and R. philippinarum, while the GSH content and GST activity in C. farreri were much higher than that of R. philippinarum. Specifically, the GSH content in C. farreri was almost 22 times of that of R. philippinarum in the control groups. Moreover, C. farreri had higher Cd accumulation rate and concentration than those of R. philippinarum. It is found that the two bivalves with different abilities for accumulating Cd did show different responses in antioxidant systems under the same Cd-stress conditions. High content of GSH, and higher GST and GPx activities may help to explain the scallop C. farreri have higher ability to defense and detoxify the Cd than the clam R. philippinarum.
cadmium; Chlamys farreri; Ruditapes philippinarum; antioxidant defenses: Cd accumulation abilities
国家自然科学基金(41206101)
赵艳芳(1979-),女,博士,研究方向为有害重金属生物化学,E-mail: yanfang_z1979@163.com;
*通讯作者(Corresponding author),E-mail: shangdr@ysfri.ac.cn
10.7524/AJE.1673-5897.20130308004
赵艳芳,吴继法,翟毓秀,等. 镉胁迫对不同镉富集能力海水养殖贝类(扇贝和菲律宾蛤仔)抗氧化能力的影响[J]. 生态毒理学报, 2014, 9(2): 224-232
Zhao Y F, Wu J F, Zhai Y X, et al. Effects of cadmium stress on the antioxidant responses in two biovalves (the scallop Chlamys farreri and the clam Ruditapes philippinarum) with different abilities to accumulate cadmium [J]. Asian Journal of Ecotoxicology, 2014, 9(2): 224-232 (in Chinese)
2013-03-08录用日期2013-06-25
1673-5897(2014)2-224-09
X171.5
A
尚德荣(1960—),女,副研究员,主要研究方向为污染生物化学,发表学术论文20余篇。

