DCPTA对盐胁迫下玉米叶片渗透调节生理生化特征影响
魏湜,张翯,顾万荣,李晶,李改玲,焦健,曹鑫波,杨可攀
(1.东北农业大学农学院,哈尔滨150030;2.农业部东北地区作物栽培科学观测实验站,哈尔滨150030)
DCPTA对盐胁迫下玉米叶片渗透调节生理生化特征影响
魏湜1,2,张翯1,顾万荣1,2,李晶1,2,李改玲1,焦健1,曹鑫波1,杨可攀1
(1.东北农业大学农学院,哈尔滨150030;2.农业部东北地区作物栽培科学观测实验站,哈尔滨150030)
为明确DCPTA提高玉米幼苗耐盐性生理生化机制,采用Hoagland营养液水培试验,以‘先玉335’和‘丰禾1号’两类不同耐盐性玉米品种为材料,研究15 mg·L-1DCPTA对150 mmol·L-1NaCl胁迫下玉米幼苗生物量、叶片相对含水量、渗透调节及细胞膜稳定性的影响。结果表明,DCPTA显著增加盐胁迫下玉米幼苗鲜重、干重及株高,缓解盐胁迫对幼苗生长的抑制。盐胁迫下DCPTA处理的玉米叶片可溶性糖和可溶性蛋白含量增加,脯氨酸含量降低,叶片相对含水量提高。施用DCPTA后,与单一盐胁迫相比,‘先玉335’叶片MDA含量和相对电导率分别降低26.4%和26.0%,‘丰禾1号’分别降低31.3%和33.5%。外源DCPTA通过提高植株渗透调节能力,维持植株水分平衡,保护细胞膜结构和功能,可减轻盐胁迫对玉米幼苗的伤害。DCPTA对盐敏感型玉米品种效果更佳。
DCPTA;盐胁迫;植物生长调节剂;玉米;渗透调节
土壤盐渍化是作物产量受损重要原因之一,中国土壤盐渍化程度较高,尤其是在北方,已成为限制作物产量主要环境因素之一。黑龙江省西部盐碱地面积高达96.65×104hm2,其中轻度盐碱地面积为26.70×104hm2,占27.62%,主要分布在大庆及齐齐哈尔市南部地区[1]。因此,研究开发提高春玉米耐盐性措施能合理利用盐碱地,对指导玉米生产具有重大意义。
植物生长调节剂有显著、高效调节效应,已被广泛应用于农业生产。研究表明,植物生长调节剂能增强作物在盐胁迫下的适应能力[2-4]。叔胺类物质对植物生长发育有促进作用,2-(3,4-二氯苯氧基)-乙基-二乙胺(DCPTA)为其典型代表[5],有提高作物产量、改善品质、增强抗逆性作用[6],已逐步应用于蔬菜、花卉、林木及大田作物[7-8]。目前关于DCPTA增强作物抗逆性报道,主要集中在提高抗冷性与抗旱性上,原立地等研究表明适宜浓度DCPTA能有效保护低温胁迫下玉米叶片光合系统,使玉米幼苗叶片抗冷性提高[9]。朱恒光等发现,不同浓度DCPTA处理均能提高低温胁迫下玉米叶片可溶性糖和可溶性蛋白含量,降低相对电导率和MDA含量增长速率,减缓低温带来的氧化损伤,提高植株抗低温能力[10]。谢腾龙等研究表明,干旱胁迫下玉米幼苗叶片喷施DCPTA可抑制膜脂过氧化,能增强渗透调节能力,增加幼苗抗旱性[11]。
DCPTA与作物抗逆性关系及其作用机理研究至今仍是研究热点,但有关DCPTA对玉米苗期耐盐性研究国内外尚未见报道。本试验以耐盐性不同的两个寒地玉米品种幼苗为试材,探究盐胁迫下DCPTA对玉米幼苗生物量、叶片渗透调节物质含量及细胞膜稳定性影响,为DCPTA在玉米抗逆生产中的应用提供理论和实践依据。
1 材料与方法
1.1 材料与设计
供试品种为耐盐型‘先玉335’和盐敏感型‘丰禾1号’玉米品种。
2-(3,4-二氯苯氧基)-乙基-二乙胺(DCPTA)98%可湿性粉剂由郑州化工集团提供。
试验于2014年7~8月在东北农业大学农学院温室内进行。选取饱满、整齐一致种子经表面消毒后浸种催芽,待种子发芽后播于温室内装有蛭石的育苗盘中,自然光照培养,昼温25~30℃、夜温15~20℃。长至二叶一心期时,挑选生长一致幼苗,洗净根部蛭石后定植于装有1/2 Hoagland营养液(pH 6.2±0.1)的水槽内培养,水槽容量为15 L,槽内盛装14 L营养液,槽外裹双层黑色遮光布。
待幼苗三叶一心时进行处理,设置4个试验处理,各3次重复。①1/2Hoagland营养液栽培(CK);②1/2Hoagland营养液+15 mg·L-1DCPTA(DCPTA处理);③1/2 Hoagland营养液+150 mmol·L-1NaCl(NaCl处理);④1/2 Hoagland营养液+150 mmol·L-1NaCl+15 mg·L-1DCPTA(NaCl+ DCPTA处理)。
DCPTA浓度(15 mg·L-1)是基于预备试验筛选出的最适浓度,于盐胁迫前1 d将DCPTA施加到营养液中,进行DCPTA预处理。盐胁迫处理时,为防止盐冲击,先在营养液中加入50 mmol·L-1NaCl,直接将NaCl溶于营养液中,每12 h递增50 mmol·L-1NaCl,直至浓度达到150 mmol·L-1,此时为取样期的0 d。整个水培过程全程通气,每天调节pH至6.2±0.1,每2 d更换1次营养液。
分别于处理后0、1、2、3、4 d取样测定叶片相对含水量、MDA含量和相对电导率,于处理后第3天测定植株鲜重、干重、株高及渗透调节物质含量。
1.2 测定指标及方法
1.2.1 鲜重干重及株高
每处理选取5株幼苗,蒸馏水快速冲洗,用滤纸吸干表面水分,称鲜重。之后将材料在烘箱中105℃杀青15 min,再在80℃下烘干至恒重,称量干重。鲜重干重均以5株幼苗平均值表示。株高以幼苗地上部分最高点拉直高度为准。
1.2.2 渗透调节物质含量
取幼苗倒三位叶片,称取0.5 g,液氮冷冻后立即置于-80℃保存,测定各指标。脯氨酸含量采用茚三酮比色法测定[12]。可溶性蛋白含量采用考马斯亮蓝G-250染色法测定[12]。可溶性糖含量采用蒽酮法测定[13]。
1.2.3 叶片相对含水量
取5株幼苗所有叶片,蒸馏水清洗,滤纸吸干表面水分后称鲜重,再将叶片在蒸馏水中浸泡6 h,称取饱和鲜重,之后放入烘箱80℃烘干至恒重,称量干重。叶片相对含水量(%)=(鲜重-干重)/(饱和鲜重-干重)×100%。
1.2.4MDA含量测定
取0.5 g叶片,采用TBA显色法测定[14]。
1.2.5 相对电导率测定
叶片经去离子水冲洗干净,用滤纸吸净表面水分,将叶片避开主脉切割成大小一致叶块,称取0.5 g,放入试管中,加入20 mL去离子水,浸泡10 h后用DDS-307A型电导率仪测得电导率R1,再将试管放入沸水浴中煮沸20 min,冷却至室温,测得电导率R2。相对电导率(%)=R1/R2×100%。
1.3 数据分析
试验数据采用DPS7.05软件LSD法进行标准差及显著性比较分析,绘图采用软件Microsoft Excel 2003。
2 结果与分析
2.1DCPTA对盐胁迫下幼苗生长的影响
盐胁迫下植物最敏感的生理响应是生长抑制、生物量降低。由表1可知,盐胁迫下,玉米幼苗整株鲜重、整株干重和株高均显著低于对照,表明NaCl对植株生长有明显抑制作用,‘丰禾1号’受抑制程度大于‘先玉335’。施加DCPTA促进盐胁迫下植株生物量积累,幼苗鲜重、干重和株高均显著提高,‘先玉335’分别提高15.8%、14.8%和10.1%,‘丰禾1号’分别提高21.3%、17.2%和18.3%,对‘丰禾1号’促进效果更明显。此外,单独DCPTA处理对植株生长存在促进作用。

表1DCPTA对盐胁迫下幼苗生物量影响Table 1Effects of DCPTA on biomass of maize seedlings under salt stress
2.2DCPTA对盐胁迫下幼苗叶片相对含水量变化的影响
叶片相对含水量可反映植物叶片水分亏缺状况,是衡量叶片水分状况的重要指标。由图1可知,幼苗叶片在盐胁迫1、2、3、4 d后,叶片相对含水量明显下降,‘先玉335’分别降低9.1%、12.5%、15.7%、22.0%,‘丰禾1号’分别降低12.3%、18.0%、22.9%、31.5%。经DCPTA预处理幼苗,在盐胁迫1、2、3、4 d后,‘先玉335’叶片RWC分别提高4.3%、5.3%、7.2%、10.6%,‘丰禾1号’分别提高6.9%、11.4%、14.7%、20.4%,表明DCPTA延缓盐胁迫下叶片RWC下降,效果为‘丰禾1号’>‘先玉335’。此外,对照条件下施加DCPTA,叶片相对含水量增加。
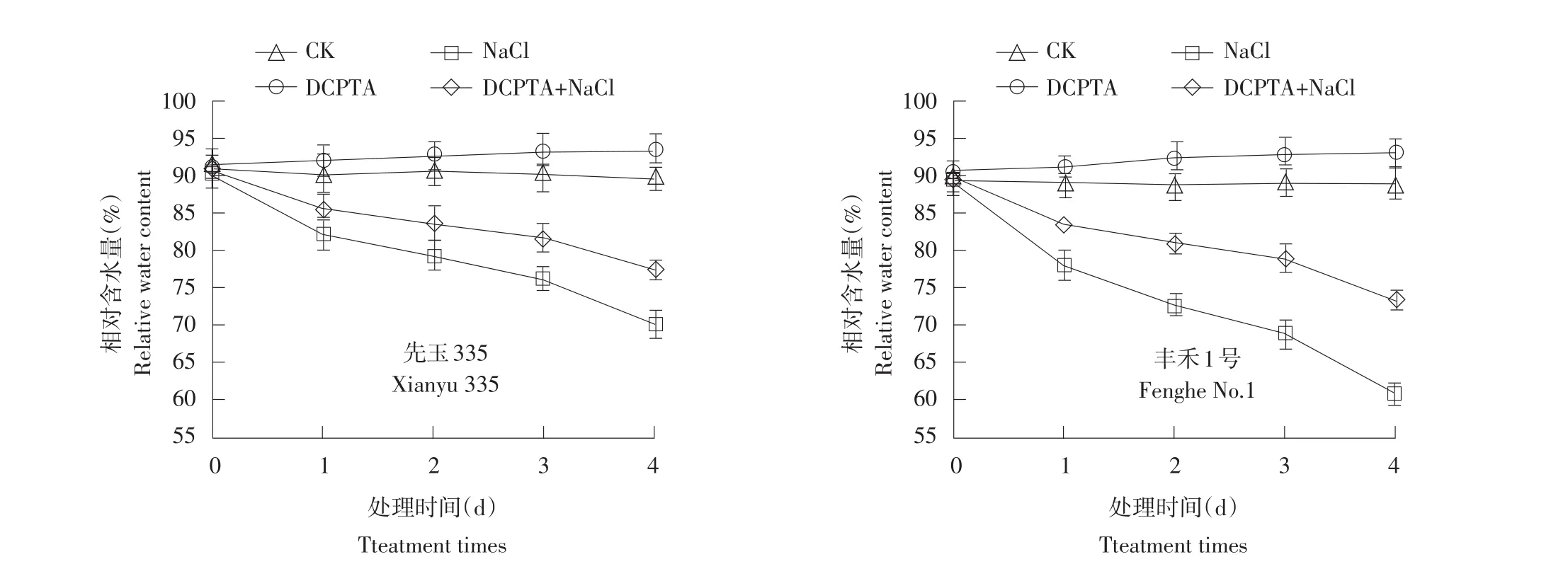
图1DCPTA对盐胁迫下玉米幼苗叶片相对含水量(RWC)变化影响Fig.1Effects of DCPTA on variation of relative water content of maize seedling leaves under salt stress
2.3DCPTA对盐胁迫下叶片渗透调节物质含量的影响
脯氨酸、可溶性糖和可溶性蛋白是三种重要渗透调节物质,有助于调节逆境条件下植株渗透压,防止细胞脱水。图2(以第3天为例)表明,盐胁迫下幼苗叶片中脯氨酸含量显著高于对照,‘先玉335’和‘丰禾1号’分别高出51.5%和77.6%。施加DCPTA后,‘先玉335’和‘丰禾1号’叶片脯氨酸含量分别比盐胁迫处理显著降低17.9%和23.0%。与对照相比,DCPTA处理后,叶片脯氨酸含量降低,‘丰禾1号’叶片脯氨酸含量显著下降。
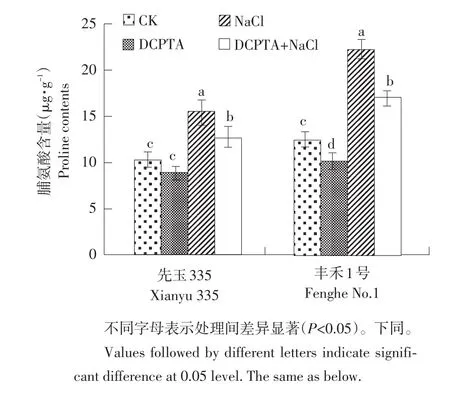
图2DCPTA对盐胁迫下叶片脯氨酸含量影响Fig.2Effects of DCPTA on proline contents in maize seedling leaves under salt stress
DCPTA对盐胁迫下叶片可溶性糖和蛋白含量的影响见图3、4。由图3、图4(均以第3天为例)可知,盐胁迫处理显著提高幼苗叶片可溶性糖和蛋白含量,‘先玉335’分别为对照的188.4%和126.0%,‘丰禾1号’分别为对照的170.3%和119.6%。盐胁迫下施加DCPTA进一步提高叶片可溶性糖和可溶性蛋白含量,‘先玉335’分别提高13.6%和10.7%,‘丰禾1号’分别提高23.8%和14.4%,‘丰禾1号’提高幅度均比‘先玉335’大。与对照相比,DCPTA处理后叶片可溶性糖含量显著增加,但对可溶性蛋白含量无显著影响。
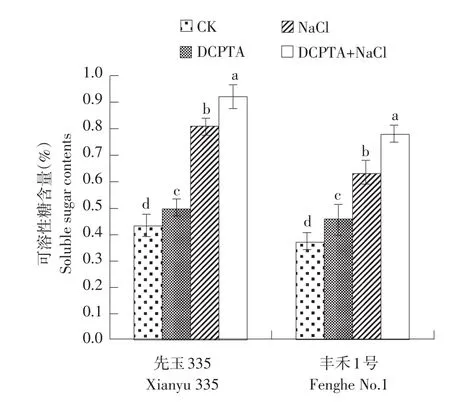
图3DCPTA对盐胁迫下叶片可溶性糖含量影响Fig.3Effects of DCPTA on soluble sugar contents in maize seedling leaves under salt stress

图4DCPTA对盐胁迫下叶片可溶性蛋白含量影响Fig.4Effects of DCPTA on soluble protein contents in maize seedling leaves under salt stress
2.4DCPTA对盐胁迫下叶片细胞膜稳定性的影响
MDA是膜脂过氧化主要产物之一,其含量可以判断膜系统受损程度和植物抗逆性。由图5可知,盐胁迫处理使幼苗叶片MDA含量显著升高,随处理时间延长MDA含量呈增加趋势,且‘丰禾1号’升高幅度大于‘先玉335’。盐胁迫下DCPTA处理显著降低叶片MDA含量,在处理的1、2、3、4 d‘先玉335’分别降低16.3%、21.9%、25.9%、26.4%,‘丰禾1号’分别降低20.3%、27.5%、30.1%、31.3%,‘丰禾1号’降低幅度大于‘先玉335’。对照组在整个处理过程中叶片MDA含量变化不大,施加DCPTA后叶片MDA含量显著降低。
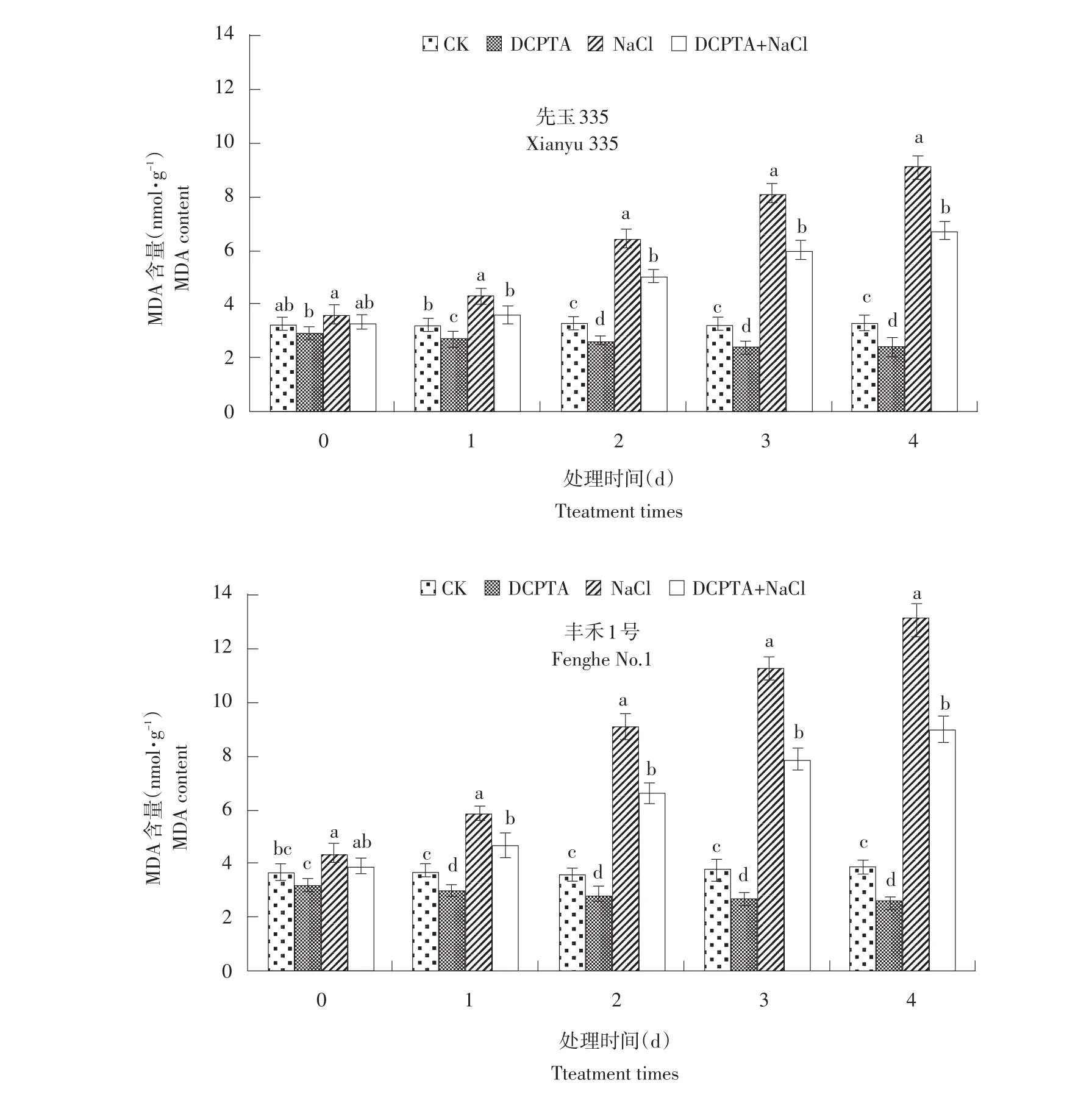
图5DCPTA对盐胁迫下玉米幼苗叶片MDA含量变化影响Fig.5Effects of DCPTA on variation of MDA content in maize seedling leaves under salt stress

图6DCPTA对盐胁迫下玉米幼苗叶片相对电导率变化的影响Fig.6Effects of DCPTA on variation of relative electrical conductivity of maize seedling leaves under salt stress
由图6可见,盐胁迫下幼苗叶片相对电导率增加,‘先玉335’和‘丰禾1号’分别在处理后第2天和第1天与对照差异达到显著水平,相对电导率随处理时间延长而增加,‘丰禾1号’增加幅度比‘先玉335’大。施加DCPTA能降低叶片相对电导率,与NaCl处理相比,‘先玉335’和‘丰禾1号’分别在处理后第2天和第1天显著下降,处理1、2、3、4 d‘先玉335’分别降低11.3%、16.9%、21.9%、26.0%,‘丰禾1号’分别降低14.9%、23.1%、27.5%、33.5%,‘丰禾1号’降低幅度更大。对照条件下,叶片相对电导率在处理期间无明显变化,DCPTA处理后叶片相对电导率降低。
3 讨论
生物量是植物对盐胁迫响应的综合体现及对盐胁迫的综合反应[15],是确定作物耐盐性的常用指标。以往研究表明,较高浓度盐胁迫会导致植株干重、鲜重及株高显著降低[16-17]。本试验结果表明,150 mmol·L-1盐胁迫下玉米幼苗生长量明显受到抑制,鲜重、干重及株高均显著降低,外源施用DCPTA减轻盐胁迫对幼苗生长的抑制,促进盐胁迫下幼苗生长,使幼苗鲜重、干重及株高显著增加,表明DCPTA有缓解盐胁迫伤害的作用。盐胁迫下,DCPTA处理效果与品种耐盐性有关,对耐盐性强的品种作用效果较小,而对耐盐性差的品种作用效果明显。非逆境条件下DCPTA能显著促进幼苗生长。
盐胁迫下许多植物具有一定渗透调节能力,维持叶片含水量,但植株在盐胁迫下仍然会表现出失水状况[18]。在本研究中,随盐胁迫时间延长,玉米幼苗叶片相对含水量显著下降,而使用DCPTA预处理的叶片相对含水量显著增加,‘丰禾1号’增加幅度大于‘先玉335’,表明DCPTA增加植株水分吸收,降低因盐胁迫造成的玉米幼苗水分亏缺,改善其水分状况,这也可能是DCPTA提高玉米耐盐性的重要途径之一,且DCPTA对耐盐性差的品种作用效果更好。对照条件下施加DCPTA叶片相对含水量增加,但与盐胁迫下施加DCPTA相比,增加幅度较小。
盐胁迫下外界渗透势较低,可导致植物细胞失水而造成生理性缺水,这时植物体内渗透调节起关键作用。脯氨酸、可溶性糖和可溶性蛋白是渗透调节过程三种重要的渗透调节物质。目前关于逆境下植物体内脯氨酸积累的机制存在两种观点:第一种认为,盐胁迫下脯氨酸大量积累是植物适应逆境的一种方式,有助于提高植物耐盐性[19];第二种则认为,脯氨酸是植物受到盐胁迫伤害的产物,脯氨酸积累量更应作为衡量盐胁迫伤害程度的指标[20]。本试验中,盐胁迫显著增加玉米幼苗叶片脯氨酸含量,耐盐性强品种增加幅度小于耐盐性差品种,盐胁迫下施加DCPTA叶片脯氨酸含量显著降低,表明DCPTA减少盐胁迫对幼苗伤害是脯氨酸含量下降的主要原因。盐胁迫下施加DCPTA,‘丰禾1号’脯氨酸含量降低幅度大于‘先玉335’,表明DCPTA缓解盐胁迫对幼苗伤害的效果表现为‘丰禾1号’>‘先玉335’。可溶性糖和可溶性蛋白有调节细胞渗透压,维持细胞含水量和膨压作用。本试验中,盐胁迫处理的玉米幼苗叶片可溶性糖和可溶性蛋白含量显著提高,施加DCPTA进一步提高盐胁迫下叶片可溶性糖和可溶性蛋白含量,可以使细胞质浓度增加,细胞渗透势降低,有利于维持叶片相对含水量,一定程度上减轻盐胁迫对玉米幼苗的伤害。
植物在适于生长的环境中,体内活性氧产生与清除处于一种动态平衡状态,盐胁迫会破坏这种平衡体系,导致自由基大量积累,引起膜脂肪酸中不饱和键被氧化分解,产生MDA[21],MDA能与酶蛋白发生链式反应聚合,使膜系统变性,膜受到损伤和破坏[22],当质膜的选择透性因逆境伤害而明显改变时,细胞内大量电解质渗透到膜外,致使组织浸泡液电导率升高,因此MDA含量和电导率是反映氧化损害程度强弱的两个重要指标[23]。本试验结果表明,盐胁迫下玉米幼苗叶片MDA含量和相对电导率显著升高,生物膜受到伤害,这与前人研究结果相符[24-25],施加DCPTA降低盐胁迫下叶片MDA含量和相对电导率,‘丰禾1号’降低幅度大于‘先玉335’,表明DCPTA减轻玉米幼苗叶片细胞质膜过氧化程度,维持质膜选择透性,说明DCPTA提高植物抗盐胁迫能力与其对质膜的保护作用有关,对耐盐性差品种作用效果更明显。对照条件下施加DCPTA,叶片MDA含量和相对电导率含量降低,与顾万荣等研究结果一致[8]。
4 结论
盐胁迫下,玉米幼苗生长受到抑制,叶片相对含水量下降,膜质过氧化加剧,膜透性增大。外源DCPTA有效促进盐胁迫下不同耐盐性玉米品种幼苗生长,提高幼苗渗透调节能力,使叶片相对含水量保持在较高水平,降低MDA和相对电导率,减轻盐胁迫对细胞膜伤害,说明DCPTA能诱导玉米耐盐性提高,缓解盐胁迫对幼苗伤害。DCPTA对提高盐敏感型玉米品种耐盐性效果更好。
[1]尤海洋.黑龙江省轻度盐碱地苜蓿的种植方法和田间管理[J].养殖技术顾问,2014(6):98.
[2]张凤银,陈禅友,胡志辉,等.外源水杨酸对盐胁迫下菜豆种子萌发和幼苗生理特性的影响[J].东北农业大学学报,2013,44 (10):39-43.
[3]孙珊珊,安勐颍,韩烈保,等.外源2,4-表油菜素内酯对多年生黑麦草幼苗耐盐性的影响[J].草地学报,2014,22(5):1045-1050.
[4]温福平,张檀,张朝晖,等.赤霉素对盐胁迫抑制水稻种子萌发的缓解作用的蛋白质组分析[J].作物学报,2009,35(3):483-489.
[5]Gausman H W,Burd J D,Quisenberry J,et al.Effect of 2-diethylaminoethyl-3,4-dichlorophenylether(DCPTA)on cotton plant(Gossypium Hirsutum)growth and phenology[J].Biotechnology, 1985,3(3):255-257.
[6]Keithly J H,Yokoyama H,Gausm H W.Promotive effects of DCPTA on seedling development and growth of radish[J].Journal of the American Society for Horticultural Science,1992,117(2):294-297.
[7]叶秀莲,杨成根,贾琦,等.新型植物生长调节剂DCPTA的合成及应用研究[J].江苏农学院学报,1995,16(4):67-70.
[8]顾万荣,李召虎,翟志席,等.DCPTA和DTA-6对大豆和玉米苗期叶片内源激素与氧自由基代谢的影响[J].植物遗传资源学报,2009,10(2):300-305.
[9]原立地,顾万荣,孙继,等.DCPTA对低温胁迫下玉米幼苗叶片叶绿素含量及其荧光特性的影响[J].作物杂志,2012(5):63-67.
[10]朱恒光,顾万荣,王泳超,等.DCPTA对低温下玉米叶片生理生化特征的影响[J].核农学报,2015,29(3):549-556.
[11]谢腾龙,朱恒光,顾万荣,等.水分胁迫下DCPTA对寒地春玉米种子萌发及幼苗生长的影响[J].农业现代化研究,2015,36 (1):144-148.
[12]郝再彬,苍晶,徐仲.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2004.
[13]张宪政.作物生理研究法[M].北京:农业出版社,1992.
[14]邹琦.植物生理学实验指导[M].北京:中国农业出版社,2003.
[15]程玉静,郭世荣,张润花,等.外源硝酸钙对黄瓜幼苗盐胁迫伤害的缓解作用[J].西北植物学报,2009,29(9):1853-1859.
[16]赵莹,杨克军,赵长江,等.外源糖调控玉米光合系统和活性氧代谢缓解盐胁迫[J].中国农业科学,2014,47(20):3962-3972.
[17]孙丽娜,曲敏,任广涛,等.水杨酸对盐胁迫下黄瓜种子萌发和幼苗生长发育的影响[J].东北农业大学学报,2006,37(4):449-453.
[18]Munns R.Comparative physiology of salt and water stress[J]. Plant,Cell and Environment,2002,25(2):239-250.
[19]Nayyar H,Walia D P.Water stress induced proline accumulation in contrasting wheat genotypes as affected by calcium and abscisic acid[J].Biologia Plantarum,2003,46(2):275-279.
[20]DeLacerda C F,Cambraia J,Oliva M A,et al.Solute accumulation and distribution during shoot and leaf development in two sorghum genotypes under salt stress[J].Environmental and Experimental Botany,2003,49(2):107-120.
[21]曾韶西,王以柔,李美如.不同胁迫预处理提高水稻幼苗抗寒期间膜保护系统变化比较[J].植物学报,1997,39(4):308-314.
[22]孙富,杨丽涛,谢晓娜,等.低温胁迫对不同抗寒性甘蔗品种幼苗叶绿体生理代谢的影响[J].作物学报,2012,38(4):732-739.
[23]何文亮,黄承红,杨颖丽,等.盐胁迫过程中抗坏血酸对植物的保护功能[J].西北植物学报,2004,24(12):2196-2201.
[24]郭启芳,马千全,孙灿,等.外源甜菜碱提高小麦幼苗抗盐性的研究[J].西北植物学报,2004,24(9):1680-1686.
[25]季琳琳,吴中能,刘俊龙,等.NaCl胁迫对两种柳树幼苗生理特性的影响[J].东北农业大学学报,2014,45(1):77-82.
Effect of DCPTA on the physiological and biochemical characteristics of osmotic adjustment in maize seedling leaves under salt stress/WEI
Shi1,2,ZHANG He1,GU Wanrong1,2,LI Jing1,2,LI Gailing1,JIAO Jian1,CAO Xinbo1,YANG Kepan1
(1. School of Agriculture,Northeast Agricultural University,Harbin 150030,China;2.The Observation Experiment Station of the Ministry of Agriculture for Crop Cultivation Science in Northeast Area,Harbin 150030,China)
In order to make clear the physiological and biochemical mechanisms of DCPTA on salt resistant capability of maize seedlings,hydroponic experiments were performed with two different salt tolerance varieties‘Xianyu 335’and‘Fenghe No.1’to investigate the effects of 15 mg·L-1DCPTA on biomass,relative water content,osmotic adjustment and cell membrane stability of maize seedings under 150 mmol·L-1NaCl stress.The results showed that,DCPTA significantly increased fresh weight,dry weight and plant height of maize seedlings and alleviated growth inhibition under the condition of salt stress. DCPTA treatment under salt stress led to a increase in soluble sugar and soluble protein content,a decrease in proline content and an improvement in relative water content of maize leaves.The MDA content and relative conductivity of‘Xianyu 335’under DCPTA application were 26.4%and 26.0%lower than those under salt treatment,respectively,‘Fenghe No.1’were 31.3%and 33.5%lower,respectively.ExogenousDCPTA alleviated the salt stress damage to maize seedlings by enhancing the osmotic adjustment ability, maintaining the water balance and protecting cell membrane structure and function of seedling leaves. DCPTA has a better effect on salt-sensitive maize variety.
DCPTA;salt stress;plant growth regulator;maize;osmotic adjustment
S513
A
1005-9369(2015)09-0001-08
时间2015-9-23 9:38:09[URL]http://www.cnki.net/kcms/detail/23.1391.S.20150923.0938.010.html
魏湜,张翯,顾万荣,等.DCPTA对盐胁迫下玉米叶片渗透调节生理生化特征影响[J].东北农业大学学报,2015,46(9):1-8.
Wei Shi,Zhang He,Gu Wanrong,et al.Effect of DCPTA on the physiological and biochemical characteristics of osmotic adjustment in maize seedling leaves under salt stress[J].Journal of Northeast Agricultural University,2015,46(9):1-8.(in Chinese with English abstract)
2015-05-17
“十二五”农村领域国家科技支撑计划课题(2011BAD16B11);黑龙江省科技攻关项目(GA12B101-02);2015哈尔滨市科技创新人才研究专项青年后备人才计划(RC2015QN002083)
魏湜(1956-),男,教授,博士,博士生导师,研究方向为作物高产栽培生理生态。E-mail:weishi5608@163.com

