两株植物乳杆菌作为潜在益生菌的体外评价
孟祥晨,李雪,姚蕾,周金雨
(乳品科学教育部重点实验室,东北农业大学食品学院,哈尔滨150030)
两株植物乳杆菌作为潜在益生菌的体外评价
孟祥晨,李雪,姚蕾,周金雨
(乳品科学教育部重点实验室,东北农业大学食品学院,哈尔滨150030)
采用体外试验方法,评价两株植物乳杆菌KLDS1.0391与KLDS1.0706作为益生菌的潜在能力,包括对酸和胆盐的抗性、免疫活性以及安全性评价。采用活菌计数法测量其在低酸和胆盐条件下耐受性,采用MTT法观察不同剂量活性和热致死乳杆菌对小鼠脾脏淋巴细胞增殖能力影响,采用哥伦比亚血平板测定两株植物乳杆菌溶血性,采用K-B药敏纸片法测定其抗生素抗性。结果表明,两株植物乳杆菌均对酸和胆盐有较好耐受性;活性、热致死植物乳杆菌均能促进体外小鼠淋巴细胞增殖,表现出剂量依赖关系,活性植物乳杆菌作用效果较热致死乳杆菌更为明显;两株植物乳杆菌均无溶血性,对万古霉素与链霉素具有抗性。
植物乳杆菌;溶血性;抗生素抗性;胃肠道耐受性;淋巴细胞增殖
植物乳杆菌属于乳杆菌科乳杆菌属,因多数分离自植物得名[1]。在代谢过程中,植物乳杆菌能通过竞争性抑制作用在胃肠道内占位、定植,抑制致病菌对胃肠道侵害,调节肠道菌群平衡。菌株对胃肠道低酸、胆盐等不良环境耐受性是其发挥益生作用先决条件。作为一类人体有益菌群,植物乳杆菌不仅具有调节肠道菌群益生功能,还具有免疫调节功能,例如能调节脾细胞增殖能力以及影响Th1/Th2细胞平衡等[2-5]。食品工业生产中,植物乳杆菌已有较长使用历史[6],通常被认为是“安全的”[7],但有些植物乳杆菌存在溶血性、抗生素抗性等安全隐患[8-10],其安全性不容忽视。
植物乳杆菌KLDS1.0391分离自内蒙古自治区传统发酵稀奶油“焦克”,能够通过代谢合成细菌素,而植物乳杆菌KLDS1.0706同样分离自内蒙古传统发酵乳制品,但却不产细菌素。本试验以植物乳杆菌KLDS1.391和KLDS1.0706为研究对象,评价其作为潜在益生菌可能性,研究内容包括对胃肠道不良环境抗性、免疫活性及安全性,为后续试验奠定基础。
1 材料与方法
1.1 材料与仪器
1.1.1 试验菌株
植物乳杆菌(Lactobacillus plantarum)KLDS 1.0391、KLDS1.0706和鼠李糖乳杆菌(Lactobacillus rhamnosus GG)由东北农业大学乳品科学教育部重点实验室保存;化脓性链球菌(Streptococcus pyogenes)ATCC19615、金黄色葡萄球菌(Staphylococcus aureus)ATCC25923购自上海复祥生物科技有限公司。
1.1.2 试验用小鼠
BALB/c小鼠,60只,雌性,6~8周龄,清洁级,购自哈尔滨肿瘤医院实验动物中心。饲养环境温度:23±2℃;照明时长:12 h·d-1;饲料:标准小鼠饲料;自由饮水。每组3只作为平行对照,另选3只作为空白对照组。
1.1.3 培养基
Man-Rogosa-Sharp(MRS)培养基、Brian Heart Infusion(BHI)培养基和Tryptone Soya Broth(TSB)培养基。培养基具体配制方法参照文献[11]方法。
1.1.4 试剂
微生物药敏试纸,哈尔滨鑫丰生物材料有限公司;哥伦比亚血琼脂培养基,哈尔滨伟业生物工程有限公司;Roswell Park Memorial Institute(RPMI)1640培养液,美国Gibco公司;胎牛血清,美国Hyclon公司;刀豆蛋白(ConA)、噻唑蓝(MTT)、台盼兰、牛胆盐,美国Sigma公司;二甲基亚砜(DMSO),天津TBD公司。
1.1.5 仪器与设备
HF90型CO2培养箱,香港力康发展有限公司;Model 680型酶标仪,美国Beckman公司;EL1 04/ 00型电子天平,梅特勒上海公司;2~1 000 μL可调定量移液器,德国Eppendor公司;96孔培养板,美国Corning Incorporated Costa公司;XW-80A型旋涡混合器、AE-30倒置生物显微镜,麦克奥迪实业集团有限公司;VD-1320型洁净工作台,北京东联哈尔仪器制造有限公司;LD4-2型低速离心机,北京医用离心机厂。
1.2 方法
1.2.1 酸耐受性试验
植物乳杆菌KLDS1.0391与KLDS1.0706以2%接种量接种于液体MRS培养基中,37℃下静置培养16 h。得到过夜培养物离心(6 000 r·min-1,4℃,10 min),收集菌体,并用pH 7.2磷酸盐缓冲液(PBS)洗涤2次。洗涤后得到菌体用PBS缓冲液重悬,再用3 mol·L-1的HCL溶液pH分别调节至2和3。pH 2时,分别在0、0.5 h时取样,用移液枪吸取1 mL菌液加入灭菌9 mL生理盐水中进行梯度稀释。稀释到适宜浓度时,吸取100 μL涂板并于24 h后菌落计数。pH 3时,分别在1、2、3 h时取样,操作方法同上[11]。
1.2.2 胆盐耐受性试验
按照以上方法进行培养、洗涤及重悬等步骤,并用3 mol·L-1的NaOH溶液调节至pH 7。孵育0、4、8 h后取样,用灭菌后生理盐水进行梯度稀释,当达到适宜浓度后,吸取100 μL涂板,并于24 h后菌落计数[11]。
1.2.3 对小鼠淋巴细胞增殖试验
参照文献[5]方法,并以鼠李糖乳杆菌LGG为对照菌株。
1.2.3.1 菌悬液制备
将试验菌株接种至MRS培养基中,37℃培养16 h,将菌液6 000 r·min-1离心10 min后,重悬于0.01 mol·L-1PBS缓冲液中(pH 7.2),所得菌悬液分为活菌组和灭活菌组(100℃,30 min,经检验证明无活菌存在,仍保持正常细菌形态)。将处理后活菌组和灭活菌组菌液6 000 r·min-1离心10 min并弃掉上清,用含10%胎牛血清RPMI1640培养液重悬菌沉淀,并调整两组菌悬液浓度均为107cfu·mL-1。
1.2.3.2 小鼠脾脏淋巴细胞液制备
试验当天颈椎脱臼处死,置75%酒精内浸泡2~5 min,置于超净台内,逐层剪开腹壁,无菌取小鼠脾脏,置于盛有预冷的RPMI 1640培养液平皿中,剪去结缔组织和脂肪,无菌注射器研磨过200目钢网过滤到离心管中,4℃1 500 r·min-1离心10 min,继用红细胞裂解液去除红细胞,4℃1 000 r·min-1离心10 min后弃上清,用PBS洗2遍,收集细胞,用含10%FCS的RPMI1640培养基重悬细胞。用台盼蓝法测定细胞存活率,要求活细胞比率在95%以上。计数后用含10%FCS的RPMI 1640培养液调成所需细胞数培养。
1.2.3.3 乳杆菌体外对淋巴细胞增殖的影响
在无菌96孔板中,设空白调零组(只加培养液200 μL·孔-1)、阴性对照组(终浓度约为1×106个·mL-1的小鼠淋巴细胞悬液180 μL·孔-1,20 μL培养液·孔-1)、阳性对照组(淋巴细胞悬液180 μL·孔-1和终浓度为2.5 μg·mL-1的ConA)、乳酸菌对照组(培养液180 μL·孔-1和终浓度分别为105、106、107cfu·mL-1的待测活性和热致死菌悬液)、乳酸菌试验组(淋巴细胞悬液180,20 μL·孔-1不同浓度待测菌悬液,使不同种属的活性和热致死乳杆菌与细胞分别以10∶1、1∶1和1∶10比例共同孵育)。所有试验均重复3次。
加样混匀后,置于37℃、5%CO2恒温培养箱连续培养48 h。培养结束前4 h,加入5 mg·mL-1的MTT液20 μL·孔-1,反应4 h后吸去上清液50 μL·孔-1,加入DMSO 100 μL·孔-1,静置10 min后用酶标仪在570 nm波长处测定OD并计算淋巴细胞转化值。
1.2.4 溶血性试验
将活化好的两株植物乳杆菌KLDS1.0391、KLDS1.0706以及对照菌株LGG取出接种于MRS液体培养基中,化脓链球菌接种于BHI培养基中,37℃,16 h活化3代后,穿刺接种于哥伦比亚血琼脂培养基,37℃静置培养16 h,观察是否有溶血圈出现,以化脓性链球菌ATCC19615作为指示菌株,判断三株乳杆菌是否具有溶血性[12]。
1.2.5 抗生素抗性试验
操作方法参照文献[13]方法,将两株植植物乳杆菌及鼠李糖乳杆菌LGG接种于MRS液体培养基中,37℃静置培养16 h,调整其浓度为108cfu·mL-1。用无菌棉拭子蘸取菌液并在管壁上挤压出多余菌液。用棉拭子将菌液均匀涂抹在整个MRS培养基表面,反复3次,每次将平板顺时针旋转60°,最后沿周边绕两圈。待平板干后,用无菌镊子取药敏纸片贴在平板表面,每个平板贴5张纸片,每张纸片间距不小于24 mm,纸片中心距平皿边缘不少于15 mm。待纸片贴好后,将平板放置于37℃培养箱中培养24 h后取出,用游标卡尺测量抑菌圈直径,抑菌圈边缘以肉眼看不到细菌明显生长为界限。药敏纸片试验同时用Streptococcus pyogenes ATCC25923为指示菌,鼠李糖乳杆菌LGG为对照菌。当且仅当Streptococcus pyogenes ATCC 25923抑菌圈直径在允许范围内时,测定菌株抑菌直径结果才真实有效。
1.3 数据分析
每个试验均独立重复3次,3次独立试验结果以“平均值±标准差”表示,并用SPSS 20.0对结果进行显著性分析。
2 结果与分析
2.1 对低酸的耐受性
试验中为更好模拟真实胃酸情况,选取pH 2和pH 3两个酸度。由图1A所示,当受试菌在pH 2的PBS缓冲液中孵育1 h后,无活菌存活(数据未给出)。当植物乳杆菌KLDS1.0391在pH 2的PBS缓冲液中孵育0.5 h后,活菌数维持在4.16 log cfu·mL-1,其活菌存活量显著高于植物乳杆菌KLDS1.0706(P<0.05)。对照菌株LGG在pH 2时表现出最好耐受性(P<0.05)。
由图1B所示,在pH 3时,所有菌株均表现出对酸良好耐受能力。在pH 3的PBS缓冲液中孵育3 h后,所有菌株存活量仍均超过9 log cfu·mL-1。在孵育1、2、3 h时,植物乳杆菌KLDS1.0391菌株存活量均高于植物乳杆菌KLDS1.0706,且在孵育1、2 h时差异显著(P<0.05)。但植物乳杆菌KLDS1.0391在孵育期间段内其菌株存活量略小于对照菌株LGG,且在孵育3 h时差异显著(P<0.05)。
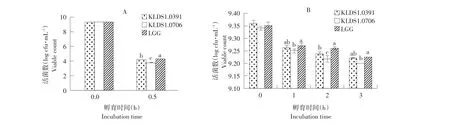
图1 乳杆菌对pH 2和pH 3低酸环境的耐受性Fig.1Tolerance of Lactobacillus strains to pH 2 and pH 3
2.2 对胆盐的耐受性
由图2A可知,孵育4 h后,植物乳杆菌KLDS 1.0391活菌数显著高于植物乳杆菌KLDS1.0706(P<0.05),且略高于对照菌株LGG;孵育8 h后,受试菌株活菌数无显著差异,且活菌数均维持在8.0 log cfu·mL-1,说明菌株对0.3%胆盐具有较强耐受性。

图2 乳杆菌对0.3%、0.5%和1.0%胆盐的耐受性Fig.2Tolerance of Lactobacillus strains to 0.3%,0.5%and 1%bile salt
由图2B可知,孵育4 h后,受试菌活菌数均维持在8.5 log cfu·mL-1。两株受试植物乳杆菌活菌数均高于对照菌株LGG,且植物乳杆菌KLDS1.0706活菌数略高于植物乳杆菌KLDS1.0391。经孵育8 h后,三株菌株活菌数无显著差异(P>0.05),且植物乳杆菌KLDS1.0391活菌数略高于KLDS1.0706。
由图2C可知,孵育4 h后,三株菌株活菌数无显著差异(P>0.05),且均保持在8.0 log cfu·mL-1以上,但两受试菌活菌数较对照菌LGG偏少。在孵育8 h后,植物乳杆菌KLDS1.0706的活菌数明显下降,且显著低于植物乳杆菌KLDS1.0391与LGG(P<0.05)。说明植物乳杆菌KLDS1.0706对1.0%胆盐耐受能力较差。
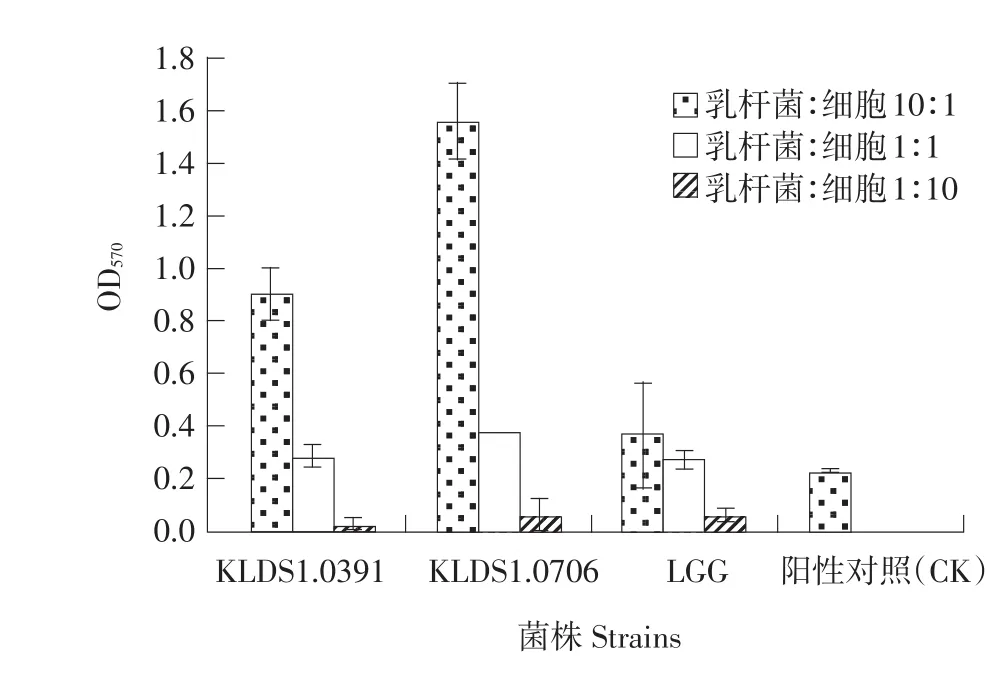
图3 活性乳杆菌刺激淋巴细胞增殖后的OD570Fig.3OD570of lymphocyte proliferation stimulated by viableLactobacillusstrains
淋巴细胞转化值大小可直接反映淋巴细胞活性高低,是测定T淋巴细胞免疫功能的重要指标之一[14]。由表1可知,活性乳杆菌对体外小鼠淋巴细胞转化均有促进作用,且呈现计量依赖关系。小鼠脾脏淋巴细胞转化值随活性乳杆菌与小鼠淋巴细胞浓度比值增大而增大。当活性乳杆菌与小鼠淋巴浓度比值为10∶1时,淋巴细胞转化值依次为:植物乳杆菌KLDS1.0706>LGG>植物乳杆菌KLDS1.0391(P<0.05)。当活性乳杆菌与小鼠淋巴细胞浓度比值为1∶1时,植物乳杆菌KLDS 1.0706对小鼠淋巴细胞的转化值也显著高于植物乳杆菌KLDS1.0391和对照菌LGG(P<0.05);当活性乳杆菌与小鼠淋巴浓度比值为1:10时,三株乳杆菌对小鼠淋巴细胞转化值虽无差异显著性,但植物乳杆菌KLDS1.0706转化值仍高于其他两株,与对小鼠淋巴细胞增殖结果一致。
2.3.2 热灭活乳杆菌作用
由图4可知,热致死乳杆菌与小鼠淋巴细胞浓度比为10∶1时,热致死乳杆菌OD570显著高于阳性对照组(P<0.05),且其中植物乳杆菌KLDS1.0706 OD570最大。说明植物乳杆菌KLDS1.0706对促进小鼠淋巴细胞体外增殖活性最高。其次分别为植物乳杆菌KLDS1.0391、LGG。而当热致死乳杆菌与小鼠淋巴细胞浓度比为1∶1时,其OD570也与阳性对照组相当;当热致死乳杆菌与小鼠淋巴细胞浓度比为1∶10时,不同种热致死乳杆菌OD570均显著低于阳性对照组(P<0.05)。说明随热致死乳杆菌浓度降低,对促进小鼠体淋巴细胞增殖作用减弱。
由表2可知,植物乳杆菌KLDS1.0706对小鼠淋巴细胞转化值的影响高于植物乳杆菌KLDS 1.0391和对照菌株LGG,且在乳杆菌与细胞浓度比为10∶1与1∶10时差异显著(P<0.05)。然而,通过对比表1、2可知,热致死乳杆菌对体外小鼠淋巴细胞转化作用虽有一定促进作用,但效果不明显,其大部分作用效果仅约为同一浓度下活性乳杆菌对体外小鼠淋巴细胞转化效果的十分之一到几十分之一,而且在乳杆菌与细胞比为1∶10时,对照菌株LGG对小鼠淋巴细胞转化无促进作用。
2.3 乳杆菌体外对小鼠淋巴细胞的增殖作用
2.3.1 活性乳杆菌作用
由图3可知,活性乳杆菌与小鼠淋巴细胞浓度比值越高,OD570越大。说明活性乳杆菌对小鼠淋巴细胞体外增殖有促进作用,且乳杆菌与小鼠淋巴浓度比越大,促进作用越明显。乳杆菌与小鼠淋巴细胞比值为10∶1时促进作用最为明显,而当乳杆菌与小鼠淋巴细胞浓度比为1∶10时,其增值作用显著低于ConA(P<0.05)。两株受试乳杆菌中,植物乳杆菌KLDS1.0706在不同浓度下对小鼠淋巴细胞的促进作用均显著高于植物乳杆菌KLDS1.0391(P<0.05)。而两株受试菌株与对照菌株LGG相比,两株受试乳杆菌促进作用均高于LGG。
表1 活性乳杆菌刺激小鼠脾脏淋巴细胞的转化值(±s,n=3)Table 1Proliferative response of spleen cells induced by viable Lactobacillus strains(±s,n=3)
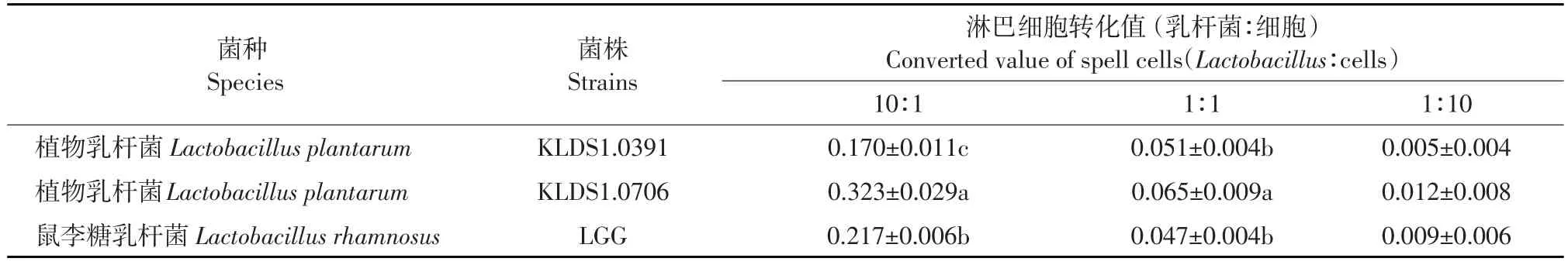
表1 活性乳杆菌刺激小鼠脾脏淋巴细胞的转化值(±s,n=3)Table 1Proliferative response of spleen cells induced by viable Lactobacillus strains(±s,n=3)
注:同列数据肩标字母不同表示差异显著(P<0.05)。下同。Note:Column data marked with different superscripts mean significant difference(P<0.05)。The same as below.
菌种Species菌株Strains植物乳杆菌Lactobacillus plantarum植物乳杆菌Lactobacillus plantarum鼠李糖乳杆菌Lactobacillus rhamnosus KLDS1.0391 KLDS1.0706 LGG淋巴细胞转化值(乳杆菌∶细胞)Converted value of spell cells(Lactobacillus∶cells)10∶1 0.170±0.011c 0.323±0.029a 0.217±0.006b 1∶1 0.051±0.004b 0.065±0.009a 0.047±0.004b 1∶10 0.005±0.004 0.012±0.008 0.009±0.006
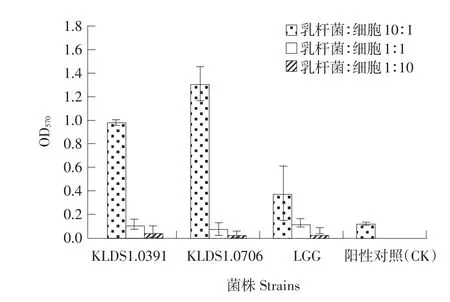
图4 热致死乳杆菌刺激淋巴细胞增殖后的OD570Fig.4OD570of lymphocyte proliferation by thermal-inactive Lactobacillus strains
2.4 安全性
2.4.1 溶血性
以化脓性链球菌为对照菌株,检测乳杆菌溶血性。化脓性链球菌菌落周围出现透明溶血圈(见图5A),为乙型溶血(β-溶血),对人体的致病力强。乳杆菌KLDS1.0391、KLDS1.0706及对照菌LGG菌落周围没有出现溶血圈(见图5B、C、D),说明植物乳杆菌KLDS1.0391、KLDS1.0706与鼠李糖乳杆菌LGG不具有溶血性。
2.4.2 抗生素抗性
根据表3,对照菌株Streptococcus pyogenes ATCC25923抑菌圈直径在允许范围内,所以可知受试菌株抑菌结果真实有效。
表2 热致死乳杆菌刺激小鼠脾脏淋巴细胞的转化值(x±s,n=3)Table 2Proliferative response of spleen cells induced by thermal-inactiveLactobacillusstrain±s,n=3)
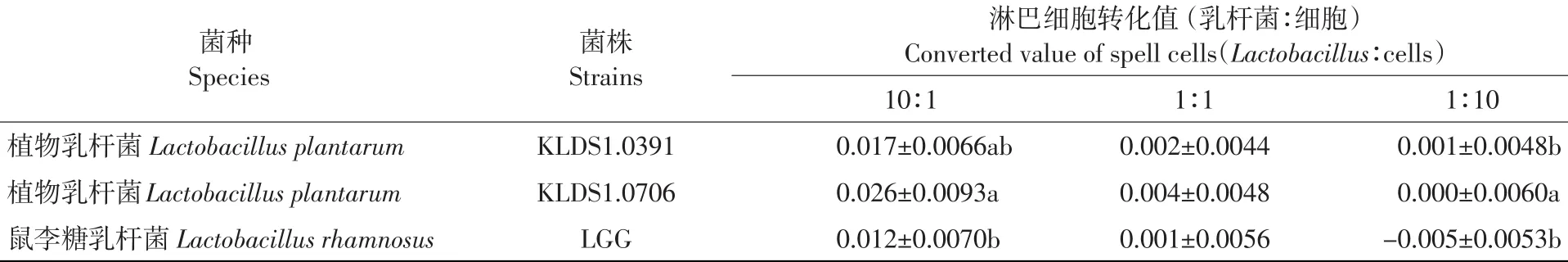
表2 热致死乳杆菌刺激小鼠脾脏淋巴细胞的转化值(x±s,n=3)Table 2Proliferative response of spleen cells induced by thermal-inactiveLactobacillusstrain±s,n=3)
菌种Species菌株Strains植物乳杆菌Lactobacillus plantarum植物乳杆菌Lactobacillus plantarum鼠李糖乳杆菌Lactobacillus rhamnosus KLDS1.0391 KLDS1.0706 LGG淋巴细胞转化值(乳杆菌∶细胞)Converted value of spell cells(Lactobacillus∶cells)10∶1 0.017±0.0066ab 0.026±0.0093a 0.012±0.0070b 1∶1 0.002±0.0044 0.004±0.0048 0.001±0.0056 1∶10 0.001±0.0048b 0.000±0.0060a -0.005±0.0053b
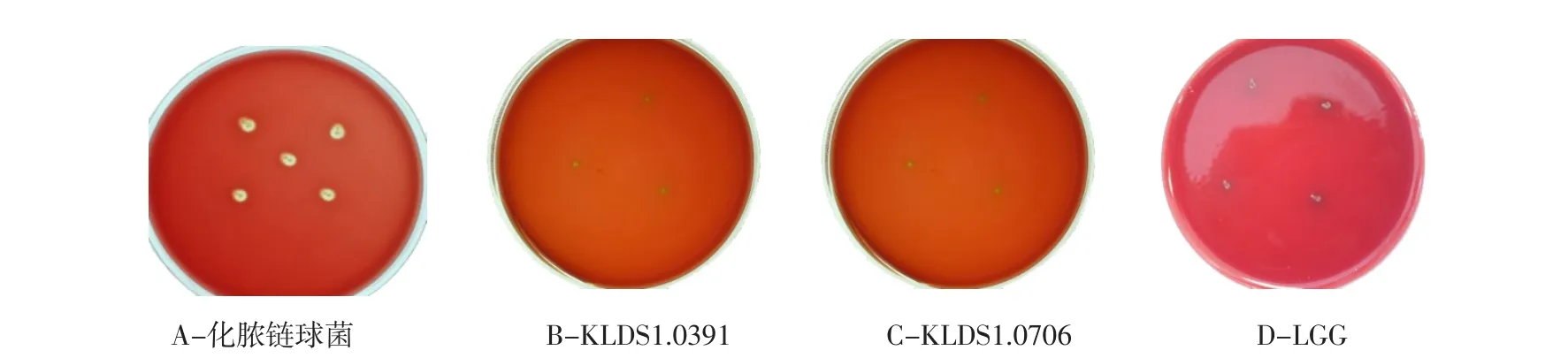
图5 化脓链球菌、植物乳杆菌KLDS1.0391、KLDS1.0706及鼠李糖乳杆菌溶血性Fig.5Hemolytic properties of Streptococcus pneumoniae,Lactobacillus plantarum KLDS1.0391,KLDS1.0706 and Lactobacillus rhamnosus
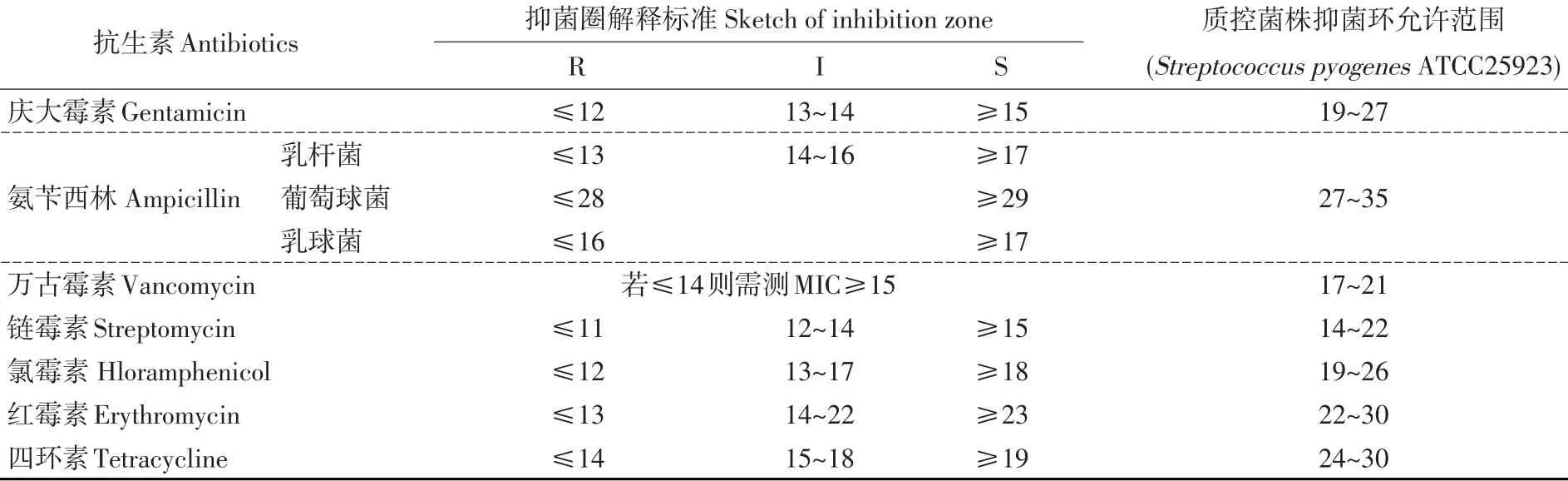
表3 抑菌圈解释标准Table 3Sketch of inhibition zone
由表4可知,KLDS1.0391、KLDS1.0706以及对照菌株LGG均对万古霉素与链霉素具有抗性,且对四环素敏感。其中,KLDS1.0706对庆大霉素具有抗性,KLDS1.0391、LGG对庆大霉素敏感。
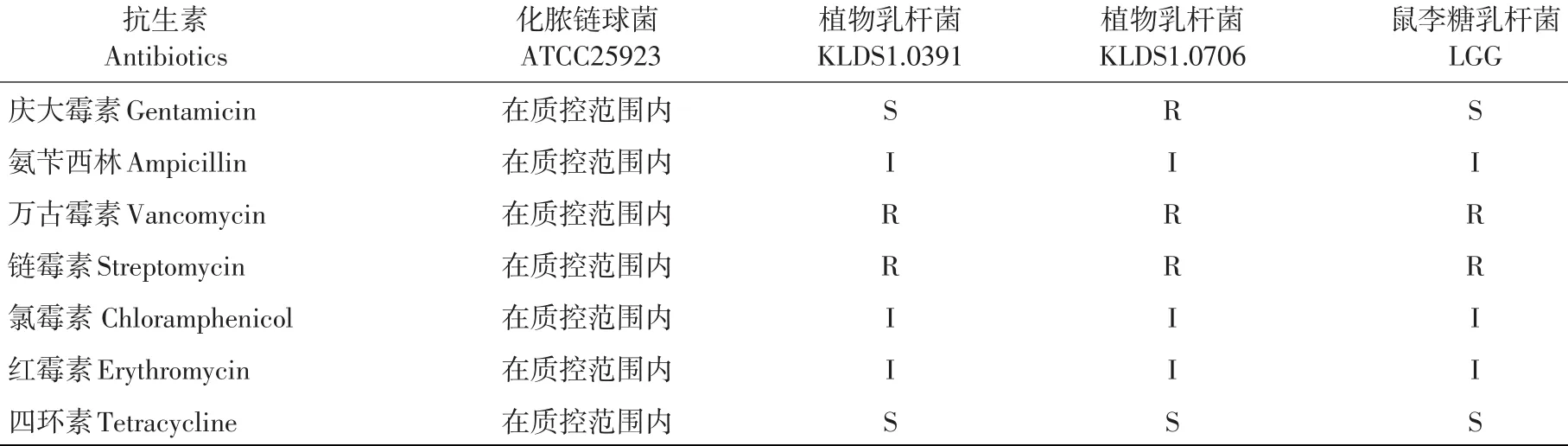
表4 测定抗生素抗性时获得的抑菌直径Table 4Inhibition zone diameters of antibiotic(mm)
3 讨论
对低酸和胆盐耐受性试验表明,植物乳杆菌KLDS1.0391相比植物乳杆菌KLDS1.0706,对酸和胆盐均有较高耐受性,推测是植物乳杆菌KLDS 1.0391在代谢过程中产生细菌素所致。有报道称细菌素对菌株在肠道内的定植及与肠道内其他菌株竞争有优势[15-17],而且,Bove等也曾从基因表达方面证实这一说法[18]。两株菌对胆盐耐受性,除在1%胆盐中孵育8 h时外,其余条件下活菌数差异均不显著(P>0.05),均能维持在相同数量级上,并与对照菌LGG抗性相仿。结果与Yu等和Vinderola等研究结果接近[19-20],说明这两株菌对胆盐具有较好耐受性。
对淋巴细胞增殖作用表明植物乳杆菌KLDS 1.0391与植物乳杆菌KLDS1.0706对小鼠脾细胞均有促进增殖作用,且活性植物乳杆菌对脾细胞的增殖作用要好于热致死乳杆菌增殖作用。说明植物乳杆菌本身或其代谢产物对小鼠淋巴细胞增殖作用有促进效果,但作用机理尚待动物试验和临床试验提供依据。
溶血性是体外对菌株进行安全性检测的重要指标之一。根据溶血特征可将溶血性分为两类:α溶血,特点是菌落周围有草绿色溶血圈,对人致病力差;β溶血,其特点是菌落周围出现透明溶血圈,对人体致病力强。若无溶血性,则没有溶血圈出现。本试验发现三株试验用菌均无溶血圈出现,说明三株菌均不具有溶血性。Argyri等试验选取73株乳杆菌,经试验发现其中69株乳杆菌属于γ溶血,4株属于α溶血[21]。而Vidhyasagar等试验中同样发现所选6株含有细菌素基因的乳杆菌均属于γ溶血[22]。从而可以看出,虽然溶血性是体外评价益生菌安全性的指标之一,但大多数乳酸菌均不具有溶血性,属于γ溶血,只有少量乳酸菌具有对人体致病能力较低的α溶血性。而具有溶血性的乳杆菌罕有发现。
菌株抗生素抗性测定是体外评价益生菌和潜在益生菌的重要手段之一。Argyri等研究发现所选73株乳酸菌(含37株植物乳杆菌)均对万古霉素具有抗性[21],且50%以上乳酸菌对克林霉素具有抗性。Tulumoglu等研究表明,选取20株乳酸菌均对万古霉素具有抗性,对青霉素和四环素敏感[23]。本研究发现,植物乳杆菌KLDS1.0391、KLDS1.0706以及对照菌株LGG均对万古霉素与链霉素具有抗性,且KLDS1.0706对庆大霉素具有抗性,证明乳酸菌是一类耐肽聚糖类(如万古霉素)细菌。但对其他抗生素抗性可能具有种属差异性。两株植物乳杆菌抗生素抗性基因是否存在转移的风险,还需进一步从基因角度验证。
4 结论
植物乳杆菌KLDS1.0391和KLDS1.0706对低酸和胆盐有较好抗性,接近LGG;两株菌对小鼠淋巴细胞有较强增殖作用;两株菌均无溶血性,但对万古霉素与链霉素具有抗性,而且,植物乳杆菌KLDS1.0706还对庆大霉素具有抗性。研究结果初步表明植物乳杆菌KLDS1.0391与KLDS1.0706具有作为益生菌的潜在能力。
[1]马千里,刘冬,顾瑞霞.植物乳杆菌的益生特性及其在乳制品中的应用[J].中国奶牛,2014(1):36-40.
[2]Pérez-Cano F J,Dong H,Yaqoob P.In vitro immunomodulatory activity of Lactobacillus fermentum CECT5716 and Lactobacillus salivarius CECT5713:Two probiotic strains isolated from human breast milk[J].Immunobiology,2010,215(12):996-1004.
[3]Salva S,Villena J,Alvarez S.Immunomodulatory activity of Lactobacillus rhamnosus strains isolated from goat milk:impact on intestinal and respiratory infections[J].International journal of food microbiology,2010,141(1):82-89.
[4]Tsai Y T,Cheng P C,Pan T M.The immunomodulatory effects of Lactic acid bacteria for improving immune functions and benefits [J].Applied microbiology and biotechnology,2012,96(4):853-862.
[5]李艾黎,马冬雪,孟祥晨.乳杆菌对原代淋巴细胞中Th1/Th2细胞平衡的影响[J].细胞与分子免疫学杂志,2011,27(4):389-391.
[6]靳志强,王延样.植物乳杆菌在人体肠道的益生特性[J].中国乳品工业,2007,35(9):30-34.
[7]郭晓奎,袁杰利.益生菌安全性的现状与对策[J].中国微生态学杂志,2009,21(6):576-577.
[8]马千里,刘冬,顾瑞霞.植物乳杆菌的益生特性及其在乳制品中的应用[J].中国奶牛,2014(1):36-40.
[9]贡汉生,孟祥晨.益生菌的安全性评价[J].现代食品科技, 2005,21(4):76-79.
[10]刘勇,张勇,张和平.世界益生菌安全性评价方法[J].中国食品学报,2011,11(6):141-151.
[11]Messaoudi S,Madi A,Prevost H,et al.In vitro evaluation of the probiotic potential of Lactobacillus salivarius SMXD51[J].Anaerobe,2012,18(6):584-589.
[12]苏本宪.乳杆菌对Staphylococcus aureus和Streptococcus pyogenes抑菌作用的研究[D].哈尔滨:东北农业大学,2014:47.
[13]郭兴华,凌代文.乳酸细菌现代研究实验技术[M].2版.北京:科学出版社,2013:392-393.
[14]徐艳,董彦琴.白芍总苷对小鼠淋巴细胞体外增殖活化影响的研究[J].中华中医药学刊,2013,31(4):914-917.
[15]Vesterlund S,Vankerckhoven V,Saxelin M,et al.Safety assessment of Lactobacillus strains:Presence of putative risk factors in faecal,blood and probiotic isolates[J].Int J Food Microbiol,2007 (3):325-331.
[16]Noriega L,de los Reyes-Gavilán C G,Margolles A.Acquisition of bile salt resistance promotes antibiotic susceptibility changes in Bifidobacterium[J].Journal of Food Protection,2005,68(9):1916-1919.
[17]Feld L,Schjørring S,Hammer K,et al.Selective pressure affects transfer and establishment of a Lactobacillus plantarum resistance plasmid in the gastrointestinal environment[J].Journal of Antimicrobial Chemotherapy,2008,61(4):845-852.
[18]Bove P,Russo P,Capozzi V,et al.Lactobacillus plantarum passage through an oro-gastro-intestinal tract simulator:carrier matrix effect and transcriptional analysis of genes associated to stress and probiosis[J].Microbiological Research,2013,168(6):351-359.
[19]Yu Z,Zhang X,Li S,et al.Evaluation of probiotic properties of Lactobacillus plantarum strains isolated from Chinese Northeast pickled ca[J].World Journal of Microbiology and Biotechnology, 2013,29(3):489-498.
[20]Vinderola C G,Reinheimer J A.Lactic acid starter and probiotic bacteria:A comparative“in vitro”study of probiotic characteristics and biological barrier resistance[J].Food Research International,2003,36(9):895-904.
[21]Argyri A A,Zoumpopoulou G,Karatzas K A G,et al.Selection of potential probiotic lactic acid bacteria from fermented olives by in vitro tests[J].Food Microbiology,2013,33(2):282-291.
[22]Vidhyasagar V,Jeevaratnam K.Evaluation of Pediococcus pentosaceus strains isolated from Idly batter for probiotic properties in vitro[J].Journal of Functional Foods,2013,5(1):235-243.
[23]Tulumoglu S,Yuksekdag Z N,Beyatli Y,et al.Probiotic properties of lactobacilli species isolated from children's feces[J].Anaerobe,2013,24:36-42.
In vitroevaluation of twoLactobacillus plantarumas potencial probiot-ics
/MENG Xiangchen,LI Xue,YAO Lei,ZHOU Jinyu
(Key Laboratory of Dairy Science,Ministry of Education,School of Food Science,NortheastAgricultural University,Harbin 150030,China)
The probiotic potential of twoLactobacillus plantarumstrains KLDS1.0391,KLDS1.0706 was evaluated by a series ofin vitroassays,and then a preliminary evaluation of the two strains of immunological activity was conducted,finally the safety of two strains was evaluated.The tolerance to low pH and bile salt was used the viable counts assay;effect of active and thermal-inactive strains with different amount on the proliferative capacity of the lymphocytes in the mice spleen were assessed by the MTT method;in addition,the hemolytic activity of two strains were determined by Columbia blood agar;the antibiotic resistance of two strains were determined by Kirby-Bauer(KB)antibiotic testing.Results showed that it was indicated that two non-hemolyticLactobacillus plantarumstrains were greatly resistant to harsh environment and had resistance to vancomycin and streptomycin.Though either the activeLactobacillusor the thermal-inactive Lactobacilluswas able to promote the lymphocytes proliferationin vitroand the promoting effect was amount-dependent,activeLactobacilluswere more effective than the thermal-inactive ones.
Lactobacillus plantarum;hemolytic activity;antibiotic resistance;gastrointestinal tolerance;lymphocyte proliferation
TS252.1
A
1005-9369(2015)09-0044-08
时间2015-9-23 10:43:25[URL]http://www.cnki.net/kcms/detail/23.1391.S.20150923.1043.022.html
孟祥晨,李雪,姚蕾,等.两株植物乳杆菌作为潜在益生菌的体外评价[J].东北农业大学学报,2015,46(9):44-51.
Meng Xiangchen,Li Xue,Yao Lei,et al.In vitroevaluation of twoLactobacillus plantarumas potencial probiotics[J].Journal of Northeast Agricultural University,2015,46(9):44-51.(in Chinese with English abstract)
2015-03-23
哈尔滨市杰出青年人才基金项目(2014RFYXJ006);教育部博士学科点专项科研基金项目(20122325110017)
孟祥晨(1970-),女,教授,博士,博士生导师,研究方向为食品微生物与生物技术。E-mail:xchmeng@163.com

