重组异种骨对Balb/c小鼠的免疫学影响
孙晓霞,盖潇潇,孙立魁,王贤美,仇士东,侯 丽
(国家食品药品监督管理局济南医疗器械质量监督检验中心,山东省医疗器械生物学评价重点实验室,山东济南 250101)
重组异种骨对Balb/c小鼠的免疫学影响
孙晓霞,盖潇潇,孙立魁,王贤美,仇士东,侯 丽
(国家食品药品监督管理局济南医疗器械质量监督检验中心,山东省医疗器械生物学评价重点实验室,山东济南 250101)
目的 动态评价小鼠植入重组异种骨后的免疫毒性改变,揭示该重组异种骨的免疫学作用机制。方法 以广东冠昊生物科技股份有限公司研发的重组异种骨为材料,进行体外检测该重组异种骨的淋巴细胞转化实验;将重组异种骨植入Balb/c小鼠右侧股部肌间隙,分别通过血生化分析仪、ELISA和流式细胞术,于植入后1周、2周、4周动态监测Balb/c小鼠免疫学改变,综合评价该重组异种骨对机体的免疫学影响。结果 通过实验发现,该重组异种骨无明显的体外淋巴细胞免疫刺激作用;异种骨植入小鼠后,其血清中C3、IgG、IgM、炎性因子(TNF-α、IL-6)水平以及植入物局部碱性磷酸酶(ALP)含量均与阴性对照组(即假手术组)无明显差异,且该异种骨植入对小鼠外周血单个核细胞(peripheral blood mononuclear cell, PBMC)及其淋巴结淋巴细胞的分群和活化均无显著影响。结论 该重组异种骨不能引起体内外的免疫毒性反应,从而为重组异种骨的临床应用提供实验数据和理论依据。
重组异种骨;免疫毒性;Balb/c小鼠
由于事故或疾病等各种原因造成的骨创伤、骨缺损是临床常见病例。自体骨是目前公认的植骨材料[1],但患者要遭受2次手术的痛苦,且其数量有限;此外,异体骨的来源有限且有传染疾病的危险。重组异种骨因其来源广泛和独特的生物学特性作为组织工程骨支架材料,可避免使用异体骨可能发生的交叉感染,有效解决临床上自体骨与同种骨不足的问题,具有较好的应用前景,但移植后发生的剧烈免疫排斥阻碍了异种骨移植的发展[2]。近年来,随着对异种骨处理方法的不断改进,市场上出现多种能应用于临床的异种骨[3],但仍缺乏对异种骨植入后介导的免疫毒性研究,其中的免疫学机制尚不清楚。
本研究以广东冠昊生物科技股份有限公司采用已获得专利授权(US6106555A,US6231614B1)制备的猪源性异种骨为实验对象,通过体外细胞毒实验、淋巴细胞转化实验和体内肌肉植入实验,分别检测该重组异种骨对体液免疫和细胞免疫的影响,以评价其对机体的免疫安全性,从而为进一步开展临床实验提供实验数据和理论基础。
1 材料与方法
1.1 动物和细胞
Balb/c小鼠,雌雄各半,6~8周龄,体质量18~22 g,购自北京维通利华实验动物技术有限公司;L929细胞系购自中科院典型培养物保藏委员会细胞库。
1.2 试剂和仪器
刀豆蛋白A Ⅳ型(ConA)、植物血凝素(PHA)、弗氏完全佐剂(Freud’s)和MTT均购自Sigma公司;小牛血清白蛋白(BSA,北京索莱宝科技有限公司产品);RPMI1640培养基(GIBCO公司产品);人外周血淋巴细胞分离液(天津灏洋);ELISA检测试剂盒(表1);流式细胞术相关抗体(表2)。倒置显微镜(Olympus TH4-200);全自动酶标仪(Multiskan MK3,热电仪器有限公司);流式细胞仪(Becton Dickinson, USA);多功能匀质仪(Precellys 24,Bertin公司)。
表1 ELISA检测试剂盒
Tab.1 ELISA Detection Kits

目录号产品名称生产商6320MouseIgGELISAKitABI6380MouseIgMELISAKitABI6270MouseComplement3ELISAKitABI16193MouseIL-6ELISAKitABI21926MouseTNF-αELISAKitABI
1.3 实验样品及处理
重组异种骨由合作单位广东冠昊生物科技股份有限公司提供,经紫外辐照灭菌后,无菌分割成3 mm×3 mm×3 mm大小的骨粒,新鲜牛骨亦由此方法处理成相同大小的骨粒。
1.4 细胞毒性实验
根据ISO10993-12:2007[4]规定的原则制备样品,取重组异种骨和新鲜牛骨经多功能匀质仪粉碎后精确称重,以RPMI 1640培养基(含100 mL/L FBS)为浸提介质,充分吸胀后,按0.1 g/mL的含量在(37±1)℃的条件下浸提(24±2)h,50 g离心5 min,制备试验液,按ISO10993-5:2009[5]中要求,对重组异种骨和新鲜牛骨的试验液进行体外细胞毒性试验。
表2 流式细胞术的相关抗体
Tab.2 Flow cytometry-related antibodies

目录号产品名称生产商100204FITCanti-mouseCD3antibodyBioLegend400605FITCRatIgG2b,κIsotypeCtrlAntibodyBioLegend100708PEanti-mouseCD8antibodyBioLegend400507PERatIgG2a,κIsotypeCtrlAntibodyBioLegend104508PEanti-mouseCD69antibodyBioLegend400907PEArmenianHamsterIgGIsotypeCtrlAntibodyBioLegend103130PerCPanti-mouseCD45antibodyBioLegend100412APCanti-mouseCD4antibodyBioLegend400611APCRatIgG2b,κIsotypeCtrlAntibodyBioLegend115512APCanti-mouseCD19antibodyBioLegend400511APCRatIgG2a,κIsotypeCtrlAntibodyBioLegend
1.5 小鼠血清制备
小鼠摘眼球放血,收集血液,4 ℃静置30 min,800 g离心15 min,收集上层血清,-20 ℃保存。
1.6 淋巴细胞制备
①人外周血单个核细胞(PBMC)制备:抽取健康志愿者前臂静脉血10 mL,加至淋巴分离液的上层,按照淋巴细胞分离液说明书,离心取淋巴细胞层加入10 mL无菌1×PBS,离心后收集人PBMC用含100 mL/L FCS的RPMI 1640培养液重悬细胞。②Balb/c小鼠外周血单个核细胞(PBMC)制备:小鼠摘眼球放血,收集血液至抗凝管;离心后弃上清,用红细胞裂解液裂解红细胞,离心后收集鼠PBMC用1×PBS重悬细胞。③Balb/c小鼠淋巴结(lymph node)淋巴细胞制备:脱颈椎处死Balb/c小鼠,无菌摘取淋巴结,用1×PBS溶液200目筛网研磨过滤;离心后收集鼠淋巴结淋巴细胞用1×PBS重悬细胞。
1.7 实验分组
体外细胞毒性实验共分为3组:阴性对照组(空白培养基组);重组异种骨组;新鲜牛骨组,体外淋巴细胞转化实验共分为4组:阴性对照组(空白培养基组),重组异种骨组、新鲜牛骨组和阴性对照组(PHA);体内实验共分为4组:阴性对照组(假手术组);重组异种骨组;新鲜牛骨组;BSA对照组(BSA和Freuds联合免疫)
1.8 实验步骤
1.8.1 MTT实验 按照ISO10993-5:2009医疗器械生物学评价第5部分体外细胞毒性试验MTT法进行。
1.8.2 淋巴细胞转化实验 按照ISO10993-20:2006医疗器械生物学评价第20部分淋巴细胞增殖实验[6]。将细胞悬液加入96孔板,每孔100 μL,设6个复孔。阳性对照组加入PHA至终浓度为10 ng/mL,实验平板在37 ℃、50 mL/L CO2培养箱中培养3 d后取出,加入MTT,继续培养6 h,离心后弃上清,加入DMSO,振荡平板至甲臜颗粒完全溶解,在酶标仪上于570 nm波长处测吸光度值(A),参照波长为630 nm。各实验组与阴性对照组的比值作为细胞的相对增殖比例。
1.8.3 酶联免疫吸附(ELISA)实验 按照试剂盒说明书进行ELISA试验,检测血清中的免疫球蛋白(gG,IgM)、补体C3、TNF-α和IL-6水平。
1.8.4 流式细胞术(Flow cytometry)检测淋巴细胞表面分子表达 收集淋巴细胞至离心管内,500 g离心5 min,弃上清;用适量1×PBS悬起细胞并转移至流式管中(100 μL/管),设空白对照组、同型对照组、单标组和实验组,4 ℃,避光标记30 min~1 h;在流式管内加满1×PBS,离心后弃上清,1×PBS重悬细胞,用流式细胞仪检测。
1.9 统计学分析
所有结果均以平均值±标准差的形式表示,利用Student’st或者ANOV方差检验进行统计学分析,与对照组相比,P<0.05时认为差异有统计学意义。
2 结 果
2.1 异种骨浸提液对人淋巴细胞转化能力的影响
按细胞毒性实验分别制备阴性对照组(空白培养基组),重组异种骨组和新鲜牛骨组的试验液,取各组的试验液与L929细胞共培养72 h,通过MTT掺入法检测其细胞毒性。结果显示,新鲜牛骨的试验液能抑制L929细胞增殖,而重组异种骨组未出现增殖抑制作用(图1)。作为一种异源物质,由于重组异种骨在临床使用时可能会触发针对该异源成分的免疫应答,首先通过体外淋巴细胞转化实验来验证是否存在免疫反应。与细胞毒性实验相同的方法获得各组试验液,取试验液与人PBMC共同孵育,结果如图1所示,与阴性对照组相比,该异种骨不能引起人PBMC增殖反应,新鲜牛骨却对PBMC具有明显的免疫抑制作用,其相对增殖比例明显低于阴性对照组(P<0.01)。结合细胞毒性实验和淋巴细胞转化实验的结果表明,该重组异种骨无明显的淋巴细胞免疫刺激作用。
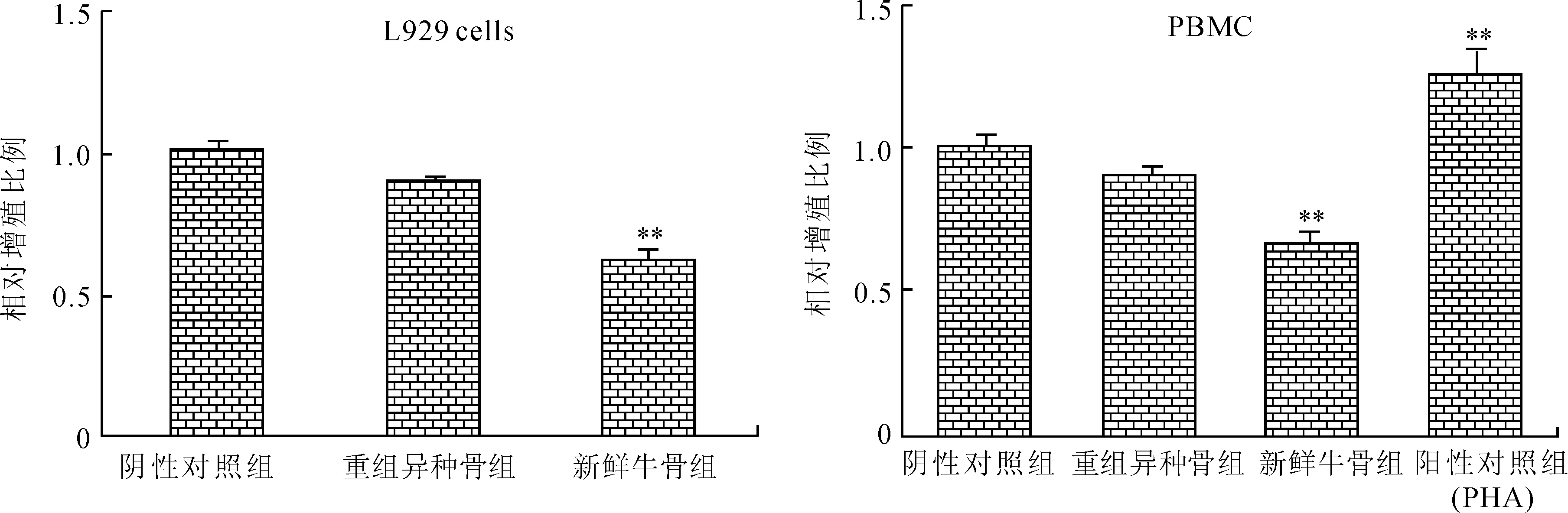
图1 重组异种骨浸提液不会引起体外培养L929细胞毒性反应和人PBMC增殖反应
Fig.1 The extracts of heterogeneous bone did not cause either cytotoxicity of L929 cell nor proliferation of human PBMCsinvitro
与阴性对照组比较,**P<0.01。
2.2 重组异种骨植入无明显一般毒性影响
一般毒性研究为解释免疫学反应的发生提供了背景资料,包括一般临床观察和局部大体观察。在本实验中,临床观察:整个实验周期受试组动物无一死亡。未发现明显的毛发状态、步态、体表孔口排液出现异常情况。局部大体观察:重组异种骨植入的第1周内,植入局部可见红肿,之后红肿情况逐渐消失,整个实验周期植入局部均无渗出。处死动物时,可发现植入部位有囊腔形成,无可见的感染现象,囊腔周围无小血管生成。新鲜牛骨组在植入部位可见明显的红肿,处死动物时,植入部位无囊腔形成。在整个试验过程中未发现植入物丢失。
2.3 重组异种骨植入对小鼠血清补体C3浓度无影响
补体C3是血清中含量最高的补体成分,本研究通过ELISA法动态观察不同植入时间血清中补体C3水平,发现与阴性对照组(假手术组)相比,植入重组异种骨后的1、2、4周并不能引起补体C3的改变;而植入新鲜牛骨却能够导致补体C3的升高(图2,4周时与阴性对照组比较,P<0.05)。
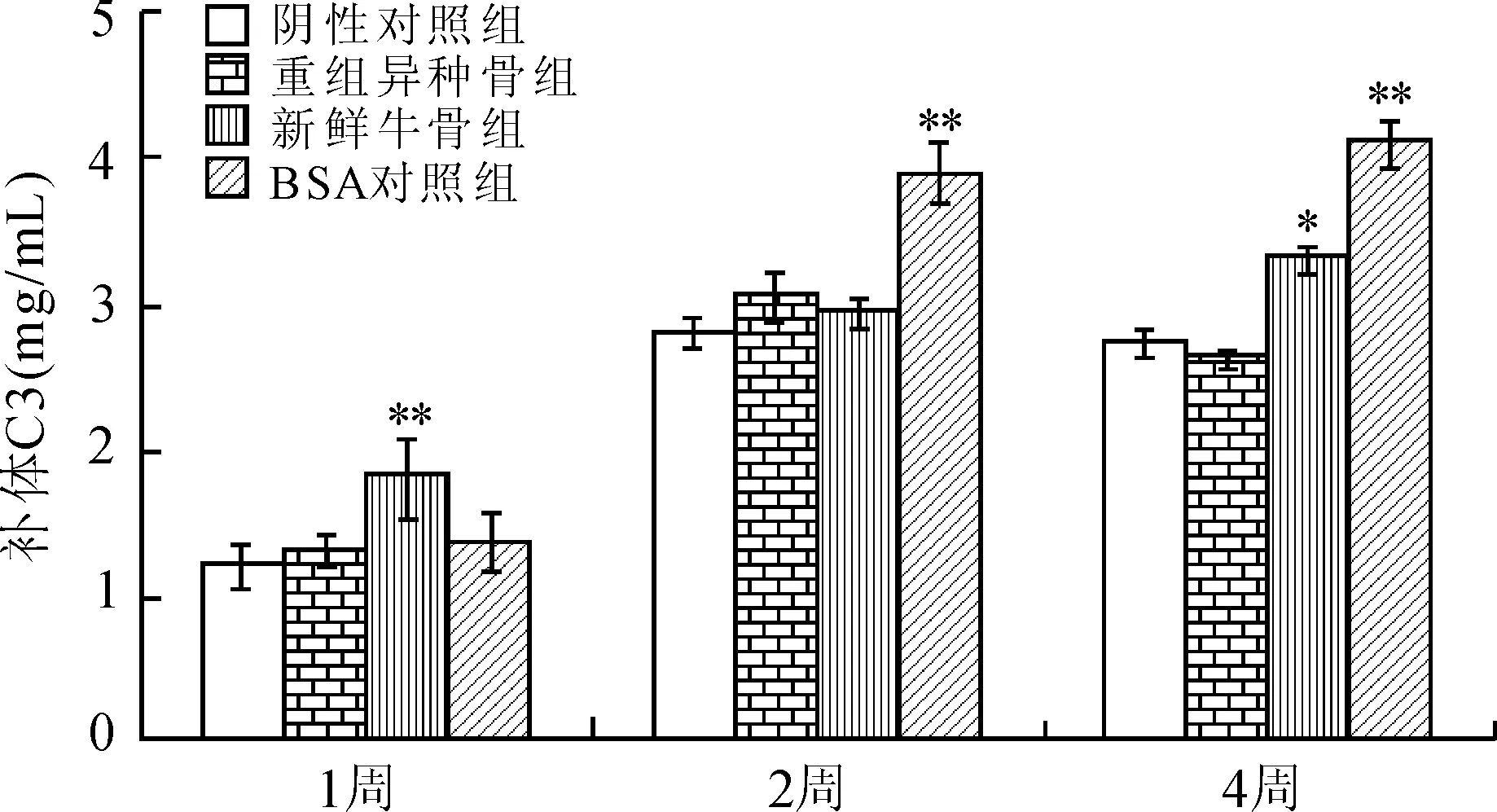
图2 重组异种骨不影响体内血清补体C3水平
Fig.2 Heterogeneous bone did not affect serum C3invivo
与阴性对照组比较,*P<0.05,**P<0.01。
2.4 异种骨植入对小鼠血清IgG、IgM浓度的影响
IgG、IgM是评价体液免疫功能的重要指标。如图3所示,与阴性对照组相比,随着植入时间的增加,新鲜牛骨组和BSA对照组ELISA检测的血清IgG、IgM均维持较高的水平(P<0.01)。而重组异种骨组的血清IgG、IgM仅在术后1周出现反应性升高,第2和4周的抗体水平与阴性对照组相比都无明显差异。这一结果显示,该重组异种骨不会影响Balb/c小鼠免疫球蛋白分泌水平。

图3 异种骨不影响体内血清IgG、IgM水平
Fig.3 Heterogeneous bone did not affect the levels of serum IgG and IgMinvivo
与阴性对照组比较,*P<0.05,**P<0.01。
2.5 重组异种骨植入小鼠后对植入物局部碱性磷酸酶(ALP)含量的影响
本实验通过免疫比浊法检测了不同植入时间的小鼠植入部位的ALP水平,结果显示,植入了重组异种骨并未引起植入的肌肉中ALP明显改变;而新鲜牛骨和BSA对照组,同阴性对照组相比,却均能导致局部ALP持续增加,至植入4周后ALP高达约300 U/L(图4)。
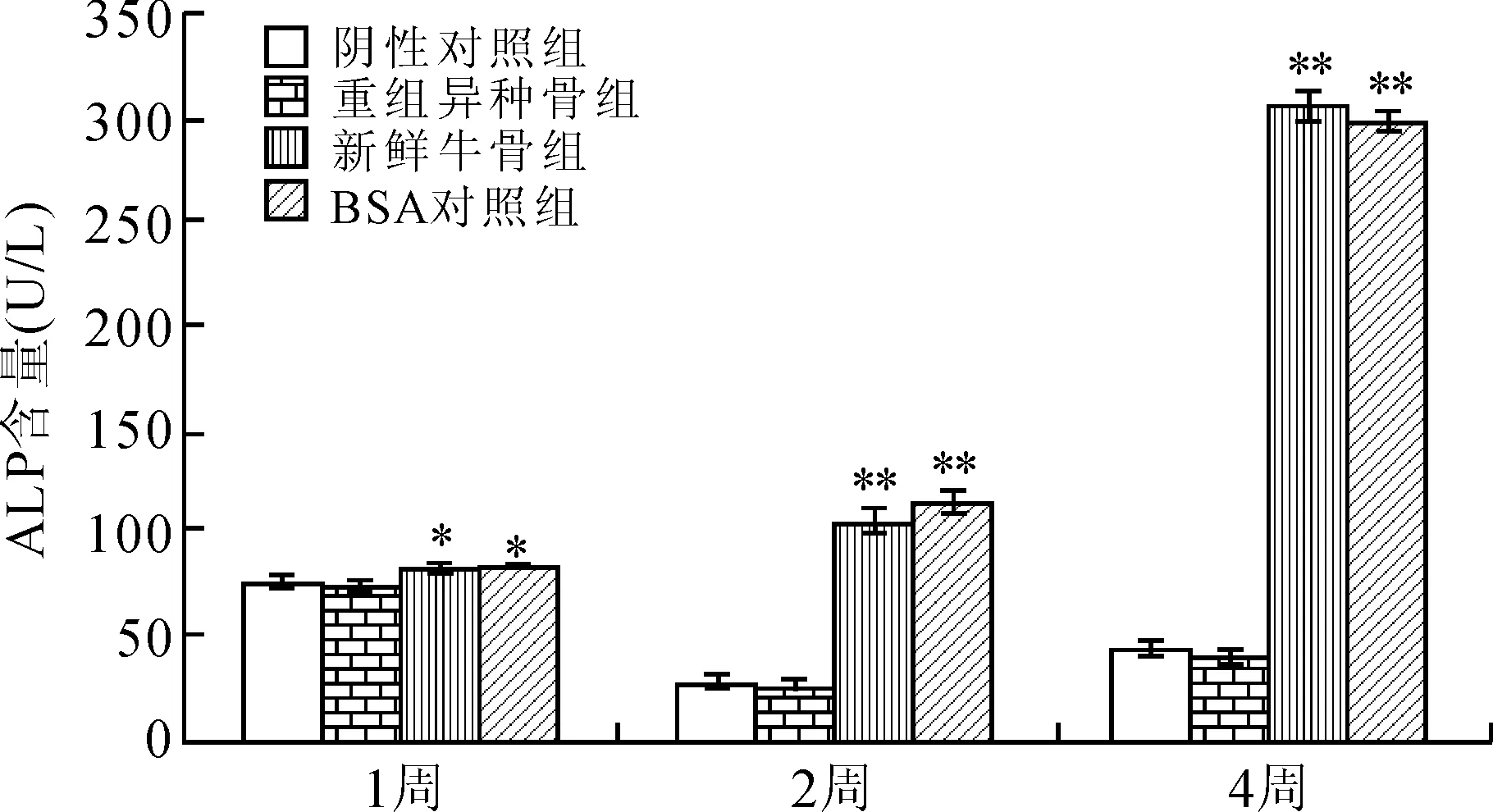
图4 异种骨不影响植入局部ALP水平
Fig.4 Heterogeneous bone did not affect the level of ALP at implantation site
与阴性对照组比较,*P<0.05,**P<0.01。
2.6 重组异种骨植入对小鼠血清中炎性因子(TNF-α、IL-6)水平的影响
通过ELISA法分别检测了小鼠血清中TNF-α和IL-6水平,发现同阴性对照组相比,除了植入重组异种骨1周后TNF-α出现短暂的升高(可能与手术引起的生理性炎症反应有关,P<0.05),此重组异种骨不会引起TNF-α和IL-6明显改变;而新鲜牛骨和BSA对照组却导致了TNF-α和IL-6持续高表达(与阴性对照组比较,P<0.01),提示炎症的持续状态(图5)。此结果也与上述补体C3和ALP水平相一致。本研究所用异种骨材料不会导致小鼠的炎症反应。
2.7 重组异种骨植入对小鼠外周血单个核细胞(PBMC)分群和活化的影响
在不同处理时间(植入后第1、2、4周),用流式细胞术检测了Balb/c小鼠PBMC中各类淋巴细胞亚群,结果如图6所示,与阴性对照组相比,重组异种骨植入组CD3+PBMC、CD4+PBMC、CD8+PBMC的百分比无明显差异。同时,分析这些淋巴细胞的活化发现,植入新鲜牛骨能上调PBMC中各T细胞亚群CD69表达(与阴性对照组比较,P<0.05),促进T细胞活化;而重组异种骨则不会影响T细胞活化(图7)。继而,通过CD19分子分析了Balb/c小鼠外周血中B细胞,发现重组异种骨不会影响B细胞的表达水平;而植入新鲜牛骨能显著促进B细胞(CD19+PBMC)百分比(图8,与阴性对照组比较,P<0.05)。且B细胞的检测结果也与上述血清中IgG、IgM含量相一致。通过检测PBMC中T、B细胞的比例活化,说明该异种骨材料不能引起Balb/c小鼠的细胞和体液免疫反应。

图5 重组异种骨不影响体内血清TNF-α和IL-6水平
Fig.5 Heterogeneous bone did not affect the levels of serum TNF-α and IL-6invivo
与阴性对照组比较,*P<0.05,**P<0.01。
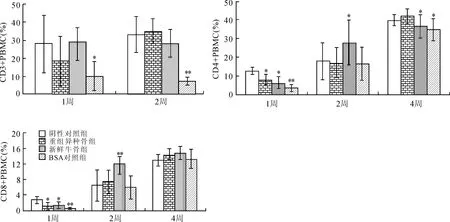

图6 重组异种骨不影响Balb/c小鼠体内PBMC分群Fig.6HeterogeneousbonedidnotaffecttheproportionofPBMCsfromBalb/cmiceinvivo与阴性对照组比较,*P<0.05,**P<0.01。
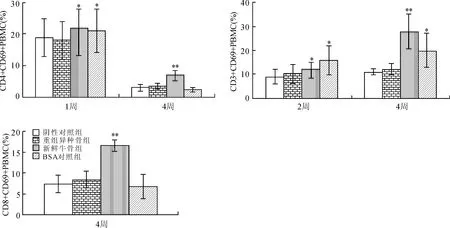
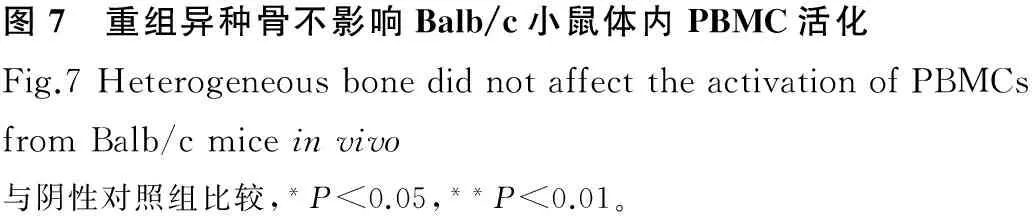
图7 重组异种骨不影响Balb/c小鼠体内PBMC活化Fig.7HeterogeneousbonedidnotaffecttheactivationofPBMCsfromBalb/cmiceinvivo与阴性对照组比较,*P<0.05,**P<0.01。

图8 重组异种骨不影响Balb/c小鼠体内外周血CD19+PBMC表达
Fig.8 Heterogeneous bone did not affect the expression of CD19+PBMCs from Balb/c miceinvivo
与阴性对照组比较,*P<0.05,**P<0.01。
2.8 重组异种骨植入对小鼠淋巴结(LN)中淋巴细胞分群的影响
进一步分析了植入部位引流淋巴结中相应的淋巴细胞表型,结果如图9所示。植入重组异种骨4周后,淋巴结中CD3+、CD4+、CD8+T细胞占总淋巴细胞的比例与阴性对照组相比无明显差异;但新鲜牛骨组和BSA对照组CD3+、CD4+T细胞的比例显著低于阴性对照组。此外,植入重组异种骨不会影响淋巴结中B细胞的表达水平,而新鲜牛骨和BSA处理能促进B细胞比例的持续增多(与阴性对照组比较,P<0.01)。
3 讨 论
异种骨因有着与人骨相似的结构,且其来源范围广,经适当处理可作为骨移植替代材料,故异种骨已越来越多的作为骨缺损替代物和椎间融合器等在临床上使用,有效地避免了2次手术所带来的创伤和感染风险。目前常采用的异种骨处理方法又深低温冷冻、反复冻融、煅烧、交联、脱蛋白、辐照或多种方法联合运用,不同的处理方法对其生物学特性存在不同的影响[7],如目前已上市的异种骨Kiel骨、Bio-OSS等,抗原性低,非常疏松易碎,缺乏力学强度及骨诱导活性,仅作为骨缺损填充材料用于牙周外科发挥传导成骨作用[3]。但实际应用过程中,由于大量存在的异种骨主要组织相容性复合物(major histocompatibility complex, MHC)[2]、α-半乳糖基抗原(α-Gal抗原)[8-9]等抗原物质,能够活化T细胞和B细胞,引起细胞免疫应答和体液免疫应答,由此产生的抗体和细胞均能介导细胞毒作用并溶解靶细胞,最终导致免疫排斥反应[10]。因此,异种骨的使用,必须在消除其免疫原性的前提下,使其具有与同种骨相似的效果,从而避免其免疫毒性作用而广泛用于临床治疗。
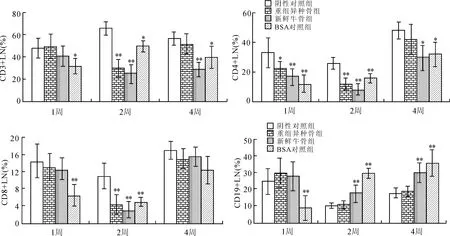
图9 重组异种骨不影响Balb/c小鼠体内淋巴结中淋巴细胞分群
Fig.9 Heterogeneous bone did not affect the proportion of lymphocytes in lymph node from Balb/c miceinvivo
与阴性对照组比较,*P<0.05,**P<0.01。
广东冠昊生物科技股份有限公司研发的重组异种骨,已在中国药品生物制品检定所完成产品的注册检验工作,试验已证实:该异种骨无免疫原排斥反应,生物相容性较好,具有良好的生物安全性[10-13],且不会对神经系统的生长和功能等产生影响[14]。本研究通过细胞毒性实验,免疫毒性的功能性检测如淋巴细胞转化实验,非功能性检测如Balb/c小鼠的血清补体C3、免疫球蛋白(IgG、IgM)含量,炎症因子(TNF-α,IL-6)水平以及外周血PBMC分群(CD4+T细胞、CD3+T细胞、B细胞)活化等一系列体外、体内实验动态审视该异种骨植入介导的全身免疫毒性;此外,还凭借植入局部的肌肉ALP水平测定和植入部位临近的引流淋巴结中淋巴细胞分群和活化的分析,进一步明确该异种骨参与的局部免疫应答。
细胞毒性实验结果表明,重组异种骨的试验液对小鼠成纤维细胞(L929)无细胞毒性,对人PBMC亦无免疫刺激作用。动物实验数据显示,与阴性对照组相比,新鲜牛骨组的血清中补体C3明显升高(图2),这一结果也与图3、图5中血清免疫球蛋白(IgG、IgM)和炎症因子(TNF-α、IL-6)水平升高相一致,说明植入新鲜牛骨可引起明显的炎症反应;而重组异种骨植入未引起上述炎症表现。免疫球蛋白和炎症因子的含量与PBMC的比例和活化水平密不可分。如图3、图8所示,与阴性对照组相比,新鲜牛骨组的血清IgG、IgM与外周血B淋巴细胞含量一致,均在较高水平;图5~7提示,新鲜牛骨组的血清TNF-α、IL-6与外周血T淋巴细胞的含量、活化水平密切相关,均较阴性对照组相比明显升高;而重组异种骨组的血清IgG、IgM、TNF-α、IL-6,外周血T、B淋巴细胞的含量均与阴性对照组相比无明显差异,表明该重组异种骨不能引起Balb/c小鼠的细胞和体液免疫反应。
植入局部免疫反应的结果显示,与阴性对照组相比,新鲜牛骨组的肌肉局部ALP高表达,且ALP与成骨、炎症和恶性肿瘤等密切相关[15],而重组异种骨植入未能引起ALP的异常改变(图4);同时,新鲜牛骨组的淋巴结B淋巴细胞亦显著增加,而重组异种骨组淋巴结淋巴细胞与阴性对照组相比均无明显差异(图9),表明重组异种骨不会造成Balb/c 小鼠的局部免疫毒性反应,进一步证实该重组异种骨对机体的免疫系统不会造成毒性反应,具有良好的免疫安全性,说明此重组异种骨有望成为一种理想的骨缺损修补材料。
然而,本研究还存在一些不足之处,比如,在天然免疫中发挥关键作用的自然杀伤细胞(NK)细胞,其是否参与了重组异种骨介导的免疫毒性反应;我们虽然发现重组异种骨植入不会引起血清补体C3的改变,但是否会影响其活化型C3a或C3b的水平;IgE,介导急性和超急性抑制排斥反应的抗体,是否也参与了重组异种骨介导的免疫毒性反应等一系列问题有待进一步的试验来揭示。
综上所述,本文从免疫学角度,从功能性和非功能性两个方面检测了重组异种骨介导的小鼠免疫毒性反应。实验结果表明,重组异种骨肌肉植入4周后,外周血中淋巴细胞分群活化,炎性因子、血清补体C3及IgG、IgM水平与对照组无明显差异。此外,肉眼观察植入部位无红肿、可见囊腔形成,肌肉中ALP含量与对照组无明显差异,且植入部位引流淋巴结中淋巴细胞分群也与对照组无明显差异。由此说明,该重组异种骨不能引起小鼠免疫毒性反应,从而为重组异种骨材料的临床应用提供实验数据和理论依据。
[1] BAUER TW. Bone graft substitutes[J]. Skeletal Radiol, 2007, 36(12):1105-1107.
[2] NIEMEYER P, SCHÖNBERGER TS, HAHN J, et al. Xenogenic transplantation of human mesenchymal stem cells in a critical size defect of the sheep tibia for bone regeneration[J]. Tissue Eng Part A, 2010, 16(1):33-43.
[3] CHARALAMBOS C, MARILYN B, ANDREW G. Poor results after augmenting autograft with xenograft (Surgihone) in hip revision surgery: a report of 27 cases[J]. Acta Orthop, 2005, 76(4):544-549.
[4] Biological evaluation of medical devices-Part 12: Sample preparation and reference materials: ISO10993-12: 2007[S].
[5] Biological evaluation of medical devices-Part 5: Tests forinvitrocytotoxicity: ISO10993-5: 2009[S].
[6] Biological evaluation of medical devices-Part 20: Principles and methods for immunotoxicology testing of medical devices: ISO/TS 10993-20:2006[S].
[7] HASHIZUME H, TAMAKI T, OURA H, et al. Changes in the extracellular matrix on the surface of sintered bovine bone implanted in the femur of a rabbit: an immunohistochemical study[J]. J Orthop Sci, 1998, 3(1):42-53.
[8] MARILIA C, JEFFREY LP. Xenotransplantation and other means of organ replacement[J]. Nat Rev Immunol, 2001, 1(2):154-161.
[9] GALILI U. Xenotransplantation and ABO incompatible transplantation: the similarities they share[J]. Transfus Apher Sci, 2006, 35(1):45-58.
[10] MCMANIGLE W, PAVLISKO EN, MARTINU T. Acute cellular and antibody-mediated allograft rejection[J]. Semin Respir Crit Care Med, 2013, 34(3):320-35.
[11] 黄金龙,夏虹. 去抗原异种骨的制备及复合异种骨的研究进展[J]. 中国骨科临床与基础研究杂志, 2012, 4(3):227-232.
[12] 黄金龙,夏虹,李丽华,等. 异种骨与成骨细胞体外生物相容性研究[J]. 中国矫形外科杂志, 2014, 22(2):158-162.
[13] 李丽华,黄金龙,李梅,等. 异种骨对骨髓间充质干细胞活性及成骨诱导的分化影响[J]. 中华手外科杂志, 2014, 30(1).
[14] 王贤美,李娜,侯丽,等. 重组异种骨材料对神经元细胞的安全性评价[J]. 山东大学学报(医学版), 2014, 52(11):16-20.
[15] KOURTZELIS I, RAFAIL S, DEANGELIS RA, et al. Inhibition of biomaterial-induced complement activation attenuates the inflammatory host response to implantation[J]. FASEB J, 2013, 27(7):2768-2776.
(编辑 卓选鹏)
Effect of heterogeneous bone on the immune system of Balb/c mice
SUN Xiao-xia, GAI Xiao-xiao, SUN Li-kui, WANG Xian-mei, QIU Shi-dong, HOU Li
(Jinan Quality Supervision and Inspection Center for Medical Devices,State Food and Drug Administration; Key Laboratory of Biological Evaluation of Medical Devices of Shandong Province, Jinan 250101, China)
Objective To make a dynamic evaluation of the immunotoxicology caused by heterogeneous bone implantation and reveal its immunological mechanisms. Methods Heterogeneous bone was provided by Guangdong Grandhope Biotech Co., Ltd. Immunology of Balb/c mice by blood biochemical analysis, ELISA and flow cytometry after the test of lymphocyte transformationinvitro. We dynamically monitored the immunological changes Balb/c mice after 1 week, 2 weeks and 4 weeks of muscle implantation to evaluate the immunological effect of the heterogeneous bone on the body. Results Our experiments showed that the heterogeneous bone did not cause immune stimulation of lymphocytesinvitro, and there were no differences between implantation of heterogeneous bone and the sham operation in the levels of C3, IgG, IgM, inflammatory factors (TNF-α and IL-6) in serum and ALP in implantation site. Moreover, heterogeneous bone implantation did not affect the proportion or activation of peripheral blood mononuclear cells (PBMCs) and lymphocytes in the lymph node. Conclusion The heterogeneous bone cannot mediate immunotoxicologyinvivo, which may provide experimental data and theoretical basis for clinical application of heterogeneous bone.
heterogeneous bone; immunotoxicology; Balb/c mouse
2014-10-31
2015-09-29
山东省自然科学基金青年基金项目(No.ZR2014CQ041);再生型医用置入器械国家工程实验室PI项目(No.2012NELRMD007) Supported by the Youth Project of Natural Science Foundation of Shandong Province (No.ZR2014CQ041) and the State Engineering Laboratory PI Project of Renewable Medicinal Implantation Devices (No.2012NELRMD007)
孙晓霞. E-mail: sun2x@163.com
R318.08
A
10.7652/jdyxb201601004
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20151216.1843.002.html(2015-12-16)

