c-Jun氨基末端激酶信号通路参与电刺激大鼠三叉神经节偏头痛模型降钙素基因相关肽表达调控
张金璐,陈新林,吕海侠,刘 勇,罗国刚
(西安交通大学:1. 第一附属医院神经内科,陕西西安 710061;2. 医学部神经生物学实验室,陕西西安 710061)
c-Jun氨基末端激酶信号通路参与电刺激大鼠三叉神经节偏头痛模型降钙素基因相关肽表达调控
张金璐1,陈新林2,吕海侠2,刘 勇2,罗国刚1
(西安交通大学:1. 第一附属医院神经内科,陕西西安 710061;2. 医学部神经生物学实验室,陕西西安 710061)
目的 探究c-Jun氨基末端激酶(c-Jun N-Terminal Kinase, JNK)信号转导通路对电刺激大鼠三叉神经节(TG)偏头痛模型中降钙素基因相关肽(CGRP)表达调控的作用。方法 成年雄性SD大鼠随机分为空白对照组、假手术组、模型组、DMSO+模型组、SP50+模型组、SP25+模型组。采用电刺激大鼠单侧TG制作偏头痛模型,选择JNK信号通路特异性阻滞剂SP600125为干预药物。观察偏头痛造模前后的行为学变化。各组大鼠处理后24 h,Western blot检测TG中磷酸化JNK蛋白(p-JNK)和JNK蛋白表达量并计算磷酸化比率,免疫组织化学染色检测CGRP表达量。结果 大鼠造模后前肢挠头次数增加、爬笼次数减少(P<0.05)。模型组、假手术组、DMSO+模型组、SP25+模型组大鼠TG内p-JNK比率较空白对照组明显升高(P<0.05);SP50+模型组TG内p-JNK比率较模型组、SP25+模型组明显降低(P<0.05);模型组TG内CGRP表达量较空白对照组、SP50+模型组明显升高(P<0.05);模型组刺激侧TG内CGRP表达量明显高于未刺激侧。结论 电刺激大鼠单侧TG可使偏头痛急性发作过程中关键的神经血管活性肽CGRP表达升高,引发大鼠行为学变化,且JNK信号通路参与了TG内CGRP的表达调控过程。
偏头痛;三叉神经节;降钙素基因相关肽(CGRP);JNK;SP600125
偏头痛是神经科一种常见的慢性复发性疾病,给患者、家庭和社会带来沉重负担。偏头痛的发病机制尚未完全阐明。较为广泛接受的是三叉神经-血管学说[1],电刺激大鼠三叉神经节(trigeminal ganglion, TG)可以诱发三叉神经支配区血浆蛋白外渗[2]、以降钙素基因相关肽(calcitonin gene-related peptide, CGRP)为代表的血管活性肽类物质释放增加,局部脑膜血流变化等非特异性炎症反应[3-4]。偏头痛发作与血清内CGRP水平变化的显著相关性是三叉神经-血管学说的核心[5]。本研究前期实验证实细胞内有丝分裂型细胞内丝裂原激活的蛋白激酶(MAPK)信号转导通路中的ERK1/2和C-Jun氨基末端激酶(JNK)通路均参与了TG离体培养后CGRP表达上调[6]。本研究旨在探究JNK信号通路对电刺激大鼠TG偏头痛模型中CGRP表达的调控作用。
1 材料与方法
1.1 主要试剂与器材
同心圆电极(Microprobes公司);CGRP特异性抗体(Abcam公司,1∶400);c-Jun氨基末端激酶(JNK)、磷酸化c-Jun氨基末端激酶(p-JNK)特异性抗体(CST公司,1∶10 000);JNK信号通路特异性抑制剂SP600125(CST公司)10 mg,溶于二甲基亚砜(DMSO)中制成母液,浓度为25 mmol/L,-20 ℃保存,工作液仍使用DMSO稀释,推荐浓度为20~50 μmol/L。
1.2 动物分组及电刺激TG偏头痛模型制作
选择SPF级SD雄性大鼠54只,体质量300~400 g,由西安交通大学医学部实验动物中心提供,并获得西安交通大学动物实验管理委员会批准。
造模电刺激TG偏头痛模型方法为:100 g/L水合氯醛全身麻醉大鼠并固定,头顶正中剪毛、“十”字切开皮肤,刮除软组织暴露颅骨表面,标记前囟;利用立体定位仪定位右侧(刺激侧)前囟后3.2 mm、旁开3.0 mm位置,牙科钻钻孔,缓慢将电极插入,深度约9.5~10 mm;连接同心圆电极-导线-电流输出装置,调整恒定输出电流1 mA,周期200 ms,波宽5 ms,持续时间5 min[3-4,7];刺激结束后,将电极缓慢垂直提拉拔出电极,缝合头皮切口并擦涂红霉素软膏。大鼠侧卧至麻醉复苏。观察大鼠的行为学变化。
将大鼠随机分为对照组、假手术组、模型组、DMSO+模型组、SP50+模型组、SP25+模型组。对照组不做任何手术处理或者药物干预;假手术组仅在电刺激部位使用牙科钻打孔,电极插入5 min但不进行电刺激;其余各组均造模,其中模型组仅进行电刺激TG偏头痛造模;DMSO+模型组同时进行干预药物SP600125的溶剂DMSO侧脑室注射;SP50+模型组、SP25+模型组同时分别进行干预药物50、25 μmol/L SP600125侧脑室注射。
1.3 免疫组织化学法检测CGRP表达
将大鼠用40 g/L多聚甲醛灌注固定,解剖TG进行冰冻切片,晾干于4 ℃保存。湿盒中复温、PBS溶液浸泡后,用3 mL/L Triton X-100浸泡30 min、PBS冲洗后使用30 mL/L H2O2溶液浸泡10 min并冲洗。用100 mL/L山羊血清室温封闭1 h,弃去擦干,滴加1∶400兔抗大鼠CGRP抗体,室温孵育2 h后4 ℃过夜。次日滴加羊抗兔二抗试剂、辣根过氧化物酶试剂,室温分别孵育2 h后冲洗、擦干。配制DAB显色,脱水、透明、封片。每组选择>6张10倍镜图片,使用Image-Pro Plus 5.0进行平均吸光度值(AA)和累积吸光度值(IA)分析。
1.4 Western blot检测p-JNK和JNK表达
将大鼠使用冰生理盐水灌注固定,解剖TG,提取蛋白并煮样,进行电泳,设置参数80 V,30 min;120 V,2 h。转膜后,将PVDF膜置于牛奶中室温封闭2 h。使用PBST稀释一抗(1∶10 000),封膜后室温孵育2 h、4 ℃摇床过夜。次日加二抗(1∶5 000)室温孵育2 h。结束后PBST洗膜,暗室内显影。对胶片使用Image J 2X软件进行灰度值(DPI)分析,并利用获得数据计算每组p-JNK比率。
1.5 统计学处理

2 结 果
2.1 偏头痛模型对大鼠行为学的影响
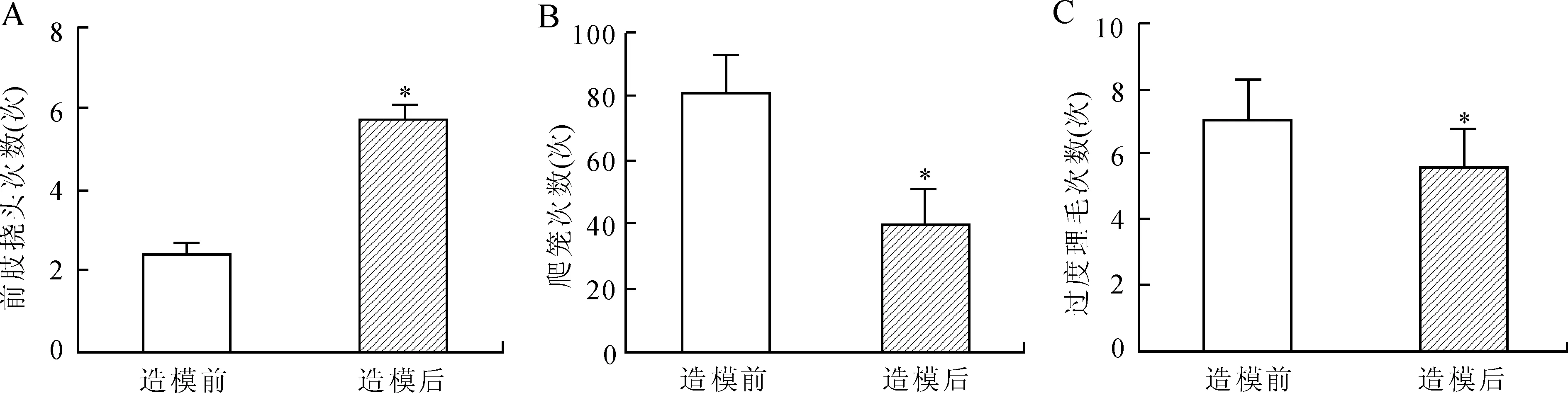
图1 电刺激大鼠三叉神经节模型塑造前后的大鼠行为学变化
Fig.1 Rats’ behavioral changes before and after the model surgery
A:平均前肢挠头次数;B:平均爬笼次数;C:平均过度理毛次数。与造模前比较,*P<0.05。
2.2 偏头痛模型及SP600125对JNK磷酸化的影响
各组大鼠分别干预24 h后,用Western blot检测TG内JNK与p-JNK,并进行灰度值(DPI)分析,进一步计算p-JNK/JNK比率,并进行单因素方差分析。结果显示,与空白对照组相比,假手术组、模型组、DMSO+模型组大鼠TG内p-JNK比率明显升高(P值分别为0.049、0.017、0.009);假手术组较对照组p-JNK比率明显升高(P=0.049),而与模型组之间无明显差异(P=0.628),但无超过模型组趋势;SP50+模型组TG内p-JNK比率较模型组明显降低(P=0.047),而SP25+模型组无此趋势(P=0.325,图2)。
2.3 偏头痛模型及SP600125对TG内CGRP表达的影响
取空白对照组、模型组以及SP50+模型组各6只大鼠TG进行免疫组织化学染色,并进行AA和IA分析显示,模型组TG内CGRP IA明显高于对照组(P=0.000)和SP50+模型组(P=0.000),而SP50+模型组与空白对照组无明显差异(P=0.807)。3组之间比较AA差异均无统计学意义(图3、4)。另外,对于模型组大鼠右(刺激侧)、左(未刺激侧)TG内CGRP表达情况进行检测,右侧(刺激侧)CGRP表达情况明显高于左侧(未刺激侧),P=0.002(图4)。
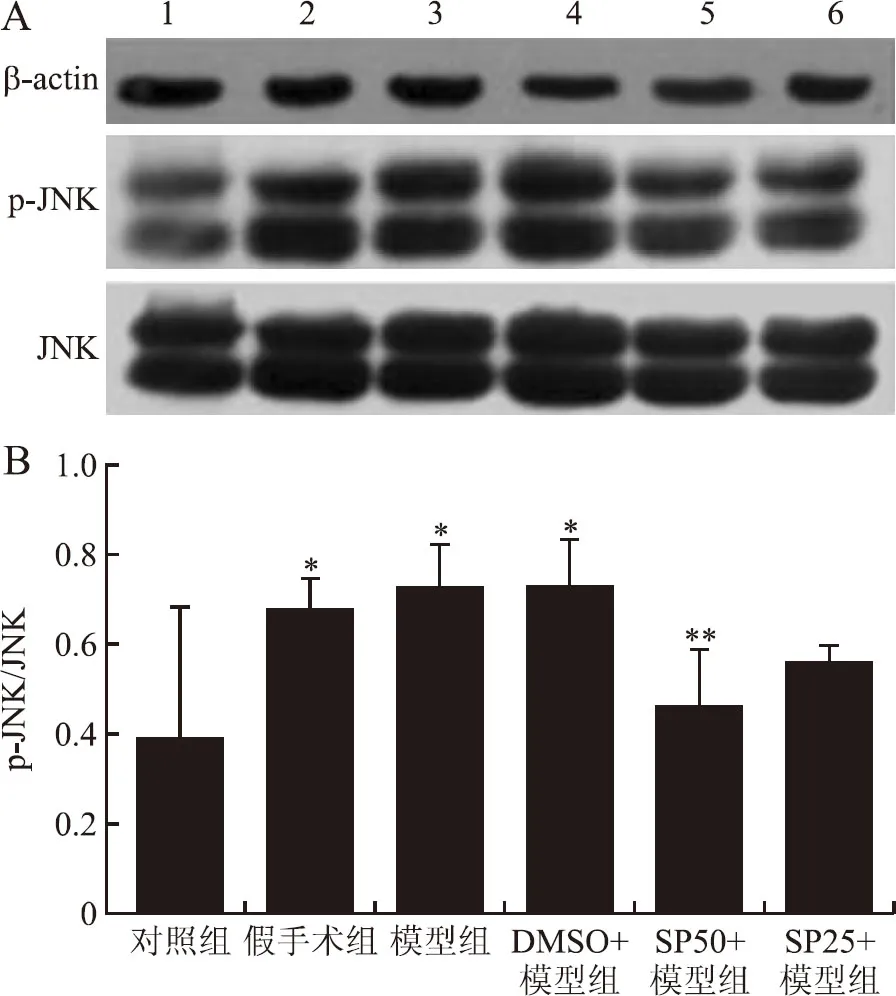
图2 各组大鼠TG内JNK和p-JNK表达及p-JNK/JNK比率变化
Fig.2 The expressions of p-JNK and JNK and the ratio of p-JNK/JNK in each group
A:1~6分别为对照组、假手术组、模型组、DMSO+模型组、SP50+模型组、SP25+模型组;B:各组p-JNK/JNK比率:与对照组比较,*P<0.05;与模型组比较,**P<0.05。

图3 三叉神经节内降钙素基因相关肽(CGRP)免疫组织化学染色
Fig.3 The expression of CGRP in TG detected by immunohistochemistry (×10)
A:空白对照组;B:SP50+模型组(50 μmol/L SP600125)刺激侧;C:模型组刺激侧;D:模型组未刺激侧(C中黑色箭头所指为典型CGRP阳性细胞)。

图4 三叉神经节内降钙素基因相关肽(CGRP)免疫组织化学染色结果的统计学分析
Fig.4 The expression of CGRP in TG detected by immunohistochemistry
A:CGRP阳性染色AA比较;B:CGRP阳性染色IA比较,3组总体P=0.000,模型组明显高于对照组(*P=0.000)和SP50+模型组(**P=0.000),而对照组和SP50+模型组间无明显差异(P=0.807)。C:模型组CGRP染色IA比较,刺激侧明显高于未刺激侧,**P=0.002。
3 讨 论
根据解释偏头痛发病机制的血管源性学说[8]、皮层扩散抑制学说[9]、三叉神经血管学说,研究人员分别构建出了多种偏头痛动物模型。综合考虑通路激活的特异性、实验动物复制难易程度等因素,最终选择以三叉神经血管学说为基础的电刺激大鼠TG作为本研究的模型。
在三叉神经-血管学说中,偏头痛发作时存在无菌性炎症、TVS激活及血管舒缩异常等核心过程[10],其中起到重要作用的是CGRP。实验研究结果显示,受到有效刺激后,三叉神经的反射活动引起CGRP释放量增多可以导致偏头痛发生[11]。CGRP在TG内含量最为丰富,其合成表达量可以作为判断TG激活程度的标志,而在本研究相关的前期研究也证实,TG体外培养模型中,存在CGRP释放增高[6,12-13]。在电刺激大鼠TG时,可以明显看到刺激侧的口鼻分泌物增多和咀嚼肌及眼肌收缩,提示电极对于TG形成了有效刺激。在后续的蛋白检测中发现,刺激侧的TG内CGRP表达明显升高,与其他研究学者进行的研究结果一致[5,14],证明了该模型科学有效模拟了TVS的激活过程。另外,模型组大鼠刺激侧CGRP表达明显高于未刺激侧,说明起源于一侧的TVS激活所导致的CGRP表达升高主要限于该侧,这可能是偏头痛呈现偏侧发作的机制之一。
研究表明,多种大鼠偏头痛模型会引起其行为学改变[15-17],行为学结果显示,电刺激后24 h,大鼠前肢挠头次数明显增加,爬笼次数明显减少,过度理毛次数前后无明显差异。分析该结果的原因可能为:为了完全消除麻药对于行为学的影响,选择了手术后24 h进行观察。在这一过程中,TG损伤导致的TVS激活态而引起的生理不适持续存在,故前肢挠头次数增加,而由于时间过久大鼠已经由躁狂多动状态转为抑郁,逃跑欲望不强烈,因而导致爬笼次数的减少。后期需进一步扩大样本量、规范行为学观察环境,完善该模型对于大鼠行为学影响的数据资料。
JNK系统是MAPK信号转导系统的3条信号通路之一。本研究所在项目的前期实验进行了以体外培养TG模型为基础的研究,结果显示离体TG内CGRP水平升高,而MAPK通路中的ERK1/2通路和JNK通路均参与了该调节过程,其中JNK信号通路起到了更为关键的作用[6]。因此本研究将调节CGRP表达的焦点定位于JNK信号通路。本研究结果显示,电刺激TG可以激活JNK通路,并可被浓度50 μmol/L的SP600125所阻断;而25 μmol/L浓度组却未见明显阻断,提示SP600125的阻断作用可能存在剂量依赖性。本研究的假手术组大鼠TG也存在部分JNK信号蛋白激活,可能与电极插入所带来的机械性损伤有关,说明机械损伤可能也会激活JNK信号通路,机械刺激和电刺激可相互叠加,JNK信号通路的活化过程。
为了验证JNK信号通路是否参与了CGRP表达的调控,本研究对比了模型组和SP50+模型组大鼠TG内CGRP的表达,结果显示:模型组大鼠TG内CGRP阳性颗粒的累积吸光度值(IA)明显高于SP50+模型组大鼠,提示JNK信号通路特异性阻断剂SP600125可以阻断CGRP的升高,提示JNK信号通路参与了电刺激大鼠TG所介导的CGRP的表达上调的调控过程。
综合以上分析,认为该模型可以模拟偏头痛发作过程,过程中存在JNK信号通路的激活,并介导了刺激侧CGRP表达升高。目前偏头痛的治疗已经由单纯干预血管舒张所引发的症状,发展为特异性阻断CGRP受体来直接调节血管舒缩情况,其针对性、特异性、精细程度均有了长足的进步。本实验在前期研究的基础上,在大鼠活体水平证实了JNK信号通路参与偏头痛发病过程中重要分子CGRP的表达调控,为进一步从分子水平研究安全有效的JNK抑制剂,从更上游水平阻断甚至预防偏头痛发病提供基础研究数据。
[1] HO TW, EDVINSSON L, GOADSBY PJ. CGRP and its receptors provide new insights into migraine pathophysiology[J]. Nat Rev Neurol, 2010, 6(10):573-582.
[2] 于生元,匡培根,张凤英,等. 电刺激三叉神经节诱发三叉神经分布区血浆蛋白外渗[J]. 中国疼痛医学杂志, 1996, 2:109-113.
[3] 沈飞飞,万琪,季燕,等. 电刺激三叉神经节诱导偏头痛大鼠脑膜非特异炎症[J]. 神经病学与神经康复学杂志, 2009, 6:47-51.
[4] 刘婷,沈飞飞,韦俊超,等. 头痛宁对电刺激三叉神经节大鼠脑膜血流与CGRP的影响[J]. 中国疼痛医学杂志, 2010, 16:220-223.
[5] JUHASZ G, ZSOMBOK T, MODOS EA, et al. NO-induced migraine attack: strong increase in plasma calcitonin gene-related peptide (CGRP) concentration and negative correlation with platelet serotonin release[J]. Pain, 2003, 106(3):461-470.
[6] 罗国刚,雷莉,樊文静,等. 三叉神经节离体培养后降钙素基因相关肽调变的细胞内信号转导机制研究[J]. 中国临床神经科学, 2010, 18 (2):113-118.
[7] WANG X, FANG Y, LIANG J, et al. Selective inhibition of 5-HT7 receptor reduces CGRP release in an experimental model for migraine[J]. Headache, 2010, 50(4):579-587.
[8] ARULMANI U, GUPTA S, VANDENBRINK AM, et al. Experimental migraine models and their relevance in migraine therapy[J]. Cephalalgia, 2006, 26(6):642-659.
[9] LAURITZEN M. Pathophysiology of the migraine aura. The spreading depression theory[J]. Brain, 1994, 117(Pt 1):199-210.
[10] BUZZI MG, MOSKOWITZ MA. The trigemino-vascular system and migraine[J]. Pathol Biol (Paris), 1992, 40(4):313-317.
[11] MCCULLOCH J, UDDMAN R, KINGMAN TA, et al. Calcitonin gene-related peptide:functional role in cerebrovascular regulation[J]. Proc Natl Acad Sci USA, 1986, 83(15):5731-5735.
[12] LUO GG, LEI L, FAN WJ, et al. Intracellular mechanism on the modulation of CGRP after organ culture of rat trigeminal ganglion[J]. Chin J Clin Neurosci, 2010, 18(2):113-118.
[13] 罗国刚,袁兴运,袁博博,等. 肿瘤坏死因子α、白介素1β和舒马曲坦对大鼠三叉神经节离体培养后降钙素基因相关肽mRNA表达水平的影响[J]. 西安交通大学学报(医学版), 2012, 33 (3):276-280.
[14] EDVINSSON L, EKMAN R, JANSEN I, et al. Calcitonin gene-related peptide and cerebral blood vessels: distribution and vasomotor effects[J]. J Cereb Blood Flow Metab, 1987, 7(6):720-728.
[15] 李征,于生元,梁景耀,等. 反复电刺激大鼠上矢状窦后的抑郁行为学表现[J]. 中国实验动物学报, 2012, 20 (2):6-10.
[16] 张红岩,于挺敏,毛西京,等. 雌激素对偏头痛大鼠行为学改变及中脑导水管周围灰质5-HT表达的影响[J]. 吉林大学学报(医学版), 2008, 34 (1):131-134.
[17] 王淑华,武胜昔,周亮,等. 雌激素对偏头痛大鼠三叉神经节内降钙素相关基因肽mRNA表达的影响[J]. 第四军医大学学报, 2004, 25 (16):1488-1491.
(编辑 国 荣)
The mechanism of c-Jun N-terminal kinase signaling transduction pathway in calcitonin gene-related peptide of rat migraine model via stimulating trigeminal ganglion by electrode
ZHANG Jin-lu1, CHEN Xin-lin2, LÜ Hai-xia2, LIU Yong2, LUO Guo-gang1
(1. Department of Neurology, the First Affiliated Hospital of Xi’an Jiaotong University,Xi’an 710061; 2. Laboratory of Neurobiology, Xi’an Jiaotong University Health Science Center, Xi’an 710061, China)
Objective To explore the mechanism of c-Jun N-terminal kinase (JNK) signaling transduction pathway in calcitonin gene-related peptide (CGRP) of rat trigeminal ganglion (TG) migraine model. Methods We randomly divided adult male SD rats into control, sham-operation, model, DMSO+model, SP50+model, and SP25+model groups. We built the rat migraine model by stimulating TG with electrode and chose SP600125 as the intervention drug. We observed the behavior changes of rats before and after the surgery. The expressions of p-JNK and JNK protein were detected by Western blot, and the expression of CGRP in TG was detected by immunohistochemistry. Results After the stimulation, the number of times of head scratching was significantly higher than before (P<0.05) while the number of times of cage climbing was significantly lower than before (P<0.05). The ratio of p-JNK/JNK in TG was significantly higher in model, sham, DMSO+model, and SP50+model groups than in control group (P<0.05), while the ratio in SP50+model group was lower than that in model and SP25+model groups (P<0.05). The expression of CGRP in TG was significantly higher in model group than in control and SP50+model groups (P<0.05). Conclusion This rat migraine model can simulate the process of migraine attack, cause the model rats’ behavioral change and activate JNK signaling pathway. JNK signaling pathway participates in the regulation of the expression of CGRP in TG.
migraine; trigeminal ganglion (TG); calcitonin gene-related peptide (CGRP); Jun N-terminal kinase (JNK); SP600125
2015-05-19
2015-09-15
国家自然科学基金资助项目(No.81271127) Supported by the National Natural Science Foundation of China (No.81271227)
罗国刚. E-mail: lguogang@163.com
R741
A
10.7652/jdyxb201601005
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20151208.1739.010.html(2015-12-08)

