抗氧化剂对过氧化氢处理的急性单核细胞白血病细胞增殖的影响
路晨阳,白改改,申秋菊,蒙 珊,惠凌云,苏 丹,张王刚,周芙玲
(西安交通大学:1. 第二附属医院血液内科,陕西西安 710004;2. 第一附属医院检验科,陕西西安 710061)
抗氧化剂对过氧化氢处理的急性单核细胞白血病细胞增殖的影响
路晨阳1,白改改1,申秋菊1,蒙 珊1,惠凌云2,苏 丹1,张王刚1,周芙玲1
(西安交通大学:1. 第二附属医院血液内科,陕西西安 710004;2. 第一附属医院检验科,陕西西安 710061)
目的 通过建立急性单核细胞白血病活性氧(ROS)细胞模型,观察抗氧化剂对其增殖的影响。方法 选用人单核细胞白血病U937细胞株,用不同浓度过氧化氢(H2O2)处理,成功建立ROS细胞模型后给予不同浓度抗氧化剂超氧化物歧化酶(SOD)处理,检测细胞增殖、细胞内ROS含量、线粒体膜电位的变化。结果 低浓度H2O2(50 μmol/L)刺激U937细胞增殖;高浓度H2O2(500 μmol/L)对U937细胞产生毒性作用。以50 μmol/L H2O2处理U937细胞48 h建立实验模型。正常U937细胞内存在少量ROS,少量凋亡细胞;50 μmol/L H2O2处理后细胞内ROS增多,线粒体膜电位升高,凋亡率下降,细胞增殖旺盛,新合成的DNA增多;加入不同浓度抗氧化剂SOD,随着SOD浓度升高,ROS含量减少,线粒体膜电位下降,凋亡率增加,细胞增殖减慢,新合成的DNA减少,表现出剂量依赖性。结论 抗氧化剂对急性单核细胞白血病细胞增殖有抑制作用,且表现剂量依赖性。
急性单核细胞白血病;活性氧自由基(ROS);抗氧化剂;细胞增殖;线粒体膜电位;超氧化物歧化酶(SOD)
活性氧(reactive oxide species, ROS)是指一类化学活性分子家族,其包括羟自由基(·OH)、超氧阴离子O2-·)、单线态氧(O2)及过氧化氢(hydrogen peroxide, H2O2)等,参与调控生物细胞功能、细胞信号转导和稳态[1-3]。有研究发现,在肿瘤细胞中可见内源性ROS水平升高[4]。ROS水平的升高与许多肿瘤细胞发展相关,可促进其恶性转化,上调存活途径和DNA损伤诱导的突变。ROS还可调节磷酸激酶、磷酸酶、氧化还原敏感的转录因子和相关基因的表达,促进恶变。研究组前期及SALLMYR等[5-9]的研究发现ROS参与急性白血病的发生发展。本研究选用人急性单核细胞白血病U937细胞株,通过模拟急性单核细胞白血病复发时的高增殖状态,研究抗氧化剂对其增殖的作用,从而为防治白血病复发的抗氧化剂药物提供实验依据。
1 材料与方法
1.1 试剂
二甲基亚砜( dimethyl sulphoxide, DMSO)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide, MTT]、超氧化物歧化酶(SOD)、H2O2均购自美国Sigma公司;EdU DNA细胞增殖检测试剂盒购自锐博生物科技有限公司;ROS检测试剂盒购自普利莱基因技术有限公司;JC-1(线粒体膜电位检测试剂盒)购自碧云天生物技术研究所;RPMI-1640培养基、胎牛血清均购自美国Hyclone。
1.2 细胞培养方法
用含100 mL/L胎牛血清、双抗(青、链霉素各100 U/100 mL)的1640培养基,在37 ℃、50 mL/L CO2条件下生长传代,实验时取对数生长期的细胞。
1.3 不同浓度HO对U937细胞的影响
1.3.1 MTT法检测不同浓度H2O2对U937细胞增殖的影响 收集对数生长期的U937细胞,调至密度为5×105/mL,接种于96孔板培养4 h,加入终浓度为0、25、50、100、150、200、500、1 000、2 000、4 000、8 000、16 000 μmol/L的H2O2作为实验组,不加药物组为阴性对照,不加细胞的1640培养液为空白组,每组设定6个复孔,重复3次。分别培养24、48、72 h,加入20 μL MTT,继续培养4 h,吸弃上清,加DMSO每孔150 μL,震荡10 min。用酶标仪检测各孔A值(λ=490 nm),计算细胞存活率,绘制U937细胞生存曲线。细胞存活率(%)=(药物组A值-空白组A值)/(对照组A值-空白组A值)×100%。并用倒置显微镜观察U937细胞形态。
1.3.2 H2O2对U937细胞内ROS的影响 严格按照ROS检测试剂盒产品手册,检测浓度为50、500 μmol/L H2O2处理U937细胞0~72 h细胞内ROS含量。
1.3.3 透射电镜观察H2O2作用U937细胞的超微结构变化 浓度为50 μmol/L H2O2处理U937细胞48 h,用25 mL/L戊二醛固定液4 ℃固定细胞,0.1 mol/L磷酸缓冲液浸洗,10 g/L四氧化锇固定液固定,0.1 mol/L磷酸缓冲液浸洗,乙醇梯度脱水,环氧树脂Epon812浸透、包埋,聚合后作半超薄切片1~2 μm,美兰染色后光学显微镜下定位,超薄切片机制作50~70 nm超薄切片,醋酸铀、柠檬酸铅染色后,透射式电子显微镜下观察、拍照。
则主塔桩基满足邻桩人工开挖要求,但为了避免施工相互影响,采取间隔交错施工,群桩开挖及浇筑顺序为:1#、8#、15#、4#、11#、18#→3#、13#、6#、16#→2#、14#、5#、17#→7#、9#、10#、12#。
1.4 不同浓度抗氧化剂对HO作用U937细胞后的影响
1.4.1 实验分组 依据上述实验结果,建立低浓度H2O2刺激细胞增殖模型(50 μmol/L H2O2处理U937细胞48 h)为模型组(即H2O2组);将H2O2组细胞密度调至2×105/mL,每孔1.0 mL接种于96孔细胞培养板上,加入不同浓度抗氧化剂SOD(20、100、300 U/L)处理48 h为实验组。并设正常U937细胞为对照组。
1.4.2 细胞内ROS的变化 严格按照活性氧检测试剂盒检测各组细胞内ROS含量。
1.4.3 线粒体膜电位的影响 分别于H2O2处理前后、不同浓度抗氧化剂处理前后,用线粒体膜电位检测试剂盒JC-1检测各组U937细胞线粒体膜电位变化;并用流式细胞仪检测细胞早期凋亡情况。
1.4.4 EdU检测细胞增殖变化 分别于H2O2处理前后、不同浓度抗氧化剂处理前后,严格按照EdU DNA细胞增殖检测试剂盒检测各组细胞增殖情况。
1.5 统计学处理

2 结 果
2.1 不同浓度HO对U937细胞存活率的影响
MTT结果显示,H2O2对U937细胞同一处理时间时,呈现出低浓度促进、高浓度抑制的双向调节作用。同一H2O2浓度作用时,随着处理时间延长,细胞存活率下降。50 μmol/L H2O2处理U937细胞48 h细胞生长状态良好、稳定(图1)。
2.2 倒置显微镜观察不同浓度HO作用后U937细胞的形态变化
低浓度H2O2(50 μmol/L)作用U937细胞后,细胞增殖活跃,数量增多,体积变大,外形规则,边缘光滑,折光性好,死亡细胞很少,活细胞数明显较正常U937细胞组多,随着H2O2浓度增加,细胞增殖逐渐减慢,数量减少,细胞变形并出现细胞碎片(图2)。
2.3 不同浓度HO作用U937细胞内活性氧变化
不同浓度H2O2处理U937细胞,随时间延长,细胞内ROS含量增加;50 μmol/L H2O2处理U937细胞后,1 h时ROS含量迅速增加,之后随时间延长细胞内ROS缓慢增加;而500 μmol/L H2O2处理U937细胞,2 h时细胞内ROS含量迅速增加,后随时间延长细胞内ROS含量缓慢增加,比50 μmol/L H2O2产生的ROS含量高(图3)。

图1 不同时间及不同浓度H2O2对U937细胞存活率的影响
Fig.1 Effects of different time and concentration of H2O2on U937 cell survival rate
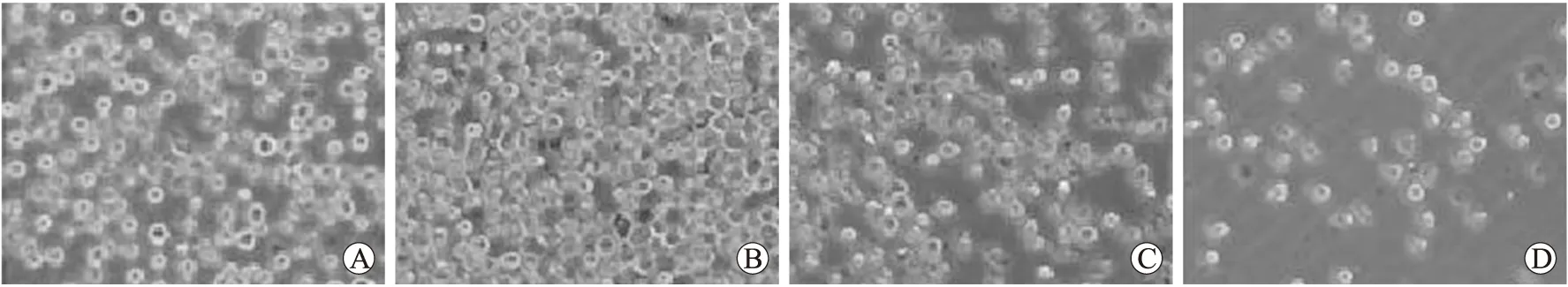
图2 不同浓度H2O2作用U937细胞后的形态变化
Fig.2 Morphological changes of U937 cells treated with different concentrations of H2O2(×40)
A:正常U937细胞;B:50 μmol/L H2O2;C:200 μmol/L H2O2;D:500 μmol/L H2O2。

图3 不同浓度H2O2处理U937细胞后不同时间点DCF荧光强度
Fig.3 DCF fluorescence intensity of U937 cells treated with different concentrations of H2O2
2.4 透射电镜观察不同浓度HO作用U937细胞的线粒体超微结构变化
正常U937细胞呈圆形,外观规则,细胞表面突起,核质比例高,核染色质丰富、分布均匀。细胞质内有较多细胞器,线粒体形态规则,结构完整。50 μmol/L H2O2处理U937细胞后细胞数量多,大小均匀,呈圆形,线粒体肿胀,嵴排列紊乱,部分可见嵴溶解,染色质轻度凝集(图4)。
2.5 荧光显微镜观察不同浓度抗氧化剂对细胞内ROS活性的影响
细胞内ROS特异性荧光探针DCF发绿色荧光。正常U937细胞内存在少量ROS,绿色荧光较弱(图5A);50 μmol/L H2O2处理U937细胞后细胞数量增多,绿色荧光增强且明显高于正常U937细胞(图5B)。50 μmol/L H2O2处理U937细胞48 h后再加入不同浓度抗氧化剂,随抗氧化剂浓度的升高,绿色荧光强度降低,表现出剂量依赖性(图5的C~E)。

图4 U937细胞线粒体超微结构变化
Fig.4 The mitochondria ultrastructural changes of U937 cells
A、B:正常U937细胞;C、D:50 μmol/L H2O2处理后U937细胞。A、C:×10 000;B、D:×30 000。
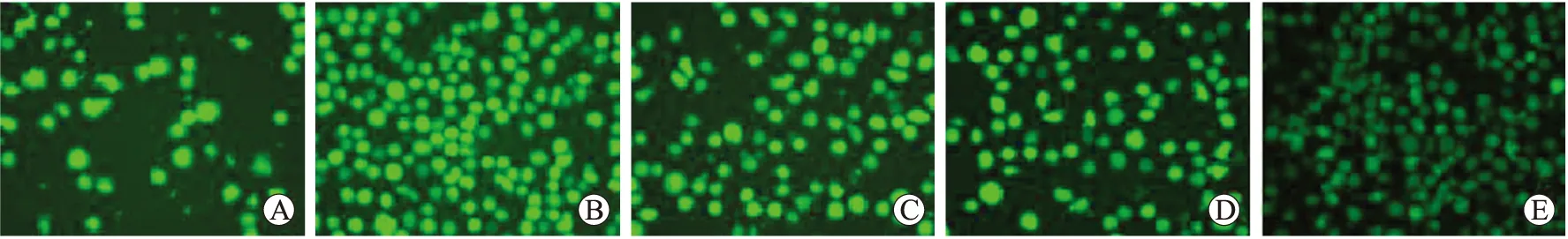
图5 U937细胞内ROS活性
Fig.5 ROS activities of U937 cells (×40)
A:对照组;B:50 μmol/L H2O2;C:50 μmol/L H2O2+20 U/L SOD;D:50 μmol/L H2O2+100 U/L SOD;E:50 μmol/L H2O2+300 U/L SOD。
2.6 流式细胞术检测不同浓度SOD作用后U937细胞线粒体膜电位的变化
线粒体膜电位较高时,JC-1在线粒体内形成多聚体,其发射光为红色荧光;细胞凋亡时,线粒体膜电位下降,JC-1以单体的形式存在于胞质内发绿色荧光。正常U937细胞绿色荧光较弱,红色荧光较强,即正常U937细胞存在少量凋亡细胞;50 μmol/L H2O2处理U937细胞后绿色荧光减弱,红色荧光增强,即H2O2作用U937细胞后细胞增殖旺盛,线粒体膜电位升高;不同抗氧化剂作用细胞后细胞内线粒体膜电位下降。随着SOD浓度增大,红色荧光减弱,绿色荧光增强(图6)。流式细胞术检测细胞凋亡显示,50 μmol/L H2O2组与对照组比较,差异具有统计学意义(P<0.05,图7);不同浓度SOD作用后,可诱导细胞凋亡,与50 μmol/L H2O2组比较,差异具有统计学意义(P<0.05,图7)。
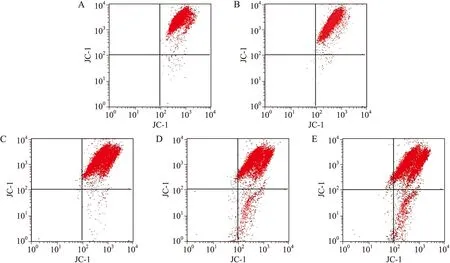
图6 不同浓度SOD作用后U937细胞线粒体膜电位变化
Fig.6 Mitochondrial membrane potential changes of U937 cells treated with different concentrations of SOD
A:对照组;B:50 μmol/L H2O2;C:50 μmol/L H2O2+20 U/L SOD;D:50 μmol/L H2O2+100 U/L SOD;E:50 μmol/L H2O2+300 U/L SOD。
2.7 EdU检测不同浓度SOD作用后U937细胞增殖变化
EdU检测细胞增殖中,红色荧光代表新合成的DNA,蓝色荧光代表Hoechst染色后的细胞核。与正常U937细胞增殖相比较,50 μmol/L H2O2作用于U937细胞后细胞增殖旺盛,红色荧光较多,即新合成的DNA多。给予不同浓度抗氧化剂后细胞增殖减慢,红色荧光减弱,新合成的DNA减少。随着SOD浓度增大,红色荧光减弱,表明SOD抑制50 μmol/L H2O2处理后U937细胞DNA合成(图8)。50 μmol/L H2O2组的EdU标记U937细胞增殖与对照组比较,差异具有统计学意义(P<0.05,图9);与50 μmol/L H2O2比较,不同浓度SOD作用后细胞增殖差异有统计学意义(P<0.05,图9)。
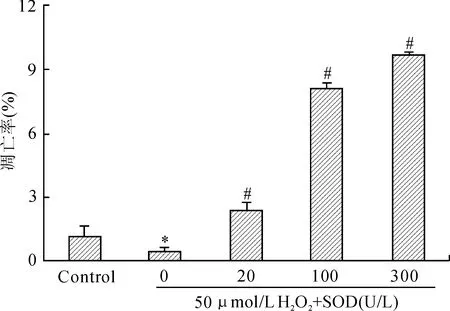
图7 不同浓度SOD作用后U937细胞的早期凋亡率
Fig.7 Early apoptosis rate of U937 cells treated with different concentrations of SOD
与对照组(control)比较,*P<0.05 ;与50 μmol/L H2O2组比较,#P<0.05。
3 讨 论
有研究表明细胞的存亡取决于氧化还原微环境中的ROS水平。低水平的ROS能促进细胞增殖,亚致死水平的ROS导致正常或癌前细胞DNA损伤从而促进恶变,而过高的ROS水平可促进氧化应激导致细胞死亡[10-11]。本实验通过不同浓度H2O2作用于急性单核细胞白血病U937细胞株,经MTT法、光学显微镜观察发现低浓度(50 μmol/L)H2O2刺激U937细胞增殖,活细胞数量增多,而200 μmol/L H2O2诱导U937细胞凋亡,随着H2O2浓度增大至大于500 μmol/L时,表现出细胞毒性作用,细胞变形并出现细胞碎片,死亡细胞明显增多。进一步证实了H2O2对细胞的增殖呈现出低浓度促进、高浓度抑制的双向调节作用[10-11]。通过给予U937细胞不同浓度H2O2作用不同时间,检测U937细胞内ROS含量的变化发现,随H2O2浓度增大,时间延长,细胞内ROS含量不断增加。同时电镜观察发现正常U937细胞呈圆形,外观规则,细胞表面突起,核浆比例高,核染色质丰富、分布均匀。细胞质内有较多细胞器,线粒体形态规则,结构完整。50 μmol/L H2O2处理U937细胞后细胞数量多,大小均匀,呈圆形,线粒体肿胀,嵴排列紊乱,部分可见嵴溶解,染色质轻度凝集。这与前期研究中,透射电镜观察初发、复发M5患者外周血单个核细胞线粒体结构变化一致[5]。因此,我们用低浓度H2O2刺激U937细胞增殖模拟急性单核细胞白血病M5复发时的高增殖状态。
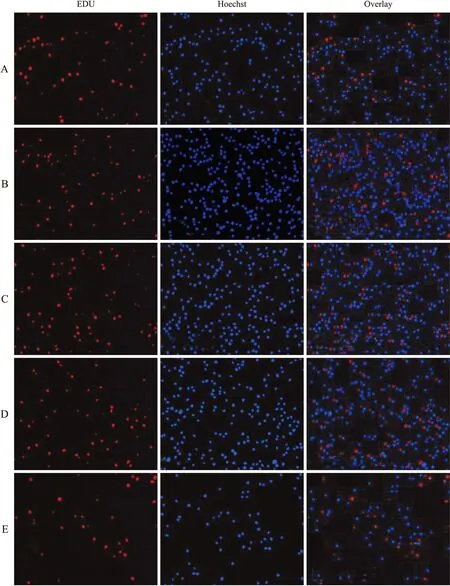
图8 EdU检测U937细胞增殖荧光图
Fig.8 U937 cell proliferation fluorescence diagram by EdU
A:对照组;B:50 μmol/L H2O2;C:50 μmol/L H2O2+20 U/L SOD;D:50 μmol/L H2O2+100 U/L SOD;E:50 μmol/L H2O2+300 U/L SOD。

图9 EdU标记U937细胞增殖变化
Fig.9 U937 cell proliferation changes by EdU marker
与对照组比较,*P<0.05;与50μmol/L H2O2组比较,#P<0.05。
我们的前期研究发现,急性单核细胞白血病患者细胞内产生大量ROS,随着细胞内ROS含量的升高,氧化能力增强,细胞内抗氧化物酶清除过量ROS,消耗了抗氧化物酶,机体的抗氧化防御能力减弱,而化疗缓解患者体内抗氧化物酶活性相比原发组、复发组升高,但仍低于正常对照组,表明血浆中抗氧化物酶的活性与病情有关[5]。且有研究表明给予抗氧化剂消除过多ROS可逆转过多ROS引起的细胞衰老和细胞功能下降[12]。本实验选用抗氧化剂SOD,发现其对增多的ROS引起增殖旺盛的U937细胞有增殖抑制作用。
SOD是一种内源性抗氧化剂,能抵御O2-·对细胞的破坏。外源性SOD可能通过强化机体抗氧化保护系统而达到有效的保护作用。有文献报道SOD基因的低表达参与多种肿瘤的发生,维持其恶性增殖,SOD可能与抑制恶性肿瘤的发生发展有关[13]。
线粒体是细胞内重要的细胞器,合成能量并参与细胞凋亡。细胞凋亡过程中,线粒体膜电位(ΔΨm)会发生变化。可以通过线粒体ΔΨm观察线粒体通透性,并能很好地评价线粒体的功能[14-15],当细胞受到损害时,MPTP开放,造成线粒体ΔΨm下降和细胞内生物合成破坏,细胞能量代谢障碍,并通过ROS产生、氧化磷酸化及钙稳态失调等多种途径进一步引起细胞损伤。可见检测线粒体膜电位的变化具有重要意义[16]。JC-1是近年来发现的一种高度特异性的线粒体荧光染料,对ΔΨm具有更高的敏感性,特异性更强,结果更可靠[17]。5-乙炔基-2,脱氧尿嘧啶核苷( EdU)是一种胸腺嘧啶核苷类似物,在细胞增殖时取代脱氧胸腺嘧啶核苷插入到新合成的DNA之中,可以高效、快速、准确地检测新合成的DNA,有效地检测S期细胞的百分比[18-19]。
本实验发现,正常的U937细胞内存在少量的ROS,线粒体膜电位低,即正常U937细胞存在少量凋亡细胞。50 μmol/L H2O2处理U937细胞后细胞内ROS含量增加,细胞增殖旺盛,线粒体膜电位升高,凋亡率减少,新合成的DNA增多。加入不同浓度SOD作用,结果显示随着SOD浓度的升高,ROS含量减少,表现出剂量依赖性,细胞内线粒体膜电位下降,细胞凋亡率增加,细胞增殖减慢,新合成的DNA减少。由此推断,50 μmol/L H2O2刺激细胞内ROS增多,增多的ROS刺激细胞增殖,给予抗氧化剂后,细胞内ROS含量减少,细胞增殖减慢,凋亡增加。
综上所述,低浓度H2O2刺激U937细胞增殖,考虑与细胞内ROS含量增加有关。抗氧化剂SOD对抗H2O2对U937细胞的增殖作用,其机制与减轻细胞内ROS水平、调节细胞内氧化还原水平有关。这提示当白血病细胞内活性氧产生过量时,补充外源性的抗氧化剂可以弥补细胞内源性抗氧化能力的不足并清除活性氧,抑制细胞增殖。因此,抗氧化剂有望成为治疗白血病的有效药。
[1] FINKEL T. Oxidant signals and oxidative stress[J]. Curr Opin Cell Biol, 2003, 15(2):247-254.
[2] ZHANG Y, DU Y, LE W, et al. Redox control of the survival of healthy and diseased cells[J]. Antioxid Redox Signal, 2011, 15(11):2867-2908.
[3] D’AUTREAUX B, TOLEDANO MB. ROS as signalling molecules: mechanisms that generate specificity in ROS homeostasis[J]. Nat Rev Mol Cell Biol, 2007, 8(10):813-824.
[4] DICKINSON BC, CHANG CJ. Chemistry and biology of reactive oxygen species in signaling or stress responses[J]. Nat Chem Biol, 2011,7(8):504-511.
[5] 白改改,路晨阳,申秋菊,等. 氧自由基在急性单核细胞白血病发病中的作用[J]. 西安交通大学学报(医学版), 2015, 36(4):501-504.
[6] NIEBOROWSKA-SKORSKA M, KOPINSKI PK, RAY R, et al. Rac2-MRC-cIII-generated ROS cause genomic instability in chronic myeloid leukemia stem cells and primitiveprogenitors[J]. Blood, 2012, 119(18):4253-4263.
[7] ZHOU F, SHEN Q, CLARET FX. Novel roles of reactive oxygen species in the pathogenesis of acute myeloid leukemia[J]. J Leukoc Biol, 2013, 94(3):423-429.
[8] ZHOU FL, ZHANG WG, WEI YC, et al. Involvement of oxidative stress in the relapse of acute myeloid leukemia[J]. J Biol Chem, 2010, 285(20):15010-15015.
[9] REDDY MM, FERNANDES MS, SALQIA R, et al. NADPH oxidases regulate cell growth and migration in myeloid cells transformed by oncogenic tyrosine kinases[J]. Leukemia, 2011, 25(2):281-289.
[10] CAIRNS RA, HARRIS IS, MAK TW. Regulation of cancer cell metabolism[J]. Nat Rev Cancer, 2011, 11(2):85-95.
[11] TOYOKUNI S. Novel aspects of oxidative stress-associated carcinogenesis[J]. Antioxid Redox Signa, 2006, 8(7-8):1373-1377.
[12] JEONG SG, CHO GW. Endogenous ROS levels are increased in replicative senescence in human bone marrow mesenchymal stromal cells[J]. Biochem Biophys Res Commun, 2015, 460(4):971-976.
[13] BRAVARD A, SABATIER L, HOFFSCHIR F, et al. SOD2: a new type of tumor-suppressor gene?[J]. Int J Cancer, 1992, 51(3):476-480.
[14] BURDON RH. Superoxide and hydrogen peroxide in relation to mammalian cell proliferation[J]. Free Radic Biol Med, 1995, 18(4):775-794.
[15] CHENAIS B, ANDRIOLLO M, GUIRAUD P, et al. Oxidative stress involvement in chemically induced differentiation of K562 cells[J]. Free Radic Biol Med, 2000, 28(1):18-27.
[16] GEIGER LK, KORTUEM KR, ALEXEJUN C, et al. Reduced redox state allows prolonged survival of axotomized neonatal retinal ganglion cells[J]. Neuroscience, 2002, 109(3):635-642.
[17] PROVINCIALI M, DONNINI A, ARGENTATI A, et al. Reactive oxygen species modulate Zn(2+)-induced apoptosis in cancer cells[J]. Free Radic Biol Med, 2002, 32(5): 431-445.
[18] ZENG C, PAN F, JONES LA, et al. Evaluation of 5-ethynyl-2'-deoxyuridine staining as a sensitive and reliable method for studying cell proliferation in the adult nervous system[J]. Brain Res, 2010, 1319:21-32.
[19] YU Y, ARORA A, MIN W, et al. EdU incorporation is an alternative non-radioactive assay to [(3)H]thymidine uptake for in vitro measurement of mice T-cell proliferations[J]. J Immunol Methods, 2009, 350(1/2):29-35.
(编辑 国 荣)
Effect of antioxidants on the proliferation of acute monocytic leukemia cells treated with hydrogen peroxide
LU Chen-yang1, BAI Gai-gai1, SHEN Qiu-ju1, MENG Shan1, HUI Ling-yun2,SU Dan1, ZHANG Wang-gang1, ZHOU Fu-ling1
(1. Department of Hematology, the Second Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710004; 2. Clinical Laboratory,the First Affiliated Hospital of Xi’an Jiaotong University, Xi’an 710061, China)
Objective To observe the antioxidant effect on the proliferation of acute monocytic leukemia cells by establishing its reactive oxygen species (ROS) cell model. Methods U937 cell treated with different concentrations of hydrogen peroxide (H2O2) was used to establish ROS cell model. The proliferative cells were treated with various concentrations of antioxidant superoxide dismutase (SOD). We detected cell proliferation, intracellular content of ROS and mitochondrial membrane potential changes. Results (1) Low concentration of H2O2(50 μmol/L) stimulated the proliferation of U937 cells while high concentration of H2O2(500 μmol/L) produced a toxic effect on the cells. U937 cells were treated with 50 μmol/L of H2O2for 48 hours to establish the experimental model. (2) U937 cells contained a small amount of ROS and apoptotic cells; after 50 μmol/L H2O2treatment, the content of intracellular ROS, the mitochondrial membrane potential, cell proliferation and the newly synthesized DNA were increased, but the apoptosis rate declined. After treatment with various concentrations of antioxidants superoxide dismutase (SOD), the content of intracellular ROS, the mitochondrial membrane potential and the newly synthesized DNA decreased, and cell proliferation slowed down while the apoptosis rate was increased, which showed a dose-dependent manner. Conclusion Antioxidants can inhibit the proliferation of acute monocytic leukemia cells in a dose-dependent manner.
acute monocytic leukemia; reactive oxide species (ROS); antioxidant; cell proliferation; mitochondrial membrane potential; superoxide dismutase (SOD)
2015-05-22
2015-09-17
国家自然科学基金资助项目(No.81270597);2011年中央高校基本科研业务费专项资金资助项目(No.0602-08143041) Supported by the National Natural Science Foundation of China (No.81270597) and the Fundamental Research Funds for the Central Universities in 2011(No.0602-08143041)
周芙玲. E-mail: zhoufuling@163.com
R733.7
A
10.7652/jdyxb201601007
优先出版:http://www.cnki.net/kcms/detail/61.1399.R.20151208.1653.004.html(2015-12-08)

