PLGA及PLGA-PEG-PLGA水凝胶的制备
刘 迪,黄晓英,何旭敏,林 旭*,夏海平*(.厦门大学化学化工学院,福建厦门36005;.厦门普瑞安生物科技有限公司,福建厦门36000)
PLGA及PLGA-PEG-PLGA水凝胶的制备
刘 迪1,黄晓英2,何旭敏1,林 旭2*,夏海平1*
(1.厦门大学化学化工学院,福建厦门361005;2.厦门普瑞安生物科技有限公司,福建厦门361000)
摘要:本研究通过控制反应操作条件,优化了聚乳酸乙醇酸(PLGA)的合成工艺,缩短了制备时间,并能通过控制反应时间制备预期相对分子质量的PLGA;同时优化后的处理工艺,降低了溶剂残留毒害等级.还将不同相对分子质量PLGA(Mn≥2 000)与系列相对分子质量聚乙二醇(PEG)共聚,合成具有溶液-凝胶转换特性的PLGA-PEG-PLGA三嵌段共聚物,得到对应组成搭配规律,测出了相应水凝胶特性相图.
关键词:聚乳酸乙醇酸(PLGA);聚乙二醇(PEG);优化;PLGA-PEG-PLGA;三嵌段共聚物;水凝胶
聚乳酸乙醇酸(PLGA)是乳酸(LA)与乙醇酸(GA)经聚合反应而成的共聚物,是一种重要的生物降解材料,具有无毒、良好的生物相容性等特点,在药物传输、基因治疗、医用纤维材料等领域得到越来越广泛的应用[1-5];且已获美国食品药品管理局(FDA)认证,被正式作为药用辅料收录进美国药典.
在国内外已报道的PLGA制备方法中,开环聚合法、溶液聚合法及固相聚合法,均有各自的缺点[6-10].相对而言,熔融聚合法因具有简单易行、毒害性小等优点,近年来已逐渐被采用[11-13].但是,熔融聚合法存在着制备时间长、合成成本较高等问题,亟待解决.目前,采用熔融聚合法可控地制备出不同相对分子质量PLGA的研究尚未见报道.本文通过控制反应条件,优化PLGA熔融聚合工艺,不仅缩短了PLGA合成时间,而且得到通过调控反应时间制备各相对分子质量PLGA的规律.并在后处理工艺中:使用毒害等级较低的丙酮取代三氯甲烷作为提纯溶剂,降低溶剂残留毒害等级;确定真空干燥过程的操作参数,解决溶剂残留问题.
在PLGA应用中,PLGA与聚乙二醇(PEG)聚合形成的PLGA-PEG-PLGA三嵌段共聚物作为当今生物高分子水凝胶材料研究热点受到广泛关注[14-16].已报道的PLGA-PEG-PLGA三嵌段共聚物水凝胶制备研究中,主要考察的是较小相对分子质量PLGA(n≤1 600)与较小相对分子质量PEG(n≤1 500)的共聚,而且是以固定相对分子质量PEG为中心,共聚接上PLGA[17-18].本文考察了以不同相对分子质量PLGA(n≥2 000)为研究主体,用系列相对分子质量PEG(n≥2 000)与之进行共聚,得到可以形成水凝胶的PLGA-PEG-PLGA三嵌段共聚物,并得出PLGA与PEG不同相对分子质量的搭配规律;进而测出各搭配合成的PLGA-PEG-PLGA三嵌段共聚物水溶液相图,得到相应溶液-凝胶转变范围.此项研究可为药物载体缓释应用提供依据.
1 实验部分
1.1试 剂
L-LA,85%~90%水溶液;GA,98%白色固体粉末;PEG(PEG2000、PEG6000、PEG8000、PEG10000、PEG20000),以上均为分析纯,阿拉丁试剂(上海)有限公司;SnCl2·2H2O,98%无色颗粒,优级纯,安耐吉化学(上海)有限公司;甲基磺酸(MSA),99%微棕色油状液体,优级纯,安耐吉化学(上海)有限公司.上述百分数均为质量分数.
1.2仪 器
傅里叶变换红外光谱仪(FT-IR):Nicolet Avatar 330,美国热电公司;核磁共振波谱仪(NMR):Avance Ⅲ400 MHz,瑞士Bruker公司;凝胶渗透色谱(GPC):Waters 1515,美国Waters公司,色谱柱(StyragelRHT,3根,流动相为四氢呋喃(THF),有效相对分子质量范围分别为500~20 000,5 000~ 60 000,50 000~4 000 000);紫外-可见分光光度计(UV-Vis):UV-2100,日本岛津公司;同步热分析仪(SDT):SDT Q600,美国TA仪器公司;智能释放试验仪:ZRS-8GD,天津市天大天发科技有限公司.
1.3PLGA的合成优化
制备预期相对分子质量PLGA:按摩尔比1∶1称取一定量的L-LA和GA加入到100 m L三口烧瓶中,加热进行磁力搅拌.抽取真空,在140℃、4 k Pa下,除水1 h;加入催化剂SnCl2·2 H2O(终质量分数0.5%),提高反应温度至165℃,并在1 h内逐渐抽取真空至400 Pa;保持165℃不变,调节压力为70 Pa,在该条件下反应若干小时.
短时间制备较大相对分子质量PLGA:在上述165℃、400 Pa下反应2 h后,加入催化剂MSA(终质量分数0.3%),提高反应温度至175℃,继续抽取真空至70 Pa,反应2 h.
后处理:经过合成得到预期PLGA粗产物后,需要进行提纯工艺:将反应产物先溶解在良性溶剂中,再在PLGA非良性溶剂中沉淀,得到较为纯净的PLGA产品.Wang等[19]、Lan等[20]在制备PLGA的后处理中,均使用三氯甲烷溶解反应产物.三氯甲烷被美国FDA列为第2类应限制溶剂,考虑到PLGA在医药工程领域的应用[1-5],从健康和安全性角度对后处理工艺进行优化很有必要.研究表明,丙酮是合成PLGA反应产物的良性溶剂,且丙酮为第3类低毒性溶剂,所以,本文用丙酮代替三氯甲烷作为提纯工艺的溶解溶剂.将上述2种合成方法制备的PLGA粗产物,在真空中冷却至常温,加入一定量丙酮搅拌溶解,并在无水乙醚中沉淀,去除上清液后用一定量丙酮溶解,再于无水乙醚中沉淀,反复3次;然后在110℃、2 k Pa下真空干燥11 h,得到PLGA产品.
1.4大分子PLGA-PEG-PLGA合成
按摩尔比2∶1称取已知相对分子质量PLGA和相应相对分子质量PEG,加入到50 m L三口烧瓶中,在常压下通入氮气,磁力搅拌下加热至160℃,反应8 h.得到不同相对分子质量匹配下的PLGA-PEG-PLGA三嵌段共聚物粗产品,氮气氛围下冷却至室温,用一定量冷水溶解,加温至75℃沉淀,去除上清液,再用冷水溶解,加热至75℃沉淀,反复3次.再于-18℃下冷冻3~4 h,35℃真空干燥,得到纯净的PLGAPEG-PLGA三嵌段共聚物.
1.5PLGA-PEG-PLGA水溶液制备
将上述每种PLGA-PEG-PLGA置于带盖玻璃试管中,用2~4℃的去离子水分别配制质量分数为10%,15%,25%,35%,45%的水溶液,保存在2~4℃冰箱中,待测.
1.6表征测试
1.6.1PLGA表征
FT-IR表征:溴化钾压片法;NMR表征:氘代三氯甲烷(CDCl3)或氘代二甲基亚砜(DMSO-d6)为溶剂,400 MHz;GPC测试:以THF为溶剂,聚苯乙烯为标样,柱温35℃,流速1 m L/min.
1.6.2PLGA-PEG-PLGA三嵌段聚合物表征
SDT测定:氮气氛围,升温速率为10℃/min,升温范围为20~300℃.
溶液-凝胶转变相图测试:试管倒置法.将冷藏的不同质量分数PLGA-PEG-PLGA水溶液于水浴中加热,从20℃以2℃/步的速率梯度升温至76℃,各温度点恒温15 min,然后将试管倒置30 s,观察试管中水溶液现象.若试管倒置中水溶液没有流下,则判定为水溶液转变为凝胶态,记录该温度及在该温度下发生溶液-凝胶转变的相应水溶液质量分数,绘制溶液-凝胶转变相图.
2 结果与讨论
2.1优化制备的PLGA表征
2.1.1FT-IR谱图检测分析
图1所示为L-LA与GA物理混合样、优化制备的PLGA以及购买参比样PLGA的FT-IR谱图.图中1 732 cm-1归属于L-LA与GA物理混合样中L-LA 与GA羧基的羰基(—CO)吸收峰,1 756 cm-1归属于PLGA中酯基的羰基(—CO)吸收峰.产物中1 756 cm-1吸收峰的出现,表明L-LA和GA的羧基、羟基发生了反应.对比优化制备的PLGA与购买参比样PLGA的FT-IR谱图,其特征峰及指纹区一致,表明优化制备的PLGA是合格的.
优化制备PLGA过程中,不同反应时间得到的PLGA、优化条件短时间制备的PLGA与参比样的红外谱图特征峰及指纹区均一致.与图1中相同,测得的系列谱图中,1 756 cm-1吸收峰为L-LA和GA中羧基、羟基反应生成酯基的羰基(—CO)吸收峰,说明优化条件制备的PLGA品质可靠.
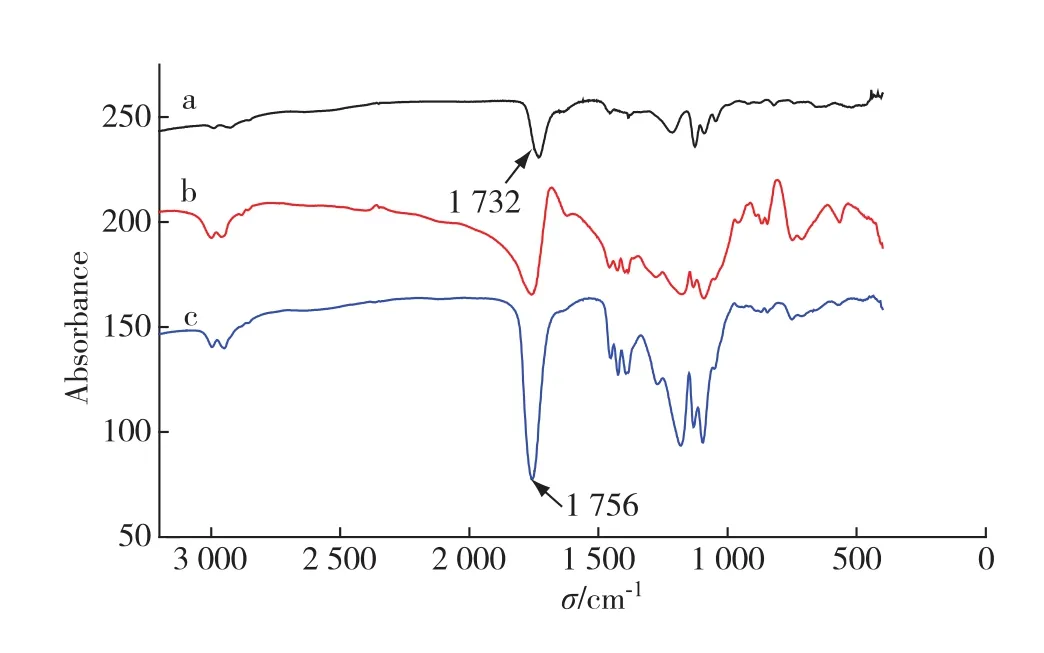
图1 L-LA与GA物理混合样(a)、参比样PLGA(b)及制备的PLGA(c)的FT-IR谱图Fig.1 Infrared spectra of mixed sample L-LA+GA(a), standard sample PLGA(b)and maded PLGA(c)
2.1.2NMR谱图检测分析
PLGA制备后处理工艺未优化之前,以三氯甲烷作为制备PLGA后处理溶剂,得到的PLGA产品中残留有三氯甲烷,如图2谱线a,1H-NMR谱图中化学位移δ=8.32处为三氯甲烷杂质峰;用丙酮替代三氯甲烷作为后处理溶剂,在常温真空干燥条件下,得到的PLGA产品中也会残留有丙酮,如图2谱线b,1HNMR谱图中化学位移δ=2.09处为丙酮杂质峰;经过实验探究,得到经提纯、沉淀后的PLGA产品在110℃、2 k Pa真空干燥11 h后,不会再存在溶剂杂质,如图2谱线c,1H-NMR谱图上没有出现δ=2.09处丙酮溶剂峰,表明该制备后处理条件可以解决溶剂残留问题.
2.1.3GPC检测分析
表1是不同反应时间下得到的PLGA的GPC测试结果.结果表明,随着反应时间的增加,PLGA的相对分子质量逐渐上升,这与羧基和羟基缩聚反应过程机理是一致的.随着反应的进行,羧基和羟基不断反应,合成的PLGA链不断增长,其相对分子质量也不断增加.因此,可以通过控制反应时间得到不同相对分子质量的PLGA,实现PLGA相对分子质量的可控化.
在此基础上,加入催化剂MSA(质量分数0.3%),提高反应温度至175℃,继续抽取真空至70 Pa,反应只需要2 h就可以得到较大相对分子质量PLGA(n=20 000)产物,与已有报道的反应时间(≥15 h)[10-13]相比,极大地缩短了反应时间.

图2 制备工艺优化后处理PLGA产品的1H-NMR谱图(400 MHz,DMSO-d6)Fig.21H-NMR spectra(400 MHz,DMSO-d6)of post-processing PLGA product preparation technology optimization
2.2PLGA-PEG-PLGA三嵌段共聚物表征
2.2.1SDT法表征嵌段结构
将合成的不同相对分子质量的PLGA-PEGPLGA三嵌段共聚物分别进行热重分析(TGA),得到的图形基本一致(如图3).结果表明,合成的共聚物有明显的双峰,分别在299.3和377.9℃.TGA曲线出现双峰,可以判定为2种情况:检测共聚物是嵌段共聚物或接枝共聚物,而由PLGA与PEG反应化学结构来看,形成的共聚物不可能得到接枝结构,则可以判断形成的PLGA-PEG-PLGA为嵌段共聚物.
2.2.2NMR表征三嵌段结构
测得PEG及PEG与PLGA共聚产物的1H-NMR谱图如图4.谱线a中,δ=2.45处为PEG两端羟基氢(—OH)的峰;PLGA与PEG共聚产物中,出现了PEG与PLGA反应产生的酯基,其旁边的亚甲基质峰位于谱线b中δ=4.25处,同时未出现PEG两端羟基峰.证实了PEG与PLGA共聚产物中PEG两端的羟基均与PLGA进行了酯化反应,形成了PLGA-PEG-PLGA三嵌段共聚物.
2.2.3水溶液的溶液-凝胶转变特性测试
通过试管倒置法,可以观测PLGA-PEG-PLGA三嵌段共聚物水溶液的凝胶化过程,以及在凝胶化过程中存在的状态.结果表明,对于n≥2 000的PLGA,与之搭配合成PLGA-PEG-PLGA三嵌段共聚物水溶液,在温度变化中能够凝胶化的PEG相对分子质量有一定规律,即PEG相对分子质量应为PLGA相对分子质量的3~4倍,如n=2 000的PLGA,只有用PEG6000~PEG8000与之搭配合成的PLGAPEG-PLGA三嵌段聚合物水溶液才能出现溶液-凝胶转化的现象.不同相对分子质量的PLGA与PEG搭配及溶液-凝胶转变情况见表2.
PLGA的相对分子量大小直接影响该共聚物在水介质中的降解速率,较小的PLGA所制备的PLGA-PEG-PLGA三嵌段共聚物在水介质中降解较慢,如n<2 000的PLGA与PEG合成的PLGAPEG-PLGA三嵌段共聚物水解时间过慢(1个月)[21],影响载药释放效果.本文研究的n≥2 000 PLGA与PEG合成的PLGA-PEG-PLGA三嵌段共聚物,根据表2中PLGA与PEG相对分子质量的搭配规律,可控地制备特定相对分子质量的PLGAPEG-PLGA,使得到的药物辅料具有临床所需的药物缓释周期.

表1 不同反应时间PLGA产品的GPC测试结果Tab.1 GPC results of PLGA in different reaction time

图3 PLGA-PEG-PLGA的TGA曲线Fig.3 TGA of PLGA-PEG-PLGA copolymers

图4 PEG(a)及PEG与PLGA共聚产物(b) 的1H-NMR谱图(400 MHz,CDCl3)Fig.41H-NMR spectra(400 MHz,CDCl3)of PEG(a) and copolymerization product of PEG with PLGA(b)
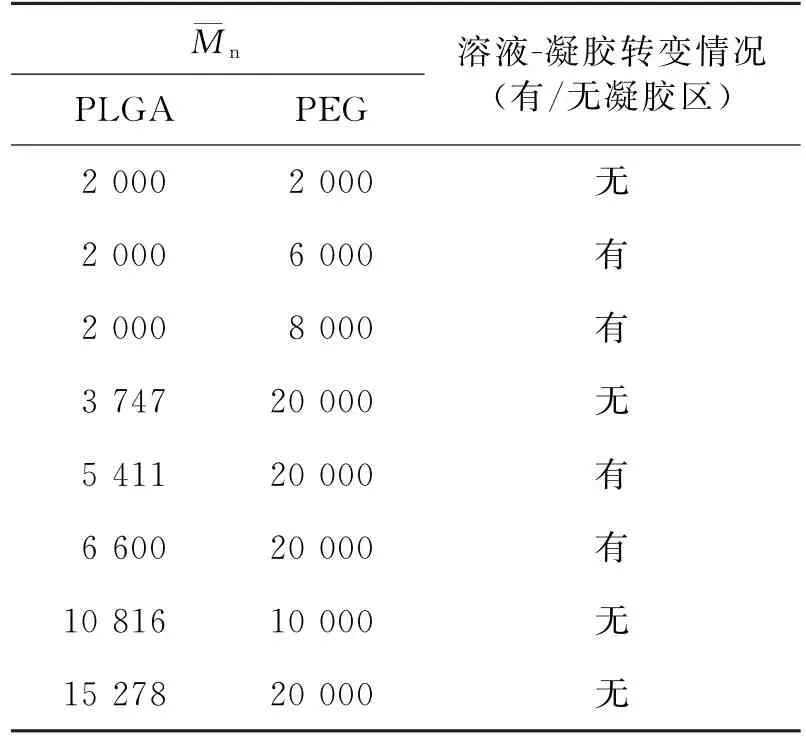
表2 不同相对分子质量PLGA与PEG搭配及溶液-凝胶转变情况Tab.2 Allocation and results of different molecular weight PLGA matching with PEG
2.2.4相图绘制
根据该相图规律,可控制相应水凝胶在载药使用中,在较低温度即溶液态下配制药剂,而在凝胶区温度时施用药剂,使之呈凝胶态,便于操作.
3 结 论
本研究通过调控熔融聚合制备PLGA工艺中的操作条件,对PLGA制备工艺进行了优化,确定了在短时间内得到较大相对分子质量PLGA的操作条件,通过控制反应时间,制备预期大小的相对分子质量PLGA,优化了制备后处理工艺,为PLGA制备提供直接指导.

图5 不同相对分子质量组成的PLGA-PEG-PLGA三嵌段共聚物水溶液相图Fig.5 Phase diagram of different molecular weight of PLGA-PEG-PLGA
参考文献:
[1] PAN Z,DING J D.Poly(lactide-co-glycolide)porous scaffolds for tissue engineering and regenerative medicine [J].Interface Focus,2012,2(3):366-377.
[2] BELOTI M M,SICCHIERI L G,DE OLIVEIRA P T,et al.The influence of osteoblast differentiation stage on bone formation in autogenously implanted cell-based poly (lactide-co-glycolide)and calcium phosphate constructs [J].Tissue Eng A,2012,18(9/10):999-1005.
[3] MCUSIC A C,LAMBA D A,REH T A.Guiding the morpho-genesis of dissociated newborn mouse retinal cells and hES cell-derived retinal cells by soft lithographypatterned microchannel PLGA scaffolds[J].Biomaterials, 2012,33(5):1396-1405.
[4] IM G I,KIM H J,LEE J H.Chondrogenesis of adiposestem cells in a porous PLGA scaffold impregnated with plasmid DNA containing SOX trio(SOX-5,-6 and -9)genes[J].Biomaterials,2011,32(19):4385-4392.
[5] KASUYA J,SUDO R,TAMOGAMI R,et al.Reconstruction of 3D stacked hepatocyte tissues using degradable,micro-porous poly(D,L-lactide-co-glycolide)membranes[J].Biomaterials,2012,33(9):2693-2700.
[6] DONG C M,QIU K Y,GU Z W,et al.Synthesis of poly (D,L-lactic acid-alt-glycolic acid)from D,L-3-methylglycolide[J].Journal of Polymer Science,Part A:Polymer Chemistry,2000,38(23):4179-4184.
[7] AJIOKA M,ENOMOT O K,YAMAGUCHI A.Basic properties of polylactic acid produced by the direct condensation polymerization of lactic acid[J].Bull Chem Soc Jpn,1995,68:2125-2131.
[8] AJIOKA M,SUIZU C,HIGUCHI C,et al.Aliphatic polyesters and their copolymers synthesized through direct condensation polymerization[J].Polymer Degradation and Stability,1998,59:137-143.
[9] 吴颖,郭士明,唐闻.生物降解聚酯:聚乙丙交酯的合成研究及应用[J].化工新型材料,2000,28(1):22-24.
[10] 吕莉,丁晓慧,林国良.聚乳酸乙醇酸的固相聚合研究[J].厦门大学学报(自然科学版),2013,52(5):655-659.
[11] MOON S I,DEGUCHI K,MIYAMOTO M,et al.Synthesis of polyglactin by melt/solid polycondensation of glycolic/L-lactic acids[J].Polym Int,2004,53(3): 254-258.
[12] WANG Z Y,ZHAO Y M,WANG F,et al.Syntheses of poly(lactic acid-co-glycolic acid)serial biodegradable polymer materials via direct melt polycondensation and their characterization[J].J Appl Polym Sci,2006,99 (1):244-252.
[13] 吴维芬,张超,黄永毅,等.无催化剂直接熔融缩聚合成聚乳酸-乙醇酸[J].厦门大学学报(自然科学版),2010, 49(3):382-385.
[14] ZHAO J,GUO B,MA P X.Injectable alginate microsphere/PLGA-PEG-PLGA composite hydrogels for sustained drug release [J].RSC Adv,2014,4(34): 17736-17742.
[15] YU L,XU W,SHEN W,et al.Poly(lactic acid-coglycolic acid)-poly(ethylene glycol)-poly(lactic acid-coglycolic acid)thermogel as a novel submucosal cushion for endoscopic submucosal dissection [J].Acta Biomater,2014,10(3):1251-1258.
[16] WHITE L J,KIRBY G T S,COX H C,et al. Accelerating protein release from microparticles for regenerative medicine applications[J].Mater Sci Eng C, 2013,33(5):2578-2583.
[17] NAGAHAMA K,KAWANO D,OYAMA N,et al.Selfassembling polymer micelle/clay nanodisk/doxorubicin hybrid injectable gels for safe and efficient focal treatment of cancer[J].Biomacromolecules,2015,16 (3):880-889.
[18] CHEN L,CI T,LI T,et al.Effects of molecular weight distribution of amphiphilic block copolymers on their solubility,micellization and temperature-induced sol-gel transition in water[J].Macromolecules,2014,47(17): 5895-5903.
[19] WANG Z,HOU X,AO Z,et al.Synthesis and characterization of biodegradable poly(lactic acid-co-glycine) via direct melt copolymerization[J].Iranian Polymer Journal,2008,17(10):791-798.
[20] LAN P,ZHANG Y,GAO Q,et al.Studies on the synthesis and thermal properties of copoly(L-lactic acid/ glycolic acid)by direct melt polycondensation[J].J Appl Polym Sci,2004,92(4):2163-2168.
[21] YU L,CHANG G T,ZHANG H,et al.Injectable block copolymer hydrogels for sustained release of a PEGylated drug[J].Int J Pharm,2008,348(1/2): 95-106.
Preparation of PLGA and PLGA-PEG-PLGA Hydrogels
LIU Di1,HUANG Xiaoying2,HE Xumin1,LIN Xu2*,XIA Haiping1*
(1.College of Chemistry and Chemical Engineering,Xiamen University, Xiamen 361005,China;2.Amoy PURUIAN Biotech Co.Ltd.,Xiamen 361000,China)
Abstract:In this study,an optimized process of poly(lactic-co-glycolic acid)(PLGA)preparation was reported,including shorting synthetic time to obtain PLGA with expected molecular weight,by controlling the reaction conditions of operation.An optimized process of its post-treatment was also investigated,reducing the residue-level of toxic organic solvent.Furthermore,this study was focused on co-polymerization of PLGA(n≥2 000)and polyethylene glycol(PEG)to form PLGA-PEG-PLGA triblock copolymers. The solution-gel conversion properties were characterized by their phase diagrams of the corresponding PLGA-PEG-PLGA aqueous solution.
Key words:PLGA;PEG;optimization;PLGA-PEG-PLGA;triblock copolymers;hydrogel
*通信作者:hpxia@xmu.edu.cn(夏海平);kevinlin1916@gmail.com(林旭)
收稿日期:2015-06-08 录用日期:2015-07-30
doi:10.6043/j.issn.0438-0479.2016.02.003
中图分类号:O 631
文献标志码:A
文章编号:0438-0479(2016)02-0162-06
引文格式:刘迪,黄晓英,何旭敏,等.PLGA及PLGA-PEG-PLGA水凝胶的制备[J].厦门大学学报(自然科学版),2016,55(2): 162-167.
Citation:LIU D,HUANG X Y,HE X M,et al.Preparation of PLGA and PLGA-PEG-PLGA hydrogels[J].Journal of Xiamen U-niversity(Natural Science),2016,55(2):162-167.(in Chinese)

